紫草素对大鼠慢性皮肤溃疡创面愈合及新生血管形成的促进作用及其机制
谢军,毛玉洁,王思宇,刘伟,刘刚
四川省医学科学院/四川省人民医院皮肤科,成都 610000
慢性皮肤溃疡是一种常见的外科疾病,病因多样,具有病程迁延、容易复发等特点,且伴发皮肤炎症,有致癌风险[1]。目前,慢性皮肤溃疡的治疗多以药物外用为主,尽管国内外相关研究较多,但尚未研制出一种高效、价廉、方便、无不良反应的药物[2-3]。中医对慢性皮肤溃疡的治疗积累了丰富的临床经验,发现了多种治疗药物,其中以紫草的疗效最为突出。紫草是紫草科紫草属多年生草本植物,具有解毒祛斑、清热消肿、治烫伤等功效,适用于斑疹、疮疡、湿疹、烫伤者,是中医治疗皮肤病的常用药物[4]。紫草素是由天然植物宗阜根中所提取的紫红色茶醌类天然色素,以紫草醌及其衍生物为主要成分,对促进皮肤溃疡愈合有重要作用,但其具体机制尚未明确。An等[5]报道,Notch1信号通路可调控炎症反应,而慢性皮肤溃疡以炎症为主要特征,因此,本研究基于Notch1信号通路分析紫草素对慢性皮肤溃疡的治疗作用及其机制,以期为紫草素的临床应用提供依据。
1 材料与方法
1.1 主要试剂及仪器 紫草素(HPLC≥98%,成都普菲德生物技术有限公司);重组牛碱性成纤维细胞生长因子凝胶(珠海亿胜生物制药有限公司,国药准字S20040001,规格21 000 U×5 g);CD34一抗(上海博湖生物科技有限公司);生物素标记的山羊抗兔IgG二抗(上海一基生物有限公司);羟脯氨酸(hydroxyproline,HyP)试剂盒(南京建成生物工程研究所);白细胞介素-8(interleukin-1,IL-8)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α) ELISA试剂盒(上海双赢生物科技有限公司);兔抗大鼠血管内皮细胞生长因子(vascular endothelial growth factor,VEGF)、转化生长因子-β1(transforming growth factor β1,TGF-β1)、Notch1、GAPDH一抗(美国Santa Cruz公司);辣根过氧化物酶标记的羊抗兔IgG二抗(上海古朵生物科技有限公司)。1658033型电泳仪(美国Bio-Rad公司)。
1.2 实验动物 SPF级健康雄性SD大鼠60只,7 周龄,体重2 6 0~2 7 0 g,由北京斯贝福生物技术有限公司提供[实验动物生产许可证号:SCXK(京)2019-0010]。实验开展前适应性饲养1 周,室温保持在2 2~2 4 ℃,相对湿度保持在40%~70%,光照按白昼夜间各12 h,饲喂全价颗粒料,自由摄食饮水。本研究经四川省医学科学院动物实验研究所批准(2019121309),实验过程符合国家和单位有关实验动物的管理及使用规定。
1.3 慢性皮肤溃疡大鼠模型的构建及分组 慢性皮肤溃疡模型构建[6]:取50只大鼠,戊巴比妥钠麻醉后,剃去背部长毛,在脱毛区域标记4 cm×4 cm造模面积,无菌条件下剪去造模区皮肤,深至筋膜,肌内注射氢化可的松60 mg/kg,筋膜下喷洒金黄色葡萄球菌1 ml,医用纱布覆盖创面,包扎固定,1周后形成慢性皮肤溃疡模型。余10只作为对照组,仅在相应部位分离皮瓣,原位缝合。造模成功标准:用大头针刺创面5 mm,无渗血且溃疡表面有肉芽组织生长,表示造模成功。共造模成功40只,随机分为模型组、阳性对照组及紫草素低、高剂量组,每组10只。
大鼠造模1周后开始给药:用生理盐水擦拭溃疡创面分泌物,清洁后给药,并用纱条覆盖。紫草素以大豆油稀释成4 mg/ml混悬液,4 ℃保存。紫草素低、高剂量组分别用4、8 mg/cm2紫草素混悬液均匀涂抹创面,阳性对照组用1890 U/cm2重组牛碱性成纤维细胞生长因子凝胶涂抹创面(具体给药剂量根据“人和动物体表面积折算的等效剂量比率表”换算),模型组与对照组给予等体积生理盐水外敷。每日换药1次,连续干预14 d。
1.4 大鼠皮肤溃疡创面愈合情况观察 干预第3、7、14天,用玻璃纸覆盖大鼠溃疡创面,划出溃疡面边缘,沿边剪下玻璃纸用电子天平(分度值0.1 mg)称重,按面积比值换算成溃疡面积(mm2),计算溃疡创面愈合率,重复测量3次。溃疡创面愈合率(%)=(用药前溃疡面积—用药后溃疡面积)/用药前溃疡面积×100%。
1.5 HE染色观察大鼠溃疡创面肉芽组织病理学变化 干预结束后,大鼠麻醉后断头处死,取腹主动脉血3 ml备用。用无菌手术器械分离溃疡创面肉芽组织,切取1 cm×1 cm组织包埋,其余部分液氮冷冻。切取的组织进行石蜡切片、HE染色,显微镜下观察溃疡创面肉芽组织毛细血管、炎性细胞、成纤维细胞等病理学变化。
1.6 免疫组化染色观察大鼠创面肉芽组织新生血管形成情况 取石蜡切片,0.01 mol/L PBS浸泡,加30% H2O2灭活内源性过氧化物酶,热修复抗原后,5% BSA封闭液封闭20 min,滴加CD34一抗(1:100) 4 ℃孵育过夜,滴加生物素标记的山羊抗兔IgG孵育30 min,PBS清洗,经DAB显色、苏木精复染、水洗返蓝、梯度乙醇脱水、二甲苯透明后,用中性树脂封片。利用纤维图像采集系统拍照,用Image-Pro Plus6.0图像分析软件分析蛋白表达强度,以棕黄色为阳性判断标准,测定积分光密度值(integrated option density,IOD)。
1.7 水解法检测大鼠创面肉芽组织中HyP含量 取30 mg液氮冷冻的创面肉芽组织,加碱水水解液1 ml混匀,95 ℃水解20 min,流水冷却后各管加pH液,将pH值调为6.0~6.8,管内液体变为黄绿色,加蒸馏水稀释至10 ml混匀,取4 ml稀释液加适量活性炭混匀,3500 r/min离心10 min,离心半径10 cm,取1 ml上清液按照HyP试剂盒说明书步骤测定HyP含量。
1.8 Western blotting检测大鼠创面肉芽组织中Notch1信号通路相关蛋白的表达 取0.1 g液氮冷冻的创面肉芽组织,冰上裂解,4 ℃下14 000 r/min离心30 min,离心半径10 cm,取上清,BCA法测定蛋白浓度。取20 μg蛋白上样,经10% SDS-PAGE电泳后,转至PVDF膜上;5%脱脂奶粉封闭1 h,加入兔抗大鼠VEGF(1:1000)、Notch1(1:1000)、TGF-β1(1:1000)、GAPDH(1:1000)一抗4 ℃孵育过夜;TBST洗膜,加入辣根过氧化物酶标记的羊抗兔IgG二抗(1:15 000)室温孵育1 h;TBST洗膜,ECL发光显色,用Gel-pro Application软件分析目的条带的灰度值。
1.9 ELISA法检测大鼠血清炎性因子水平 取大鼠腹主动脉血,3000 r/min离心20 min,离心半径10 cm,取上清分装在EP管内,-70 ℃保存,按照IL-8、TNF-α ELISA试剂盒说明书操作,采用酶标仪检测450 nm波长处的吸光度(OD)值,依据标准曲线计算血清IL-8、TNF-α水平。
1.10 统计学处理 采用SPSS 26.0软件进行统计分析。计量资料以表示,多组间比较采用单因素方差分析,进一步两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 各组大鼠皮肤溃疡创面愈合率比较 各组大鼠皮肤溃疡创面愈合率均随时间延长而增高,呈时间依赖性(P<0.05)。与模型组比较,阳性对照组及紫草素低、高剂量组干预第3、7、14天的皮肤溃疡创面愈合率增高(P<0.05);与阳性对照组比较,紫草素低、高剂量组干预第3、7、14天的皮肤溃疡创面愈合率降低(P<0.05);与紫草素低剂量组比较,紫草素高剂量组干预第3、7、14天的皮肤溃疡创面愈合率增高(P<0.05)(表1)。
表1 各组大鼠不同时间点皮肤溃疡创面愈合率比较(%,±s,n=10)Tab.1 Comparison of wound healing rate of skin ulcer in each group of rats at different time points (%, ±s, n=10)
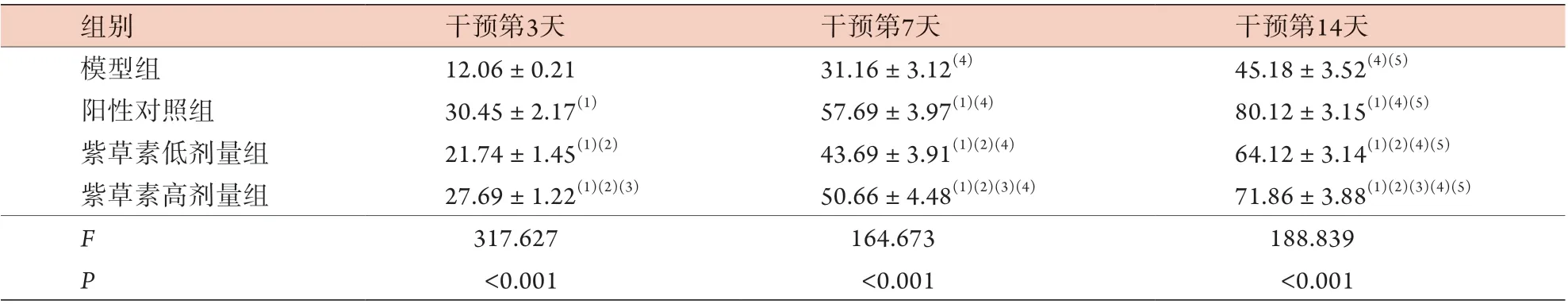
表1 各组大鼠不同时间点皮肤溃疡创面愈合率比较(%,±s,n=10)Tab.1 Comparison of wound healing rate of skin ulcer in each group of rats at different time points (%, ±s, n=10)
与模型组比较,(1)P<0.05;与阳性对照组比较,(2)P<0.05;与紫草素低剂量组比较,(3)P<0.05;与干预第3天比较,(4)P<0.05;与干预第7天比较,(5)P<0.05
组别干预第3天干预第7天干预第14天模型组12.06±0.2131.16±3.12(4)45.18±3.52(4)(5)阳性对照组30.45±2.17(1)57.69±3.97(1)(4)80.12±3.15(1)(4)(5)紫草素低剂量组21.74±1.45(1)(2)43.69±3.91(1)(2)(4)64.12±3.14(1)(2)(4)(5)紫草素高剂量组27.69±1.22(1)(2)(3)50.66±4.48(1)(2)(3)(4)71.86±3.88(1)(2)(3)(4)(5)F 317.627164.673188.839 P<0.001<0.001<0.001
2.2 各组大鼠溃疡创面肉芽组织病理学变化 HE染色结果显示,干预14 d后,模型组可见新生肉芽组织,伴有大量炎性细胞浸润;与模型组比较,紫草素低、高剂量组及阳性对照组可见陈旧性肉芽组织,炎性细胞浸润依次减轻(图1)。
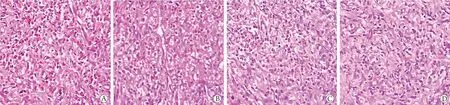
图1 各组大鼠溃疡创面肉芽组织病理学变化(HE ×200)Fig.1 Histopathological changes of ulcer wound in rats of each group (HE ×200)
2.3 各组大鼠溃疡创面肉芽组织中新生血管形成情况 免疫组化染色结果显示,模型组大鼠溃疡创面肉芽组织中C D 3 4 蛋白表达不明显。与模型组比较,紫草素低、高剂量组及阳性对照组C D 3 4 蛋白表达依次增强(图2),各组I O D 值差异有统计学意义(F=6 4 5 9.0 0 3,P<0.001)。与模型组(72 455.25±1421.12)比较,紫草素低剂量组(104 725.45±2062.45)、紫草素高剂量组(149 752.54±2441.86)和阳性对照组(197 585.23±2478.42)IOD值增高(P<0.05);与阳性对照组比较,紫草素低、高剂量组IOD值降低(P<0.05);与紫草素低剂量组比较,紫草素高剂量组IOD值增高(P<0.05)。

图2 各组大鼠溃疡创面肉芽组织新生血管形成情况(免疫组化 ×100)Fig.2 Neovascularization of ulcer wound in rats of each group (Immunohistochemical ×100)
2.4 各组大鼠溃疡创面肉芽组织中HyP含量比较水解法检测结果显示,与模型组[(2.15±0.11) μg/mg]比较,紫草素低剂量组[(3.62±0.12) μg/mg]、紫草素高剂量组[(4.94±0.15) μg/mg]和阳性对照组[(6.48±0.14) μg/mg]溃疡创面肉芽组织中HyP含量增高(P<0.05);与阳性对照组比较,紫草素低、高剂量组溃疡创面肉芽组织中HyP含量降低(P<0.05);与紫草素低剂量组比较,紫草素高剂量组溃疡创面肉芽组织中HyP含量增高(P<0.05)。
2.5 各组大鼠溃疡创面肉芽组织中Notch1信号通路相关蛋白的表达情况 Western blotting检测结果显示,与模型组比较,紫草素低、高剂量组大鼠溃疡创面肉芽组织中VEGF、TGF-β1蛋白相对表达量增高,Notch1蛋白相对表达量降低(P<0.05);与紫草素低剂量组比较,紫草素高剂量组大鼠溃疡创面肉芽组织中VEGF、TGF-β1蛋白相对表达量增高,Notch1蛋白相对表达量降低(P<0.05,图3、表2)。
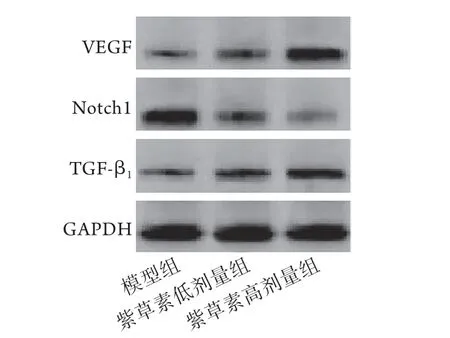
图3 Western blotting检测各组大鼠溃疡创面肉芽组织中Notch1信号通路相关蛋白的表达Fig.3 Notch1 signaling pathway related proteins in wound tissue of rats in each group (Western blotting)
表2 各组大鼠溃疡创面肉芽组织中Notch1信号通路相关蛋白的表达情况(±s,n=10)Tab.2 Expression of Notch1 signaling pathway related proteins in wound tissue of rats in each group (±s, n=10)

表2 各组大鼠溃疡创面肉芽组织中Notch1信号通路相关蛋白的表达情况(±s,n=10)Tab.2 Expression of Notch1 signaling pathway related proteins in wound tissue of rats in each group (±s, n=10)
VEGF. 血管内皮细胞生长因子;TGF-β1. 转化生长因子-β1;与模型组比较,(1)P<0.05;与紫草素低剂量组比较,(2)P<0.05
组别VEGFNotch1TGF-β1模型组0.25±0.030.95±0.090.27±0.02紫草素低剂量组 0.42±0.06(1)0.51±0.07(1)0.63±0.07(1)紫草素高剂量组 0.91±0.09(1)(2) 0.21±0.03(1)(2) 0.80±0.08(1)(2)F 279.603298.993187.778 P<0.001<0.001<0.001
2.6 各组大鼠血清炎性因子水平比较 ELISA检测结果显示,与对照组比较,模型组、阳性对照组及紫草素低、高剂量组大鼠血清IL-8、TNF-α水平增高(P<0.05);与模型组比较,阳性对照组及紫草素低、高剂量组大鼠血清IL-8、TNF-α水平降低(P<0.05);与阳性对照组比较,紫草素低、高剂量组大鼠血清IL-8、TNF-α水平增高(P<0.05);与紫草素低剂量组比较,紫草素高剂量组大鼠血清IL-8、TNF-α水平降低(P<0.05)(表3)。
表3 各组大鼠血清IL-8、TNF-α水平比较(pg/ml,±s,n=10)Tab.3 Comparison of levels of serum IL-8 and TNF-α in each group of rats (pg/ml, ±s, n=10)
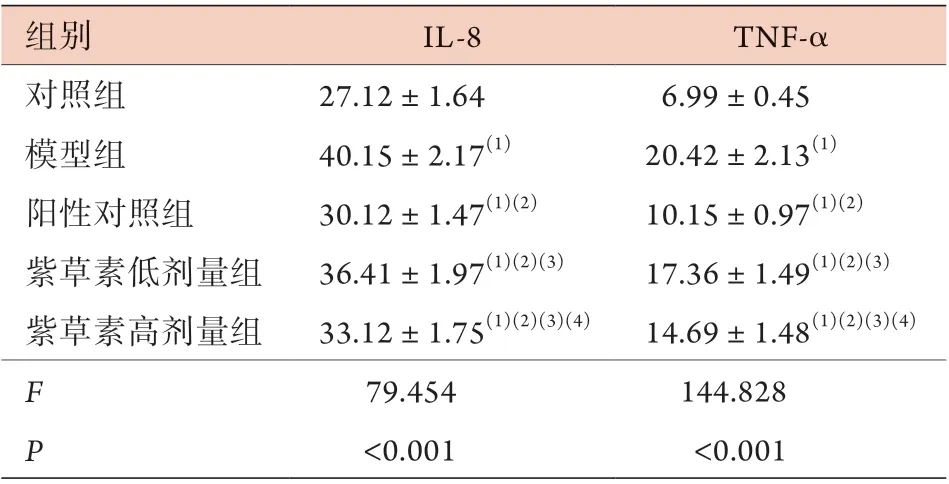
表3 各组大鼠血清IL-8、TNF-α水平比较(pg/ml,±s,n=10)Tab.3 Comparison of levels of serum IL-8 and TNF-α in each group of rats (pg/ml, ±s, n=10)
IL-8. 白细胞介素-8;TNF-α. 肿瘤坏死因子-α;与对照组比较,(1)P<0.05;与模型组比较,(2)P<0.05;与阳性对照组比较,(3)P<0.05;与紫草素低剂量组比较,(4)P<0.05
组别IL-8TNF-α对照组27.12±1.646.99±0.45模型组40.15±2.17(1)20.42±2.13(1)阳性对照组30.12±1.47(1)(2)10.15±0.97(1)(2)紫草素低剂量组36.41±1.97(1)(2)(3)17.36±1.49(1)(2)(3)紫草素高剂量组33.12±1.75(1)(2)(3)(4)14.69±1.48(1)(2)(3)(4)F 79.454144.828 P<0.001<0.001
3 讨 论
中医将慢性皮肤溃疡归属于“顽疮”范畴,是指皮肤黏膜溃破、组织坏死或骨骼损伤,反复迁移不愈并伴发感染[7]。中医外科学对体表溃疡累积了丰富的理论和经验,主张非手术治疗,即清创、控制感染、改善血液供应、促进肉芽组织生长和创面收缩等。紫草具有活血、凉血、解毒等功效,可用于血热毒盛、疮疡等的治疗[8]。现代药理学研究发现,从紫草中萃取的紫草素具有抗炎、杀菌等作用,临床用于皮肤科疾病的外治效果确切[9]。本研究探讨了紫草素在慢性皮肤溃疡治疗中的作用及其可能机制,为中医药研发奠定了理论基础。
溃疡创面愈合率是反映慢性皮肤溃疡疗效的最直观证据。本研究结果显示,与模型组比较,紫草素低、高剂量组皮肤溃疡创面愈合率增高,且紫草素高剂量组高于紫草素低剂量组,提示紫草素可促进大鼠皮肤溃疡创面愈合,且呈剂量依赖性。HE染色观察溃疡创面肉芽组织病理学变化可见,与模型组比较,紫草素低、高剂量组肉芽组织生长良好,炎性细胞浸润减少,进一步提示紫草素对于慢性皮肤溃疡具有较好的治疗效果及抗炎作用。IL-8为促炎因子,被认为是溃疡发生过程中不可或缺的炎性介质,其水平随病变范围扩大、病变程度加深而增高[10]。TNF-α是机体炎症及免疫反应的重要介质,Gourishetti等[11]发现,TNF-α水平异常升高是影响大鼠糖尿病足溃疡伤口愈合的重要因素。本研究结果显示,与对照组比较,模型组大鼠血清IL-8、TNF-α水平增高,提示慢性皮肤溃疡大鼠存在炎症;与模型组比较,紫草素低、高剂量组大鼠血清IL-8、TNF-α水平降低,提示紫草素具有抗炎作用,可降低大鼠血清炎性因子水平。皮肤细胞外间质主要成分为胶原,而HyP是胶原的主要成分,可作为衡量胶原组织代谢水平的指标,在创伤愈合期间,胶原合成与分泌是促进伤口愈合的决定性因素,检测HyP含量可反映伤口愈合的程度[12]。本研究结果显示,与模型组比较,紫草素低、高剂量组创面肉芽组织中HyP含量增高,提示紫草素可促进HyP分泌,从而促进肉芽组织生长与溃疡创面愈合。除炎症、HyP外,溃疡创面肉芽组织中的新生血管情况也影响创面愈合。CD34为高度糖基化Ⅰ型跨膜糖蛋白,是一种黏蛋白样血管递质素,可作为创面新生血管生成的标志物[13]。免疫组化染色显示,与模型组比较,紫草素低、高剂量组大鼠CD34蛋白表达强度及IOD值增高,提示应用紫草素利于创面肉芽组织新生血管形成,可促进创面愈合。由此可见,紫草素可消除炎症,促进慢性皮肤溃疡创面肉芽组织新生血管形成,改善溃疡创面病理学变化,最终促使创面愈合。
VEGF为溃疡创面肉芽组织新生血管形成的主要效应分子,Zhu等[14]发现,VEGF蛋白表达与新生血管形成及创面愈合密切相关。刘涛等[15]报道,VEGF信号通路与DLL4/Notch1通路、血管再生关系密切。VEGF为DLL4的正向调节因素,DLL4为VEGF信号通路的负向调节因素,二者共同影响特定血管内皮细胞对VEGF信号产生的反应,协同促进血管网的分化、形成。Notch1为VEGF的下游信号[16],VEGF激活其受体VEGFR1、VEGFR2后,诱导Notch1及其配体DLL4表达,DLL4/Notch1表达上调可抑制新生血管过量芽生,促进功能血管网络的构建[17]。本研究结果显示,与模型组比较,紫草素低、高剂量组大鼠创面肉芽组织中VEGF蛋白表达增高,Notch1蛋白表达降低,提示VEGF、DLL4/Notch1通路经负反馈机制协调,二者存在协同作用,紫草素可能通过上调VEGF、下调DLL4/Notch1通路发挥药效。TGF-β1是多效能生长因子,可刺激细胞外基质分泌,调节细胞生长分化,促进血管形成,在创伤修复中起促进作用[18]。本研究结果显示,与模型组比较,紫草素低、高剂量组中TGF-β1蛋白相对表达量增高,提示紫草素可能通过上调TGF-β1蛋白的表达促进溃疡创面愈合。
综上所述,紫草素可能通过调节VEGF/Notch1/TGF-β1信号通路的表达促进慢性皮肤溃疡大鼠的创面愈合及新生血管形成。但本研究仅初步观察了给药14 d内VEGF、Notch1、TGF-β1蛋白的表达,并得出该通路在紫草素治疗期间变化的结论,但VEGF/Notch1/TGF-β1信号通路在大鼠创面治疗过程中的变化趋势尚不明确,且通路之间有无相关性及其具体机制仍有待进一步探讨。

