丁苯酞修饰新型自组装短肽对氧化低密度脂蛋白损伤血管内皮细胞的影响
朱凌波 龚心琰 龚剑萍 倪市毛 宣云岗
动脉粥样硬化是心脑血管病主要始动因素之一。氧化低密度脂蛋白(oxidized low density lipoprotein,ox-LDL)可损伤血管内皮细胞,启动动脉粥样硬化过程。研究发现丁苯酞(butylphthalide,NBP)可促进血管新生,改善血管内皮的损伤[1]。新型自组装短肽(self-assembling peptide,SAP)可自主形成三维结构,于炎性细胞黏附、迁移,血管新生等过程中发挥作用[2,3]。相较于传统药物,丁苯酞修饰新型自组装短肽(sefl-assembled peptide modified by butylphthalide,NBP-SAP)对ox-LDL 损伤血管内皮细胞的影响未见报道。本次研究主要探索NBPSAP 促进血管内皮修复、血管形成与再生的机制。现报道如下。
1 材料与方法
1.1 细胞培养与分组处理 本次研究于2020 年3月至2020年10月进行。SAP 由成都赛思贝生物科技有限公司生产。人脐静脉内皮细胞株(human umbilical vein endothelial cells,HUVECs)购自中科院上海生命科学院细胞中心。HUVECs 细胞传代扩增后分四组处理。NBP-SAP+LY 组加入150 μg/ml ox-LDL 和100 μg/ml NBP-SAP 和20 nmol/ml LY450139 共同培养;NBP-SAP 组加入150 μg/ml ox-LDL和100 μg/ml NBP-SAP共同培养;ox-LDL组加入150 μg/ml ox-LDL共同培养;对照组用DMEM 完全培养基(由Gibco 公司生产)培养。
1.2 细胞活力(细胞增殖)检测 HUVECs 细胞接种培养板内,8 h 后观察细胞贴壁,按分组加入ox-LDL、NBP-SAP、LY450139 等,分别在0 h、24 h、36 h、48 h 及72 h 时培养孔内加入CCK-8 试剂盒检测液,入CO2培养箱培养4 h后,测波长450 nm记录对应吸光度(optical density,OD)值。
1.3 细胞凋亡率检测 采用Annexin V-PI 双染法。HUVECs 细胞经接种、贴壁,融合度为80%后,按分组加入ox-LDL、NBP-SAP、LY450139 等试剂干预48 h,磷酸盐缓冲液洗涤2次,250 μl 0.25%无EDTA 胰酶消化,离心后弃上清液,磷酸盐缓冲液重悬并计数。取1×105个重悬细胞离心弃上清液,加入195 μl Annexin V-PI 结合液重悬细胞,加入5 μl Annexin V-PI和10 μl碘化丙啶染色液,室温避光孵育15 min,采用流式细胞仪检测各组细胞凋亡率。
1.4 细胞侵袭力检测 采用Transwell 法。制备Transwell 小室,消化细胞,1% FBS 低血清培养基制备终浓度为1×105个/ml 的细胞悬浮母液,加入小室的上室面,每孔200 μl,下室按分组加入500 μl含有ox-LDL、NBP-SAP、LY450139 等试剂的培养基。培养板放入培养箱48 h 取出,棉球擦去上室面细胞,结晶紫染色,倒置拍照。每组均设置三次重复,随机每孔选取三个视野,统计平均值。
1.5 蛋白表达检测 采用Western Blotting 法。HUVECs 细胞经接种、贴壁后,融合度为60%时,按分组加入ox-LDL、NBP-SAP、LY450139 等试剂干预48 h。PMSF的蛋白裂解液处理后使用BCA试剂盒测蛋白量,加入对应浓度SDS-PAGE 胶,marker 及待测样品入凝胶电泳,蛋白转膜导入PVDF 膜,加Bcl-2、血管内皮生长因子(vascular endothelial growth factor,VEGF)-2、Bax、β-actin、Notch1 一抗孵育过夜后回收一抗,加入相应的二抗,回收二抗,显影液显影。扫描各条带灰度值,计算蛋白表达量。
1.6 基因表达检测 采用实时定量荧光PCR 检测。HUVECs 经接种、贴壁后,融合度为80%时,按分组加入ox-LDL、NBP-SAP、LY450139 等试剂干预48 h;TriZOL 法提取细胞总RNA,检测RNA 浓度及A260/A280。确认样本合格后进行反转录PCR,得到cDNA 后进行qPCR。相对表达量使用2-ΔΔCt法进行测定。
1.7 统计学方法 采用SPSS 20.0 和Graph-Pad Prism 8.0 统计学软件进行数据分析。计量资料以均数±标准差()表示。组间计量资料比较采用LSD-t检验;计数资料比较采用χ2检验。设P<0.05为差异有统计学意义。
2 结果
2.1 各组不同时点的细胞活力OD值比较见表1
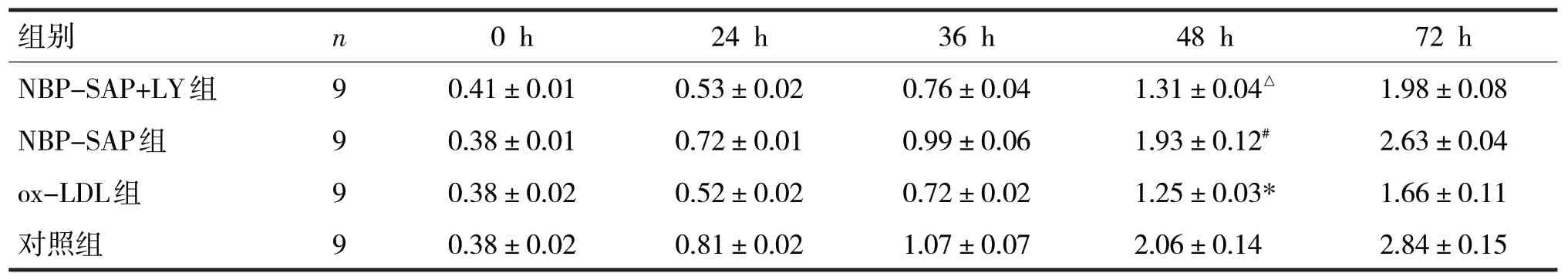
表1 各组不同时点的细胞活力OD值比较
由表1 可见,干预0 h 时各组细胞活力OD 值比较,差异无统计学意义(F=2.01,P>0.05)。干预24 h、36 h、48 h、72 h时,各组的细胞活力OD值比较,差异均有统计学意义(F分别=147.7、33.53、57.79、88.19,P均<0.05)。干预48 h 时,ox-LDL 组较对照组的OD值下降(t=2.98,P<0.05),NBP-SAP组较ox-LDL组的OD 值上升(t=3.59,P<0.05),NBP-SAP+LY 组较NBP-SAP组的OD值下降(t=4.38,P<0.05)。
2.2 各组细胞干预48 h 时培养孔内的细胞数量比较见图1
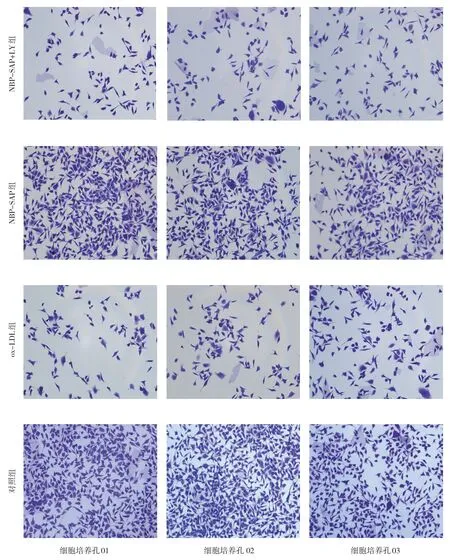
图1 各组干预48 h时细胞融合度情况示意图(结晶紫染色×20倍)
由图1 可见,干预48 h 时,ox-LDL 组较对照组培养孔内细胞数量减少,NBP-SAP 组较ox-LDL 组培养孔内细胞数量增加;NBP-SAP+LY 组较NBP-SAP组培养孔内细胞数量减少。
2.3 各组细胞干预48 h 时凋亡率和细胞侵袭能力比较见表2
由表2可见,干预48 h时,各组细胞凋亡率和细胞侵袭能力比较,差异均有统计学意义(F分别=226.80、208.50,P均<0.05),其中ox-LDL 组较对照组细胞凋亡率增高,细胞侵袭力减弱(t分别=3.14、2.67,P均<0.05);NBP-SAP 组较ox-LDL 组细胞凋亡率降低,细胞侵袭力增强(t分别=2.44、2.91,P均<0.05);NBP-SAP+LY 组较NBP-SAP 组的细胞凋亡率增高,细胞侵袭力减弱(t分别=4.07、3.92,P均<0.05)。
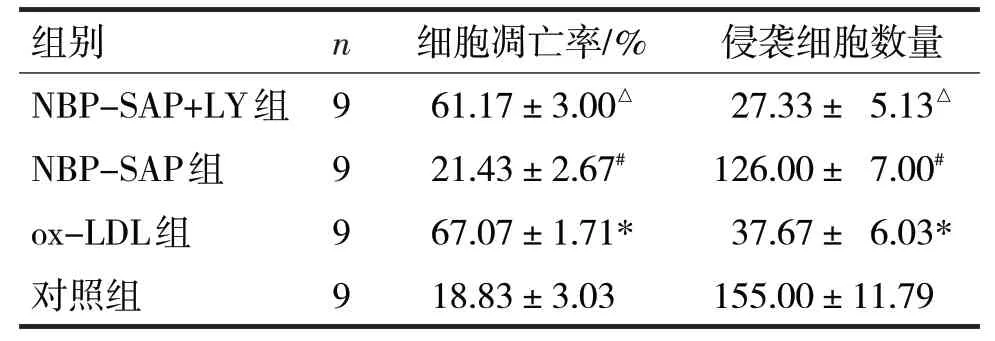
表2 各组细胞干预48 h时凋亡率和细胞侵袭能力比较
2.4 各组细胞干预48 h 时细胞侵袭能力比较见图2
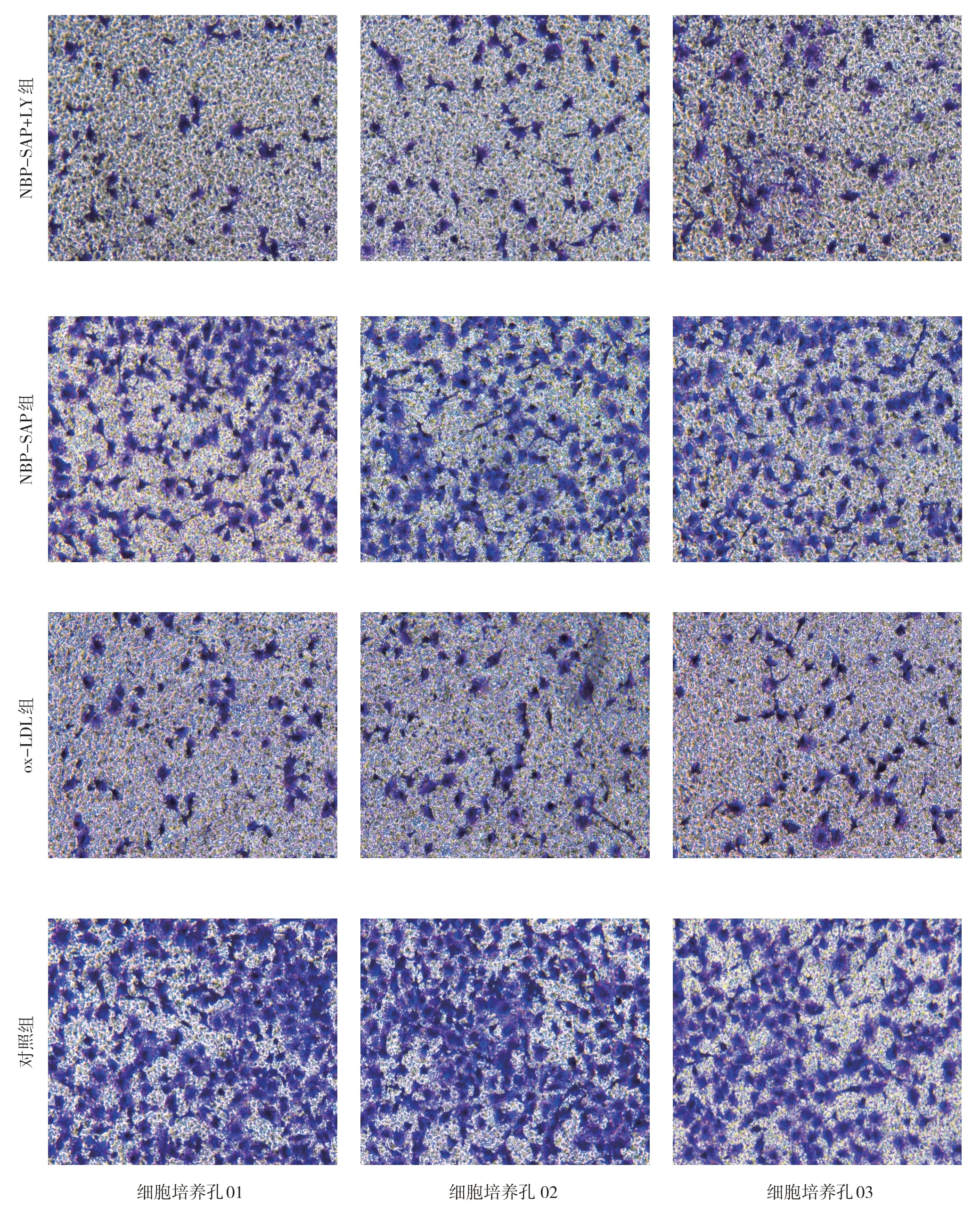
图2 各组干预48 h时细胞侵袭情况示意图(Transwell法×20倍)
由图2 可见,干预48 h 时,ox-LDL 组较对照组穿透细胞基质膜的细胞数量减少,细胞侵袭力减弱;NBP-SAP 组较ox-LDL 组穿透细胞基质膜的细胞数量增加,细胞侵袭力有所增强;NBP-SAP+LY组较NBP-SAP 组穿透细胞基质膜的细胞数量有所减少,表明阻断信号通路后,细胞侵袭力减弱。
2.5 各组细胞干预48 h时蛋白表达量比较见图1
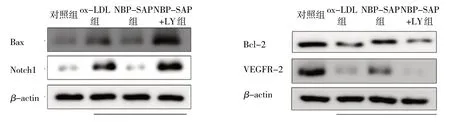
图1 各组细胞干预48 h时蛋白表达量比较
由图1 可见,干预48 h 时,ox-LDL 组较对照组细胞中Bax、Notch1 的蛋白表达量上调,Bcl-2、VEGFR-2 的蛋白表达量下调(t分别=8.59、13.93、10.00、28.83,P均<0.05);NBP-SAP 组较ox-LDL组VEGFR-2、Bcl-2 的蛋白表达量上调,Bax、Notch1 的表达量下调(t分别=12.57、14.49、12.41、11.30,P均<0.05);NBP-SAP+LY 组较NBP-SAP组细胞中Bax、Notch1 的蛋白表达量上调,Bcl-2、VEGFR-2 的蛋白表达量下调(t分别=20.18、8.59、11.23、14.18,P均<0.05)。
2.6 各组细胞干预48 h 时VEGF/Notch 通路相关基因mRNA相对表达量的比较见表3

表3 各组细胞干预48 h时VEGF/Notch通路相关基因mRNA相对表达量的比较
由表3 可见,以对照组为基线,干预48 h 时,NBP-SAP 组较ox-LDL 组DLL4、Notch1、Bax 基因mRNA 表达下调(t分别=13.08、13.16、6.96,P均<0.05)。NBP-SAP+LY 组较NBP-SAP 组VEGF、VEGFR-2、Bcl-2 基因mRNA 表达下调(t分别=12.96、19.93、20.33,P均<0.05)。
3 讨论
超分子学科是近年来的前沿及热点研究方向。SAP 基于分子自组装原理,具有生物相容性和生物活性良好,且易于修饰改造[4]的优点,因此成为了基因工程和组织工程的新兴研究热点。SAP 以非共价键结合排列成特定纳米结构,响应环境能力极高,负载药物能力良好,可应用于药物精确递送[5]。
NBP 具有保护血管内皮细胞、促血管新生与形成、改善缺血组织的微循环和抑制炎症反应等作用[6]。预防和治疗性的NBP 给药能够增强损伤后的血管内皮细胞修复,增加脑微动脉管径和血流速度,从而改善软脑膜的微循环[7,8]。NBP 可增强血管内皮屏障功能,维持血流动力和血管应力,减少“失巢凋亡”,其特征为内皮细胞脱落[9,10]。而因NBP 药物理化特性及分子结构差异,其在免疫调节、抗炎、细胞凋亡、细胞增殖等方面作用受限[11,12],而NBPSAP可能借助SAP的特性而发挥药物的优点。
本次实验研究NBP-SAP 对ox-LDL 损伤血管内皮的影响,通过检测不同药物处理后的细胞活力及细胞凋亡,可观察到人脐静脉内皮细胞在ox-LDL 损伤后细胞凋亡率升高、细胞活力减弱,细胞中Bax、Notch1 的基因及蛋白表达量上调,VEGFR-2、Bcl-2 的基因及蛋白表达量下调。而NBP-SAP组较ox-LDL 组细胞活力增强,凋亡率下降,细胞VEGFR-2、Bcl-2 的蛋白和mRNA 表达上调,而Notch1、Bax 蛋白和mRNA 表达下调,提示NBPSAP 改善了ox-LDL 引起的内皮细胞损伤,减轻其引起的凋亡。
本次实验进一步研究了这一改善作用的机制。减少血管内皮损伤有赖于血管的新生与形成,而血管的新生和形成是一个极其复杂的过程。VEGF/VEGFR2-Notch1 通路在其中扮演重要角色。VEGF是目前公认的在血管再生全过程中发挥作用的一种生长因子,它由8个外显子和7个内含子组成,主要通过激动VEGF 受体(VEGF receptor,VEGFR)而发挥作用,VEGFR 有3种亚型,分别是VEGFR-1、VEGFR-2 和VEGFR-3,它们均属于酪氨酸激酶受体家族。在血管新生的过程中,VEGF 与VEGFR-2结合后激活下游信号,促进血管内皮细胞上的整合素与配体分离,使得局部血管基底膜发生分解,此时内皮细胞可以增殖并向外迁移[13,14]。另有报道指出,VEGF 能通过Notch1/DLL4 信号促内皮细胞形成顶端细胞,继而形成血管芽,顶端细胞形成伪足,有利于细胞迁移、黏附及形成网络状微血管[15]。本次实验结果显示,ox-LDL 组细胞中Bax、Notch1 表达上调,NBP-SAP 组较ox-LDL 组Bax、Notch1表达下调,提示NBP-SAP可能激活人脐静脉内皮细胞中被ox-LDL 抑制的VEGF/Notch1 通路,可能是NBP-SAP 减轻ox-LDL 所致细胞损伤的机制。课题组进一步用VEGF/Notch1 信号通路抑制剂LY450139 与NBPSAP 联合处理HUVECs,较NBP -SAP 不联合LY450139组比较,结果显示增强细胞活力、降低细胞凋亡率效应减弱,相应基因的表达均下调,进一步印证NBP-SAP可能激活VEGF/VEGFR2-Notch1/DLL4信号通路,减轻ox-LDL损伤血管内皮细胞的效应。
综上所述,NBP-SAP 可能激活VEGF/VEGFR2-Notch1/DLL4 通路减轻ox-LDL 损伤血管内皮细胞,其主要作用机制为促进血管的形成与新生,提示NBP-SAP 可能具有治疗心脑血管疾病的新潜力。但本次研究局限于体外实验,对NBP-SAP 是否能在体内发挥作用尚不明确,仍需进一步动物实验深入验证。

