水稻OsLPL2/PIR基因抗旱耐盐机制研究
周文期 强晓霞 王 森 江静雯 卫万荣,*
水稻基因抗旱耐盐机制研究
周文期1,2强晓霞3王 森4江静雯1卫万荣1,*
1西南野生动植物资源保护重点实验室/ 西华师范大学生命科学学院, 四川南充 637000;2甘肃省农业科学院作物研究所, 甘肃兰州 730070;3甘肃省兰州市第四中学, 甘肃兰州 730050;4陕西省畜牧产业试验示范中心, 陕西咸阳 713702
干旱威胁着全球农业生产, 限制了农业可持续发展的前景。植物叶表皮在生长发育、抵御逆境胁迫、与外界环境进行水分和气体交换中, 发挥了至关重要的作用。本研究中, 利用水稻()()和()突变体为研究材料, 与野生型中花11 (Zhonghua 11, ZH11)经干旱胁迫和不同浓度盐处理, 发现和对逆境胁迫响应更敏感, 复水后统计成活率极显著降低, 低于对照1/2。相比ZH11,和株高变矮, 根长变短, 相同叶序气孔密度、气孔开度均极显著增加, 且表皮扁平细胞边缘锯齿状凸出变平滑, 嵌套不紧密, 导致和比ZH11水分散失更多; 离体叶片失水实验也证明了和叶片在等时间内失水更快, 失水率更高; 且过表达转入中,/转基因阳性植株恢复了平滑表皮及对干旱和盐胁迫的敏感表型。研究结果表明,基因不仅控制水稻表皮细胞形态建成, 而且通过调控气孔密度、气孔开度、根生长发育等在响应植物逆境胁迫过程发挥关键作用。本研究为揭示水稻参与干旱胁迫的应答分子调控机制提供了一定的理论基础。
水稻; 抗旱; 耐盐性; SCAR/WAVE复合体; 植物表皮细胞
水稻(L.)作为全球最重要的粮食作物之一, 为全世界一半以上人口提供了口粮, 但随着人口增加、自然气候条件变化、可利用淡水资源减少、土地盐碱化、荒漠化日益加剧, 现有耕地面积逐年缩减, 面对日益增多的人口数量和日渐增长的口粮需求, 供需矛盾日益突出[1]。目前, 导致农作物产量下降的两大主要非生物因素是干旱和土壤盐碱化, 资料显示, 全世界依靠传统的淹水灌溉水稻面积约占9300万公顷, 约占55%的水稻生产面积, 其产量占世界水稻总产量的75%, 这种依赖高消耗淡水资源、氮肥等的生产模式严重制约了农业的可持续性发展[2]。近年来, 因干旱少雨及土壤盐碱化造成的粮食减产和品质降低更是逐年加剧, 直接威胁到国家粮食安全, 保障水稻的高产稳产对我国的粮食安全具有重要意义。因此, 提高作物干旱耐受性、耐盐碱性是生物技术开发和农作物育种的一个重要目标, 亟待大量挖掘作物抗旱耐盐碱基因、解析其遗传机制及逆境响应机制, 并筛选耐逆育种材料, 选育抗旱耐盐碱农作物新品种, 进行试验示范和大面积推广应用, 以保证粮食产量[3-4]。
植物表皮是植物体最外面的一层细胞, 是植物内环境与外界环境的天然保护屏障, 地上器官表皮具有保护功能, 地下器官表皮具有吸收功能[5]; 表皮细胞排列紧密, 没有细胞间隙(除气孔外), 表面还具有蜡质层和角质层, 它不仅可以感知外界刺激、传递信号、增加表皮层厚度, 这些能使植物有效地抵御外界无机胁迫(高温、冷害和干旱等)和有机胁迫(如病原体感染、虫害啃食), 也能有效防止水分和热量散失[6-7]。叶表皮除一般叶片表皮扁平细胞外, 还有气孔和表皮毛等附属物, 泡状细胞以及由硅细胞和栓细胞紧密镶嵌而成的短细胞都属于叶表皮结构[5,8-9]。在拟南芥()中, 表皮细胞边缘凸出(lobe)和凹陷(neck), 咬合嵌套排列。如果表皮细胞排列嵌合不紧密, 会加快叶片表面水分散失速度, 进而改变植物的抗旱特性[10-11], 而且植物叶片表皮上蜡质层的变化也能影响植物对干旱承受能力, 水稻()突变体叶片表面蜡质沉积减少, 导致其水分蒸发加快, 对干旱胁迫响应更敏感[12]。在拟南芥中过量表达R2R3型转录因子MYB96的植株表皮蜡质显著增加, 水分散失减少, 增强了植株耐旱性[13]。拟南芥叶片表皮毛是一种特化的单细胞表皮毛, 一般有3个分支, 对于阻碍食草动物侵害、昆虫攻击、紫外线辐射伤害及水分散失起到了十分重要的作用[14]。水稻和玉米等禾谷类作物叶片表面, 也有很多刺毛和刚毛等毛状物, 对生物及非生物胁迫具有防御和保护作用[15]。
气孔在维持植物正常的生命活动, 气体交换及蒸腾作用中发挥重要作用。植物气孔是茎和叶表皮上的一些小孔, 在植物面对非生物胁迫时发挥关键作用。虽然气孔仅占总叶面积总数的1%~2%, 但是约90%的水分流失都是通过气孔进行的[6,16-17]。前人研究将水稻气孔的发育分成6个阶段, 认为气孔发育图式与玉米气孔发育图式基本相同[18]。从原表皮细胞一共经历了3次细胞分裂, 包括2次非极性细胞分裂和1次极性细胞分裂[8,19], 细胞分裂和分化过程由一些关键的转录因子和基因协同调控, 最终发育形成成熟的气孔复合体[20]。水稻叶表皮发育详细过程参考Zhou等[9]和Wu等[21]气孔系细胞发育图式。细胞分裂中每一次细胞极性分裂异常, 都会产生畸形气孔或者变异表皮结构, 影响植物生长发育、光合及呼吸作用[20]。植物通过气孔的张开和关闭控制细胞内与外界环境二氧化碳和氧气的气体交换, 蒸腾作用中水分散失等。研究表明环境信号(如光照、温度、干旱、大气中CO2与O2的浓度以及内源激素)能调控气孔的孔径和发育[22]。因此气孔是影响植物干旱敏感性的一个重要指标, 减少气孔密度, 减小气孔开度能够提高水稻的耐旱性。
高等植物中, 环磷酸腺苷受体结合抑制因子SCAR/WAVE (suppressor of cAMP receptor/WASP family verprolin-homologous protein)复合体功能缺陷引起的微丝形态异常, 往往会导致植物叶片表皮细胞形态结构异常, 在拟南芥中最典型的特征是表皮毛发育异常, 在水稻中主要表现为硅质乳突和扁平细胞形态异常[9-11,23-27]。SCAR/WAVE复合体由5个亚基组成, 分别是ABI1 (abl-interactor 2)、NAP1 (nck-associated protein)、PIR121 (p53-inducible mRNA 121)、HSPC300 (haematopoietic stem progenitor cell 300)和SCAR/WAVE复合体[28]。微丝聚合过程的复合体肌动蛋白相关蛋白ARP2/3 (actin- related protein-2/3)促进微丝成核的活性受SCAR/ WAVE复合体影响, 能增强ARP2/3复合体的微丝成核效率[26,29]。ARP2/3复合体由7个亚基组成, ARP2 (actin relation protein 2)、ARP3、ARPC1、ARPC2、ARPC3、ARPC4和ARPC5[11,30]。目前, 植物SCAR/WAVE复合体和ARP2/3复合体不同亚基的功能缺陷突变体表现出类似的表型, 都有表皮扁平细胞异常和表皮毛缺陷表型, 说明在植物进化过程中功能保守, SCAR/WAVE-ARP2/3信号通路主要参与细胞骨架微丝成核过程[9,15,26,31-34], 但是对该复合体不同亚基功能缺失突变体响应干旱和盐胁迫机制报道比较少, 研究表明SCAR/WAVE复合体、ARP2/3复合体功能缺陷也可影响植物气孔动态和水分利用[35], 因此, 本研究从功能缺陷突变体和对干旱和盐胁迫响应比对照更敏感的表型入手, 探究基因抗旱耐盐机制。虽然水稻抗旱相关基因被克隆了不少, 但干旱是一个多基因控制的数量性状, 单个基因在抗旱、耐盐碱等性状上效应较低, 农业育种中的应用价值不高, 逆境胁迫涉及到众多基因协调调控[4,36]。因此, 需要进一步挖掘抗逆相关基因, 开展作物抗逆的分子遗传机制研究, 以期为深入剖析水稻的抗逆机制和品种改良提供理论依据。
1 材料与方法
1.1 试验材料
水稻(L.)背景材料为‘中花11’ (Zhonghua 11, ZH11), 作为对照(CK)。()是从T-DNA插入突变库中筛选到的一个表皮细胞形态变异突变体[9],是的T-DNA插入等位突变体, 从Rice Mutant Database (RMD, http://rmd.ncpgr.cn/)突变体库中订购(LOC_Os03g05020)基因突变体, 来源于华中农业大学。大肠杆菌() DH5α, 农杆菌EHA105、过表达载体p1301由实验室保存。
1.2 试验方法
1.2.1 干旱胁迫处理 依据前期研究基础[37],和苗期生长和发芽较CK延迟, 因此,先浸种和种子4~5 d发芽后, 再浸泡CK种子, 幼苗水培液中培养成苗后, 将生长匀称的幼苗移栽到同一苗盘中, 1/2为对照(CK), 1/2为或, 中间用塑料板相隔, 相同生长环境减小了因土壤环境差异造成的实验误差, 每一桶种50~60株苗, 生长8周时间,与CK大小差异不显著, 期间各平行实验都等量浇水, 间苗, 使两边植株总数相同。停止浇水, 开始干旱胁迫, 约10 d左右,和与CK表现出较为明显的干旱响应差异, 继续干旱2~4 d, 表现出极显著差异(CK或突变体, 有一半以上材料叶片脱水, 严重枯萎甚至死亡), 再等量浇水恢复4~5 d; 统计能恢复返绿的植株数。生殖期干旱, 将生长4个月大小抽穗期的植株, 停止浇水, 干旱15~20 d, CK或突变体一半以上植株出现明显的干旱失水枯萎表型, 再浇水恢复4~5 d, 统计能返绿成活的植株数目, 按以下公式计算成活率(survival rate)。抗旱实验均设置3次生物学重复, 每次定苗约50株, 复水后成活率统计数据样本量=150。成活率(%) = (恢复成活植株数/处理前成活植株数)×100。
1.2.2 不同浓度盐胁迫处理 同样的方法, 先浸种和, 待发芽后再浸种ZH11, 将生长均匀的幼苗, 移栽至苗盘中, 同一苗盘中, 一半是对照(CK), 一半是突变体, 生长4周, 用等量不同浓度的盐溶液处理, 蒸馏水(0 mmol L–1NaCl)作CK, 实验组用50 mmol L–1和100 mmol L–1NaCl处理, 3~5 d时间, 高浓度100 mmol L–1NaCl处理会出现明显的盐胁迫响应, CK或突变体有一半植株叶片干枯萎蔫, 停止处理, 用等量蒸馏水冲洗土壤, 稀释盐分, 恢复生长4~5 d, 统计盐处理和与ZH11存活植株, 按以上成活率公式计算成活率。抗盐胁迫实验设计4次生物学重复, 每次定苗25株, 复水后成活率统计数据样本量=100。本研究选用50 mmol L–1和100 mmol L–1NaCl处理, 相当于模拟了0.292%和0.584%土壤盐浓度, 当土壤含盐量达到干土重的0.3%~0.5%, 属于弱盐渍土或中等盐渍土。
1.2.3 离体叶片的失水实验 在培养间进行, 温度保持在25℃[38], ZH11、和离体叶片失水率计算, 选取处于实验所需苗期和孕穗期的植株。苗期取ZH11、和各12株第4和5叶(从叶柄处剪下), 孕穗期选取剑叶和次剑叶(从叶柄处剪下), 平均分成3组。用分析天平称取ZH11、和离体叶片的质量, 即为干重(desiccated weight, DW), 0 h的质量为鲜重(fresh weight, FW), 每隔0.5 h称量一次, 记录对应时间下的叶片干重; 持续失水3 h, 结束实验; 根据以下公式, 计算相应时间下的叶片失水率。3次生物学重复。叶片失水率(water loss rate, %) = (FW–DW)/ FW×100。
1.2.4 气孔密度的统计方法 在分析水稻叶片气孔密度时, 将每种实验材料选取约20株, 用牙齿合成树脂印迹技术获得实验叶片下表皮的印迹, 在16×40倍显微镜下, 用带25×25格(0.0324 mm2)计数板目镜观察和统计, 随机选取并观察和记录不同视野内气孔数目, 气孔密度描述了单位面积内气孔的数目, 用气孔的分布频率来表示[39], 计算公式为: 气孔密度(气孔数No. mm–2) = 单位面积内气孔个数/0.0324。用平均值计算, 3次生物学重复。
1.2.5 气孔开度的统计方法 上午9:00—10:00时, 气孔处于打开状态, 取样, 液氮速冻处理, 用日立S-3400电子显微镜扫描ZH11、和成熟叶片表皮, 观察气孔及表皮扁平细胞结构。以10 kV的加速电压扫描叶片, 观察并照相(放大800倍)。利用ImageJ软件对扫描照片中的气孔长度(stomatal lengthtal, SL)和保卫细胞开口宽度(stomatal width, SW) (图3-D, E), 测量气孔张开的最宽处宽度, 并根据公式计算气孔开度, 它表示气孔口张开的程度。干旱处理后同样的方法拍照和测量。气孔开度=气孔口张开宽度/长度。
1.2.6 实时定量PCR (qRT-PCR)检测 使用PrimeScript RT-PCR Kit (TaKaRa公司)试剂, 严格按照说明书操作, 抽提水稻幼嫩叶片组织RNA, 定量反转录得到cDNA。利用qRT-PCR技术检测目标基因表达量。()是内参基因。
1.2.7载体构建与遗传转化 提取中花11幼嫩叶片RNA, 反转录cDNA, 为PCR扩增模板, 以p1301-LPL2F和p1301-LPL2R (表1)为引物扩增3862 bp大小目的条带, 与T载体连接测序, 全部序列正确后, 再酶切, 连至p1301过表达载体, 农杆菌浸染进行愈伤组织诱导转化, 分化转基因植株。遗传转化方法参考周文期[40]。

表1 本研究使用的引物序列
引物序列中下画线表示限制性内切酶位点。
Restriction endonuclease sites are underlined in primer sequences.
2 结果与分析
2.1 OsLPL2在不同物种中的基因注释及同源蛋白保守性分析
在模式植物拟南芥()中, 已经被证明了一条通过控制微丝斑形成和微管束在细胞内空间上的分布, 进而调控细胞骨架结构及表皮扁平细胞形态建成所必需的信号通路, 即上游SPK1 (SPIKE1)传递信号给ROPs (Rho-like small GTPase in plant), 激活SCAR/WAVE复合体, 该复合体再与下游ARP2/3复合体相互作用, 激活下游信号通路, 对微丝进行核化, 促使新的微丝生成[11,41]。在水稻中, 通过图位克隆手段, 克隆到了调控水稻微丝合成SCAR/WAVE复合体关键基因(基因号: LOC_Os03g05020)[9], 在Rice Genome Annotation Project (http://rice.plantbiology.msu.edu/)中查找到不同物种中的同源基因, 功能注释都同属于PIR (PIROGI)蛋白, 功能保守。结果如表2所示。
进一步在NCBI基因组数据库(https://www.ncbi. nlm.nih.gov/)中BLAST氨基酸序列, 找到其在拟南芥、水稻、玉米和人类基因组中的氨基酸序列, 利用DNAMAN软件进行同源性比对分析(图1)。结果表明, OsLPL2与玉米ZmBRK2 (GRMZM2 G113174)同源性最高, 氨基酸相似性高达93%, 与拟南芥AtPIR(PIROGI, At5G18410)氨基酸同源性是74%, 与人类基因组中PIR121/SRA1蛋白序列相似度最低。不同物种中同源基因的氨基酸序列高度保守, 说明OsLPL2在进化上相对保守, 与同为禾本科的玉米氨基酸序列高度相似, 可能具有更保守的功能。前人研究证明了拟南芥AtPIR、水稻OsLPL2/PIR和玉米BRICK2/ZmPIR蛋白在微丝成核重组中发挥关键作用, 调控植物表皮细胞的形态建成过程[9,31-33]。但是, 该基因在作物抗旱、耐盐相关研究尚未报道, 因此, 本研究对和进行干旱和盐胁迫处理, 鉴定表型并解析其调控机制。
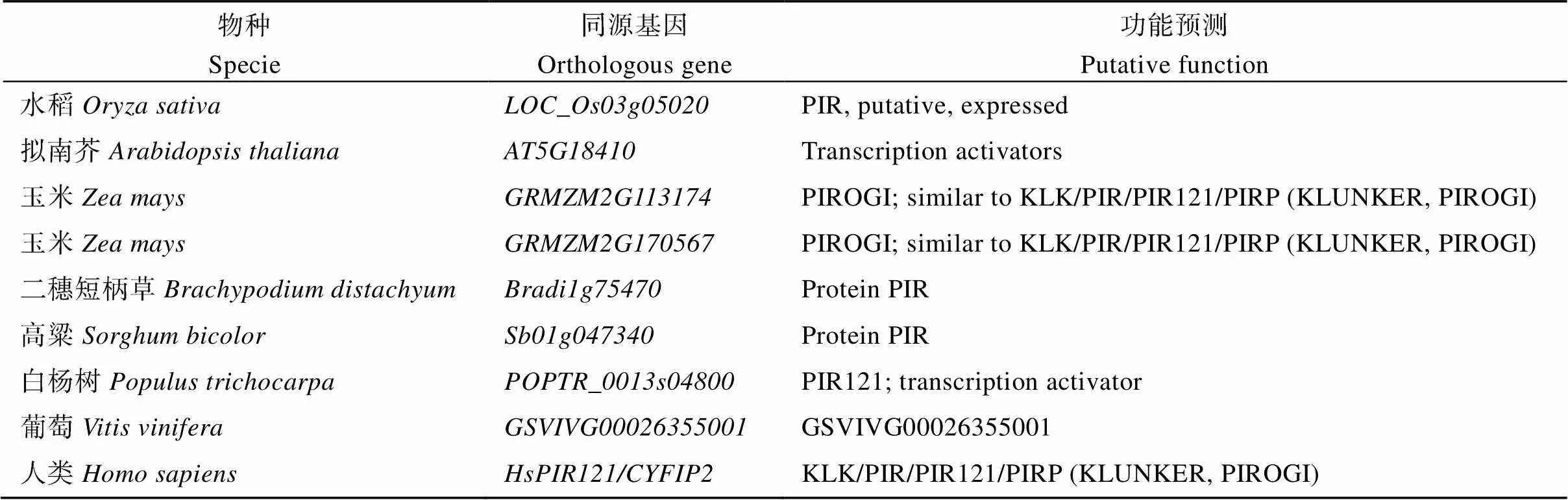
表2 OsLPL2在不同物种中的基因编号及功能注释

(图1)
AtPIR是拟南芥中PIR蛋白, OsLPL2是水稻中PIR的同源蛋白, HsPIR121是人类中PIR的同源蛋白, ZmBRK2是玉米中PIR的同源蛋白, 同源性序列分析表明, 氨基酸相似度高达72.9%。OsLPL2尤其与玉米中BRK2同源蛋白相似性高达93%。
AtPIR is a homologous protein of PIR in, OsLPL2 is a homologous protein of PIR in rice, HsPIR121 is a homologous protein of PIR in human, and ZmBRK2 is a homologous protein of PIR in maize. Homologous sequence analysis showed that the amino acid similarity is 72.9%. OsLPL2 has particularly 93% similarity to maize BRK2 homologous proteins.
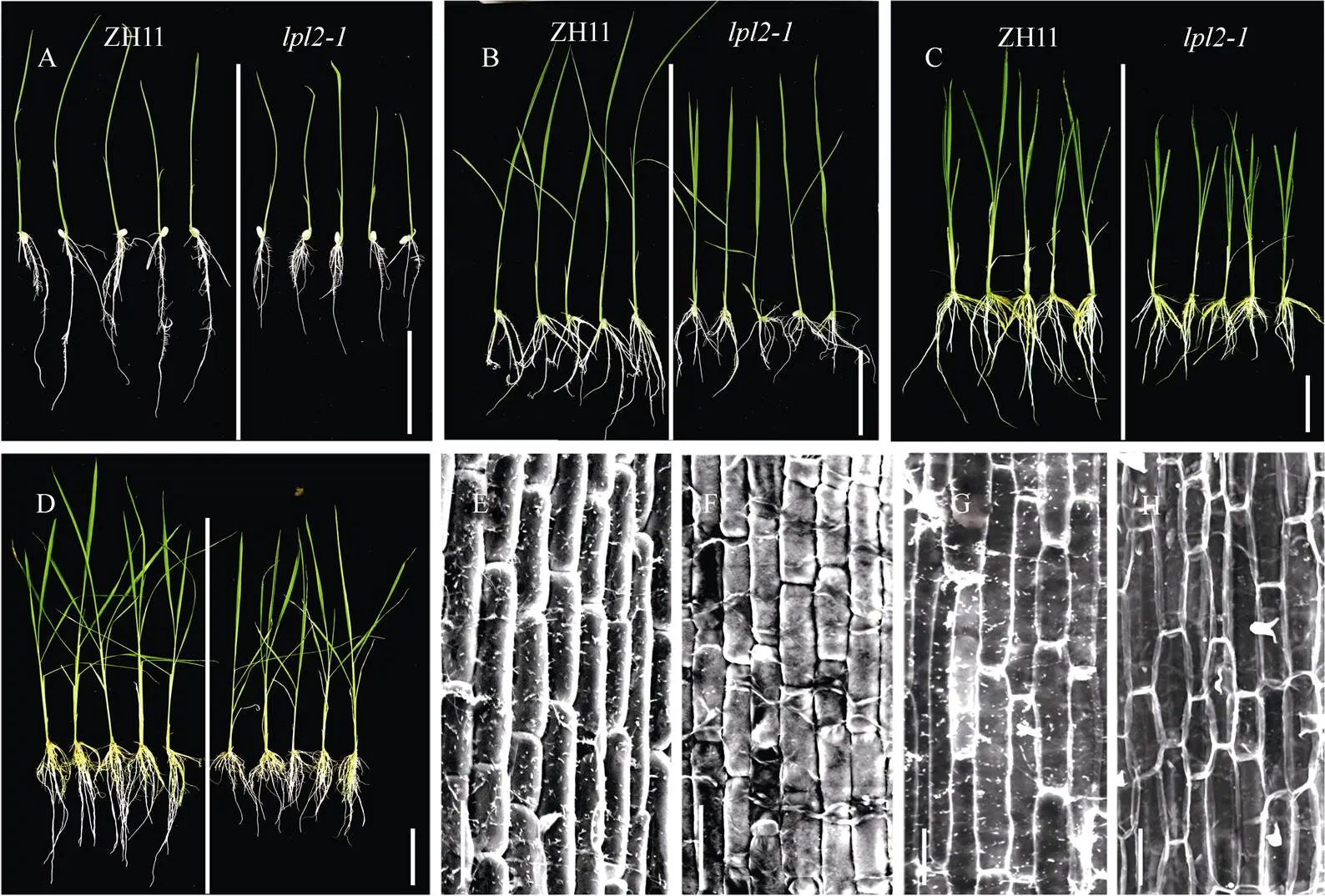
2.2 lpl2-1和lpl2-2表皮变平滑, 气孔开度变大
和是等位突变体,中基因在第16位外显子处缺失26 bp的氨基酸导致编码提前终止, 而T-DNA插入到第10个外显子中, 也导致氨基酸编码提前终止, 是功能缺失突变体, 表皮细胞平滑表型基本一致[9]。和株型高度较同期生长对照中花11 (ZH11)植株矮小, 根长变短, 株高和根长均有显著差异(图2), 叶和茎表皮扁平细胞边缘锯齿状凸出(lobes)变平缓。通过电子扫描电镜观察, ZH11幼苗期及成熟期叶片气孔呈单线性规则排列, 2个气孔相间隔一个表皮长细胞, 且表皮气孔扁平细胞边缘嵌合呈锯齿状凸出, 凸凹不平(图3-A, 黑色箭头所示)。而气孔也是呈现单线性排列, 表皮扁平细胞边缘lobes更平滑, 表皮细胞变成矩形状(图3-B)。ZH11两个成熟气孔间隔一个表皮长细胞排列(图3-A, D), 而中明显有未发育形成气孔的前体细胞(本该发育成气孔, 由于基因突变导致前体细胞异常分裂和分化) (图3-B, 黑色小三角标出), 且气孔开口明显增大(图3-C, E, F), 其表皮细胞变平滑表型从幼苗叶片到成熟期叶片表型均一致, 并没有随着叶序的增加而改变。
(图2)
AD: 分别生长1周、2周、3周和4周的植株; E, F: 分别是中花11与生长1周的根细胞扫描图; G, H: 中花11与生长4周的根细胞扫描图; I: 测量1~4周的植株高度,= 30; J: 测量1~4周的根长,= 30, 1、2、3和4分别表示第1、2、3和4周。AD: 标尺为1 cm; EH: 标尺为100 μm。*表示与对照有显著性差异,< 0.05; **表示与对照有极显著性差异(< 0.01)。
AD:plants grown at 1, 2, 3, and 4 weeks, respectively; E, F: scanning images of root cells in ZH11 andplants for growing one week, respectively; G, H: scanning images of root cells in ZH11 andgrowing for 4 weeks; I: plant height was measured from 1 to 4 weeks,= 30; J: root length was measured from 1 to 4 weeks,= 30, 1, 2, 3, and 4 represent 1, 2, 3, and 4 weeks, respectively. AD: Bar: 1 cm; EH: Bar: 100 μm. *:< 0.05; **:< 0.01.

图3 lpl2-2突变体叶片表皮形态
A: ZH11幼叶表皮细胞, 细胞边缘锯齿状凸出(黑色斜箭头所示); B:幼叶表皮细胞变平滑(黑色斜箭头所示), 发育畸形的气孔, 类似于保卫细胞母细胞(箭头所示); C: 幼叶叶片气孔开度统计,= 100; D: ZH11成熟叶气孔结构放大图, 成熟气孔由2个副卫细胞(SC)和2个保卫细胞(GC)构成, SP表示气孔开度; E:成熟叶气孔结构放大图, SL表示气孔长度, SW表示气孔宽度; F: 成熟叶叶片气孔开度统计,= 100。G, H: ZH11与第4、5叶和剑叶、次剑叶气孔密度,> 3000; AE: 标尺为20 μm。**表示极显著性差异(< 0.01)。
A: mature stomata and pavement cells (PCs) with waved lobes were obviously observed in ZH11 (oblique black arrows); B:showed epidermal PCs with gentler lobes (oblique black arrows), small black triangles indicate GMC-like cells; C: stomatal opening of young leaves,= 100; D: amplified mature stomata is composed of two GCs and SCs in ZH11 (oblique black arrows); E: amplified mature stomatal structure ofmature leaves; F: stomatal opening of mature leaves,= 100; G, H: stomatal density of the 4th, 5th, flag leaf and secondary flag leaf in ZH11 and,> 3000; AE: bar: 20 μm. **:< 0.01 (Student’s-test). PC: pavement cells; SC: subsidiary cells; GC: guard cell; SP: stomatal opening; SL: stomatal length; SW: stomatal width.
2.3 lpl2-1和lpl2-2幼苗期植株高度变矮, 根长变短
幼苗期,和与中花11相比, 生长发育迟缓、株高变矮、根长变短, 差异极显著(图2)。为了解释根变短的原因, 将生长1周(图2-E, F)和4周(图2-G, H)的ZH11及根细胞进行扫描电镜观察,根细胞长度比ZH11变短(图2-E~H),测量统计结果表明, 根长与根细胞长度相比ZH11均显著变短, 且变化趋势一致, 说明根变短主要是因为根细胞长度变短, 测定根长与根细胞长度, 与数据一致, 无差异显著性(未列出)。
2.4 lpl2-1和lpl2-2对干旱胁迫更敏感
根据和株高变矮和根长变短、表皮细胞形态变异的表型, 推测与植物抗逆性相关。为了验证这一假设, 设计了温室内干旱胁迫和不同浓度的盐处理实验。选取在相同环境下, 生长8周大小的ZH11、和植株, 开始干旱胁迫(图4-A, I), 每天观察, 待CK或者突变体表现出叶片严重脱水、萎蔫、明显干枯表型, 以敏感材料一半萎蔫、脱水干枯为临界点, 开始浇水恢复, 10~14 d出现极显著差异,植株大多萎蔫, 部分死亡(图4-B, J), 说明对干旱胁迫响应更敏感, 浇水恢复, CK逐渐恢复正常, 而和一半以上植株死亡(图4-C, K), 浇水恢复5 d后, 统计成活植株, 150株ZH11中有126株干枯表型恢复, 而150株中只有58株恢复返绿, 150株只有53株恢复返绿, 计算成活率, CK达到83%的成活率, 而和成活率不到CK的一半, 均低于40% (图4-D, L)。同样, 对抽穗期的植株干旱处理(图4-E), 17 d后,和CK表现出对干旱胁迫不同的响应,对干旱更敏感(图4-F), 浇水恢复, 统计成活率,和的成活率仍不及CK的一半, 低于30% (图4-G, H)。研究结果表明, 苗期和抽穗期干旱处理,和对干旱胁迫响应较CK更敏感。

图4 lpl2对干旱胁迫更敏感
A, E: 干旱处理前的ZH11和; B, F: 干旱后的ZH11和; C、G: 复水后的ZH11和; I: 干旱处理前的ZH11和; J: 干旱后的ZH11和; K: 复水后的ZH11和; D, H, L: 成活率。AD, IL: 苗期干旱, 标尺为10 cm; EH, 抽穗期干旱, 标尺为20 cm。每次实验都定苗50株, 3次生物学重复实验。D、H、L统计= 150, **表示极显著性差异(< 0.01)。
A, E: ZH11 andbefore drought treatment; B, F: ZH11 andafter drought; C, G: ZH11 andafter rehydration; I: ZH11 andbefore drought treatment; J: ZH11 andafter drought; K: ZH11 andafter rehydration; D, H, L: survival rate of ZH11,and. AD, IL: plants of ZH11 andwere responsive to drought at seedling stage, bar: 10 cm; EH, plants of ZH11 andwere responsive to at heading stage, Bar: 20 cm. Each experiment, 50 seedlings were selected and biological experiments were repeated for 3 times. D, H, L:= 150. **:< 0.01 (Student’s-test).
2.5 lpl2-1和lpl2-2对盐胁迫响应更敏感
种植幼苗生长4周后, 对生长均匀的CK、和进行不同浓度的盐胁迫处理, 设置3个浓度,蒸馏水(0 mmol L–1)为对照组、用50 mmol L–1和100 mmol L–1的NaCl盐水溶液处理作为实验组(图5-A, D), 6 d后, 浇灌100 mmol L–1盐水的和叶片明显出现萎蔫、下垂和枯死性状, 50 mmol L–1处理的和对盐胁迫响应更敏感(图5-B, E), 浇蒸馏水恢复, 5 d后, 100 mmol L–1处理的和大量死亡, 而50 mmol L–1处理的和过半死亡(图5-C, F), 统计恢复后成活植株, 计算成活率。实验结果表明:和植株成活率仅是ZH11一半(图5-G, H),和对50 mmol L–1和100 mmol L–1盐处理耐受能力较CK明显减弱, 对盐胁迫响应更敏感。
2.6 lpl2-1和lpl2-2气孔密度增加, 离体叶片失水快
将正常浇水的幼苗期和营养生长期的ZH11、和, 用扫描电子显微镜扫描叶表皮, 拍照统计气孔密度、测量气孔长度、宽度及气孔开口长度和宽度, 计算气孔开度(图3)。结果显示,和气孔密度无论是在幼苗期的第四和第五叶, 还是营养生长期的剑叶和次剑叶中, 气孔密度均比CK极显著增加(图3-G, H)。和气孔开度都大于CK, 两者差异极显著(图3-C, F)。同时, 为了进一步验证和由于气孔密度增加, 开度变大导致的对干旱环境更敏感表型, 用离体叶片进行3 h的失水检测, 通过对短期内水分散失速率的计算, 结果表明, 在同等时间内,和叶片水分散失比CK更快, 水分散失速率显著高于CK (图6)。该研究表明,和对干旱和盐胁迫更敏感, 是由于气孔密度增加和气孔开度的增大, 导致突变体气孔关闭程度低于CK, 所以蒸腾作用更剧烈, 叶片失水更快更多, 因此突变体和表现出对外界环境逆境胁迫更敏感表型。
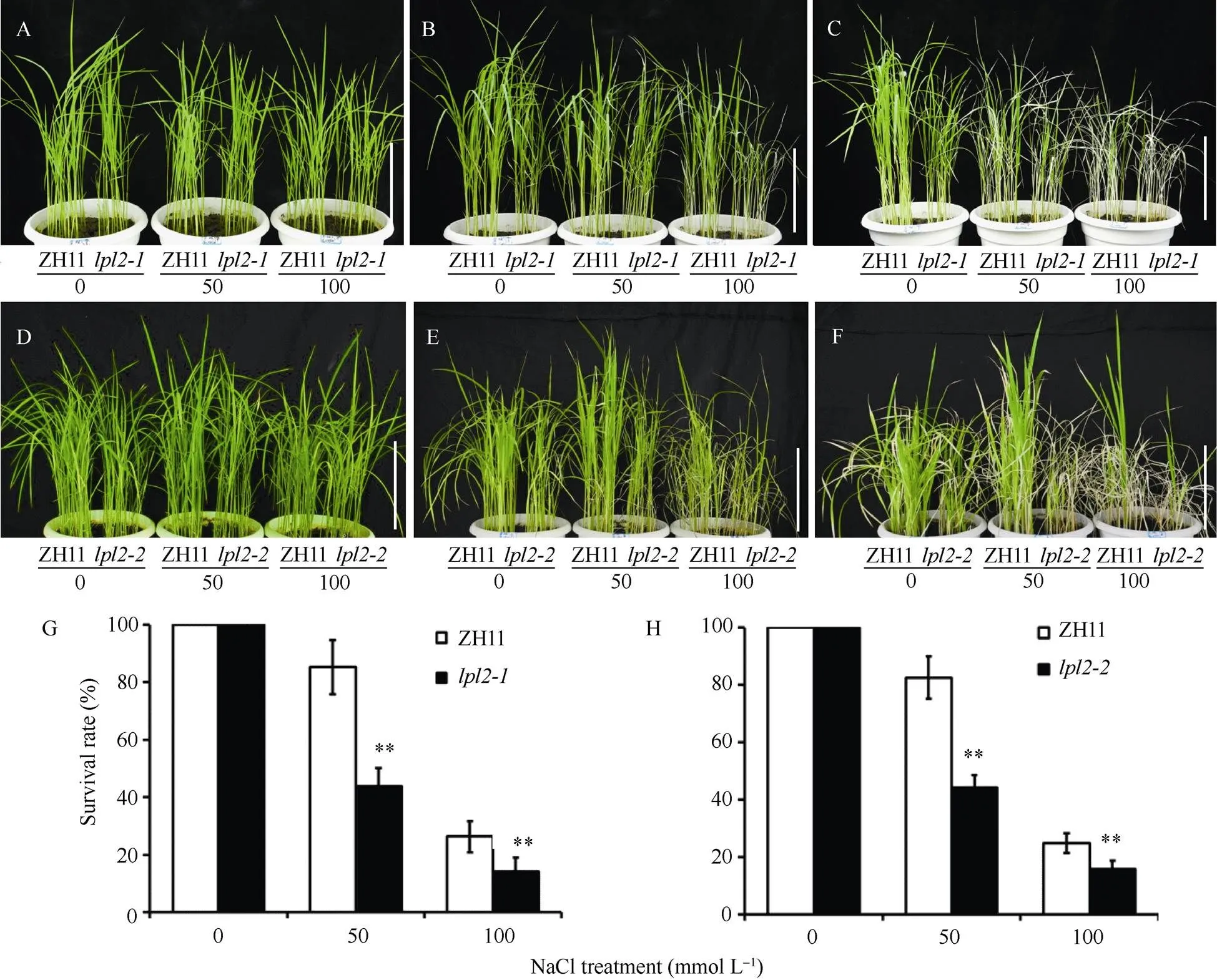
图5 lpl2对盐胁迫更敏感
A: ZH11与幼苗; B: 不同浓度NaCl处理,响应比对照更敏感; C: 浇水恢复后,成活植株明显少于CK; D: ZH11与幼苗; E: 不同浓度NaCl处理,响应比对照更敏感; F: 浇水恢复后,成活植株明显少于CK; AF, 标尺为10 cm, 每次实验都定苗25株, 4次生物学重复。G, H:、和ZH11成活率统计,= 100, **表示极显著性差异(< 0.01)。
A: the seedlings of ZH11 and; B: the response ofwas more sensitive than CK with different concentrations of NaCl; C: after recovery from watering, the surviving plants ofwere significantly less than those of CK; D: the seedlings of ZH11 and; E: the response ofwas more sensitive than CK with different concentrations of NaCl; F: after recovery from watering, the surviving plants ofwere significantly less than those of CK; AF: bar: 10 cm. In each experiment, 25 seedlings were selected and four biological replicates were performed. G, H: survival rate of,, and ZH11,= 100, **:< 0.01.
2.7 过表达OsLPL2基因转化lpl2-1恢复了突变体抗旱表型
克隆了ZH11中正常基因cDNA序列, 连接到p1301过表达载体, 过表达转化突变体, 11株-/转基因阳性, 分别编号为恢复(Complement, Com) #1~#11, 植株表皮lobe缺陷表型均得到恢复[9]。以Com #3为例, 将ZH11与转基因后代植株用同样的干旱方法处理, 干旱10 d后, Com #3没有表现出明显的敏感表型, 经过14 d干旱, 植株叶片大半脱水萎蔫(图7-A, B), 开始复水, 5 d后, 统计成活植株, Com #3与ZH11成活株率没有显著变化(图7-C, D), 说明Com #3 恢复了对干旱胁迫敏感表型。用0、50和100 mmol L–1的NaCl盐水溶液处理ZH11与转基因后代植株, 6 d的Com #3植株没有表现出和对100 mmol L–1盐浓度的高敏感性(图7-E, F), 8 d后, Com #3与ZH11叶片表现出明显的变黄, 干枯症状(图7-G), 浇等量蒸馏水恢复, 5 d后, 统计成活植株, Com #3恢复较好, 成活率与ZH11无显著性差异,对盐胁迫敏感表型在转基因后代得到恢复。研究结果表明, 由于基因突变, 氨基酸编码提前终止, 导致功能缺失, 微丝合成受阻, 表皮细胞边缘锯齿状凸出变平滑, 不能正常嵌套, 叶片保持水分能力减弱; 并且和气孔密度增加, 气孔开度增大, 水分散失速率加快, 因此对干旱和盐胁迫响应更敏感。本实验结果表明,不仅在控制植物表皮细胞形态建成中发挥不可或缺作用, 在对抗逆境胁迫(干旱和高盐环境)中也发挥着重要功能。
3 讨论
3.1 植物叶片气孔密度对干旱胁迫的响应
在植物生长过程中, 当植物遭受干旱、高盐、低温、病原菌等逆境胁迫时, 植物会通过一系列生理应激反应及代谢机制来抵御逆境胁迫。而干旱和盐碱胁迫几乎影响植物生理和新陈代谢多方面, 是影响植物生长发育和产量的重要因素之一。气孔作为植物与外界环境进行水分和气体交换的重要通道,在调节植物光合作用、蒸腾作用以及水分利用中扮演着至关重要的角色[6,17]。本研究表明SCAR/WAVE复合体亚基OsLPL2也参与了抗旱响应过程,和对干旱和盐胁迫响应更敏感。分析原因首先气孔密度升高, 从第3叶到剑叶,气孔密度都极显著高于同时期ZH11叶片气孔密度, 导致与外界环境接触并开放的通道增多, 且气孔开度增大, 导致短时间内水分散失更快, 失水率更高, 因此对干旱响应更敏感。这与前人研究水稻中突变体对干旱和盐胁迫更敏感的表型是一致的,比野生型失水更快, 因为气孔密度、气孔导度和蒸腾速率显著高于野生型[27]。野生型组成气孔孔径小, 水分扩散阻力大, 减少因蒸腾作用流失过多水分, 从而避免干旱的不利影响[26-27]。Huang等[42]在水稻中鉴定了一个干旱胁迫敏感突变体(),气孔密度增多, 气孔开度增大, 因此水分流失较对照更多。功能缺失, 导致微丝合成受阻, 引起干旱胁迫条件诱导的气孔关闭出现缺陷, 增加了ABA积累, 表现出对干旱更敏感表型,编码SCAR/WAVE复合物的另一个亚基NAP1 (Nck-associated protein 1)蛋白,在肌动蛋白丝成核活性中起着至关重要的作用[42], 而基因在我们之前的研究中已经克隆, 并命名为(基因号: LOC_), 通过体外酵母双杂交实验证明了OsLPL2与OsLPL3能直接相互作用, 可能形成一个小复合体, 功能缺失后表型与和非常类似, 表皮细胞边缘lobe平滑, 气孔密度增加[9,42]。以上研究结果表明,、和都是SCAR/WAVE复合体不同亚基, 在参与微丝成核过程中, 通过影响肌动蛋白微丝聚合来响应干旱胁迫。前人研究表明, 气孔关闭过程中, 保卫细胞中的微丝要经历解聚与重新聚合的过程, 而微丝成核和再聚合的过程处于ABA信号通路下游, 是气孔闭合所必需的[43]。当气孔处于完全张开状态时, GCs中的微丝呈现一种以气孔为中心的成束放射状, 之后微丝解聚成随机分布的状态, 牵引气孔慢慢闭合, 最后微丝重新聚合成纵向的微丝束, 气孔完全闭合[44-45]。微丝的这一动态变化受到抑制会导致GCs对ABA诱导的反应迟缓, 并进一步影响植物的干旱敏感性[45]。
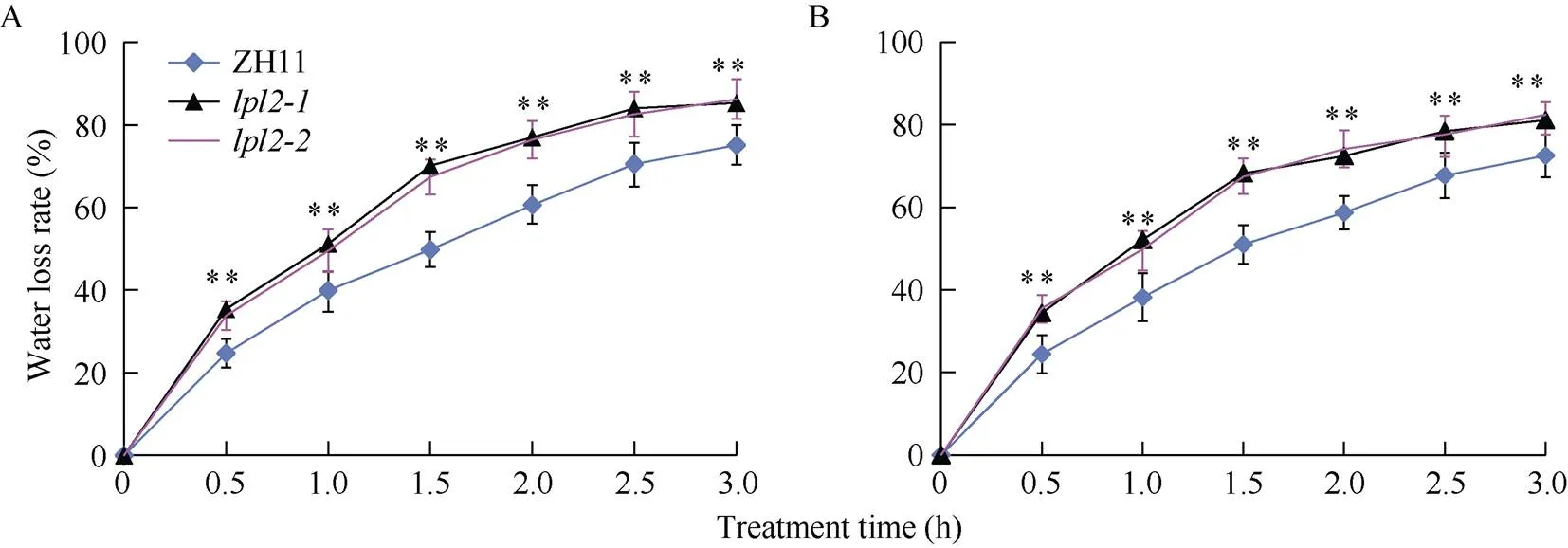
图6 ZH11与lpl2-1和lpl2-2幼叶与成熟叶离体叶片失水率
A: 幼苗期ZH11与离体叶片失水率对比, 第4、第5叶; B: 抽穗期ZH11与离体叶片失水率对比, 剑叶和次剑叶。= 50, **表示与对照有极显著性差异(< 0.01)。和气孔密度及失水率无显著差异, 但是与CK差异极显著。
A: comparison of water loss rate between ZH11 andat seedling stage, the fourth and fifth leaves; B: comparison of water loss rate between ZH11 andat heading stage, flag leaf and secondary flag leaf.= 50; ** indicates significant difference with the control group at< 0.01. There was no significant difference in stomatal density and water loss rate betweenand, but the difference was extremely significant betweenand CK.
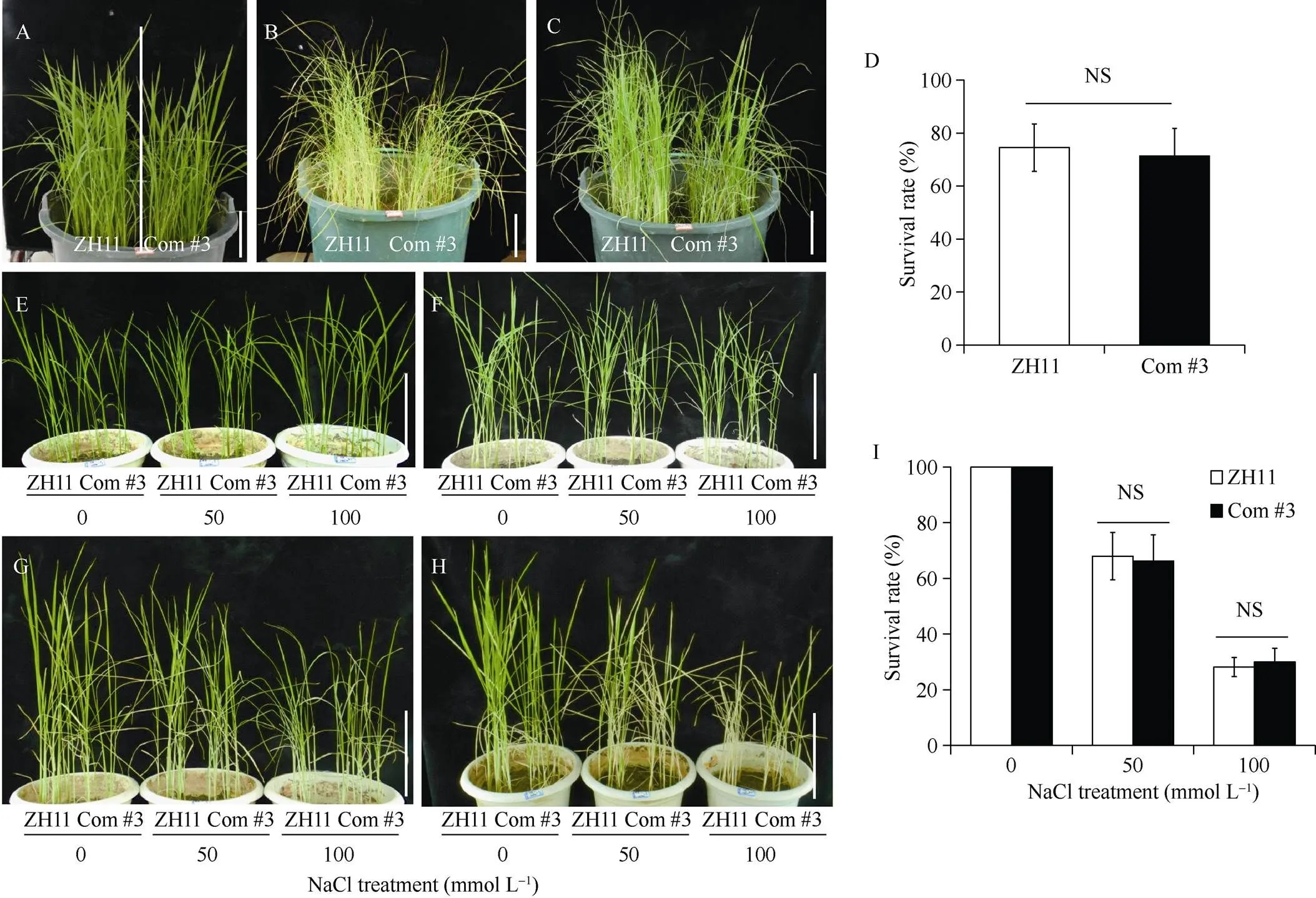
图7 OE-OsLPL2/lpl2-1恢复了lpl2-1对干旱和盐胁迫耐受性
A: 干旱处理前幼苗期ZH11和Com #3; B: 干旱后的ZH11和Com #3; C: 复水后的ZH11和Com #3; D: 干旱复水后成活率统计,= 150, 3次生物学重复, 每次定苗50株; EH: 分别是ZH11与Com #3不同浓度NaCl处理前, 处理6 d、8 d及恢复5 d后植株表型; I: 浇水恢复后, Com #3成活率与ZH11无显著差异, 标尺为10 cm,= 100, 4次生物学重复, 每次定苗25株, NSnot significant。
A: ZH11 and Com #3 before drought treatment at seedling stage; B: ZH11 and Com #3 after drought treatment; C: ZH11 and Com #3 after rehydration treatment; D: survival rate.= 150, three biological replicates, 50 seedlings each experiment; EH: plant phenotypes of ZH11 and Com #3 were treated with different concentrations of NaCl for 0, 6, 8, and 5 d after recovery, respectively. I: survival rate of Com #3 and ZH11, after watering, was not significantly different, bar: 10 cm,= 100, four biological replicates were performed, 25 seedlings each time, NSnot significant.
水稻中报道的调控叶片气孔密度响应干旱胁迫的基因如下: 过量表达()和() 基因, 转基因植株气孔密度降低, 水分散失减少, 对干旱胁迫的耐受性显著增强[46-47]。()基因影响表皮细胞的分化, 在水稻中功能缺失突变体气孔密度升高、水分散失更多, 对干旱胁迫更敏感[48]。光敏色素B (,)控制水稻叶面积及气孔密度, 影响植株抗旱[49],突变体叶表皮细胞面积减少, 数目减少, 表皮变大, 气孔密度降低, 减少了水分的散失,比野生型更抗干旱胁迫[49]。影响气孔密度大小主要因素有2个, 一是在气孔系细胞分裂和分化过程中形成成熟气孔和表皮扁平细胞数目; 二是叶表皮细胞体积的变化而导致单位叶面积上气孔数目(气孔密度)的变化, 因此对和等突变体的研究, 克隆更多控制气孔密度和开度相关基因, 可通过基因工程手段合理控制和降低气孔密度及导度, 减少单位叶面积水分蒸腾量, 是提高植物水分利用率和耐旱性的重要手段, 通过正调控气孔关闭的基因可以提高植物在干旱胁迫下的及时关闭, 提高逆境胁迫条件下的存活率[38,43,50], 可为选育抗旱耐盐碱品种提供理论基础, 具有很好的研究价值。
3.2 植物叶片气孔开度对干旱胁迫的响应
除了气孔密度之外, 气孔闭合程度也会影响作物干旱敏感性。用气孔开度表示气孔张开的程度, 气孔开度为气孔宽与长的比值。由于气孔对非生物胁迫具有应答作用, 气孔可以根据外界环境的变化来改变自己张开大小, 尽量使植物在损失水分较少的条件下获取最多的光合产物[51-52]。Fang和Xiong[53]研究认为抗旱性强的植物气孔(通过减少蒸腾来避免脱水)对水分亏缺很敏感, 在叶片趋于萎蔫之前, 气孔关闭, 起到保水抗旱功能。刘延波等[54]研究表明, 过表达玉米基因到烟草中, 显著降低了烟草叶气孔密度, 提高抗旱性, 使烟草存活率比野生型提高80%。转基因烟草植株和对照相比, 气孔密度降低了50%, 测量干旱后植株气孔导度、蒸腾速率和细胞间二氧化碳浓度都比对照降低, 转基因烟草更抗旱[54]。() 作为抗逆性的负调控因子, 其功能缺失可促使叶片气孔关闭, 减少水分蒸发, 最终提高水稻的抗旱耐盐能力[38]。重要的是, 抗逆性增强的突变体在正常生长情况下其产量与对照相比没有明显的变化, 为该基因在作物抗逆育种中的应用提供了便利[38]。提高水稻()基因的表达量能使叶片气孔的闭合程度增加, 水稻的耐旱性相应增强[50,55]。过表达()基因提高抗旱性的同时, 对盐胁迫耐受能力也大大提高[56]。同为单子叶植物玉米中,在ABA介导的气孔关闭调控中起着重要作用, 过表达转基因水稻既能提高抗旱性又不影响籽粒产量[43]。同样过表达基因转化水稻和拟南芥, 转基因植株气孔密度减少、开度减小、减少蒸腾作用来发挥节水抗旱作用[43]。转录因子通过结合到启动子上抑制表达来减少气孔密度, 增强植株的抗旱性, 转基因植株后代蒸腾速率、气孔导度及气孔密度比对照显著降低[57]。
3.3 植物叶片表皮边缘嵌合程度对干旱胁迫的响应
野生型水稻表皮细胞边缘呈锯齿状, 嵌套非常紧密, 而突变体表皮细胞边缘比较平滑, 表皮细胞间咬合不紧密, 可能导致失水更多而对干旱胁迫更敏感。在双子叶模式植物拟南芥中, 已经报道了SCAR/WAVE复合体和Arp2/3复合体, 不同亚基单基因突变或双基因突变体表现出扭曲表皮毛结构, 表皮细胞边缘Lobe与Neck相互嵌套不紧密, 留有孔隙, Lobe凸出变平滑, 植株不抗旱等共同特征, 因为在野生型中, 表皮扁平细胞紧密嵌套模式, 对植物失水起到一个非常重要的保护作用, 而突变体叶表皮细胞之间镶嵌不紧密, 会引起水分通过叶间隙散失[58]。研究结果表明气孔孔径降低能抑制干旱和盐胁迫条件下的失水过程, 提升了植株的干旱和盐胁迫耐受能力[59]。本研究中和表现出根变短、表皮边缘嵌套不紧密, 容易导致叶片中水分的蒸腾散失, 因此判断对干旱和盐胁迫比对照更敏感, 主要因为极显著增加的气孔密度、增大的气孔开度、平滑表皮嵌套不紧密和根长变短多因素共同作用的结果。
4 结论
通过对和两个等位突变体的表型鉴定, 对比ZH11,株高变矮, 根长变短, 相同叶序气孔密度、气孔开度均极显著增加, 且表皮扁平细胞边缘锯齿状凸出变平滑, 表皮嵌套不紧密, 对干旱胁迫和盐胁迫反应更敏感, 复水恢复后, 统计成活率低于对照的一半, 短期内离体叶片失水更快, 失水率更高, 过表达基因转入突变体, 转基因后代突变表型均得到恢复, 对干旱和盐胁迫处理敏感度降低, 与野生型无显著性差异。研究结果说明基因不仅控制水稻表皮细胞边缘微丝合成和形态建成, 也通过调控气孔密度及开度在响应植物逆境胁迫过程中发挥关键作用。
[1] Farooq M, Wahid A, Lee D J, Ito O, Siddique K H M. Advances in drought resistance of rice., 2009, 28: 199–217.
[2] Lampayan R L, Rejesus R M, Singleton G R, Bouman B A M. Adoption and economics of alternate wetting and drying water management for irrigated lowland rice., 2015, 170: 95–108.
[3] 饶玉春, 戴志俊, 朱怡彤, 姜嘉骥, 马若盈, 王予烨, 王跃星. 水稻抗干旱胁迫的研究进展. 浙江师范大学学报(自然科学版), 2020, 43: 417–429.
Rao Y C, Dai Z J, Zhu Y T, Jiang J J, Ma R Y, Wang Y Y, Wang Y X. Advances in research of drought resistance in rice.(Nat Sci Edn), 2020, 43: 417–429 (in Chinese with English abstract).
[4] Sahebi M, Hanafi M M, Rafii M Y, Mahmud T M M, Azizi P, Osman M, Abiri R, Taheri S, Kalhori N, Shabanimofrad M, Miah G, Atabaki N. Improvement of drought tolerance in rice (L.): genetics, genomic tools, and the WRKY gene family., 2018, 2018: 3158474.
[5] 周玉乾, 孟思远, 周文期. 植物表皮形态建成的分子调控机制.西北农业学报, 2018, 27: 609–616.
Zhou Y Q, Meng S Y, Zhou W Q. Molecular mechanism for regulating epidermal morphogenesis in plants., 2018, 27: 609–616 (in Chinese with English abstract).
[6] Martin C, Glover B J. Functional aspects of cell patterning in aerial epidermis., 2007, 10: 70–82.
[7] Yanagisawa M, Desyatova A S, Belteton S A, Mallery E L, Turner J A, Szymanski D B. Patterning mechanisms of cytoskeletal and cell wall systems during leaf trichome morphogenesis., 2015, 1: 15014.
[8] Luo L, Zhou W Q, Liu P, Luo L, Li C X, Hou S W. The development of stomata and other epidermal cells on the rice leaves., 2012, 56: 521–527
[9] Zhou W Q, Wang Y C, Wu Z L, Luo L, Liu P, Yan L F, Hou S W. Homologs of SCAR/WAVE complex components are required for epidermal cell morphogenesis in rice., 2016, 67: 4311–4323.
[10] Brembu T, Winge P, Seem M, Bones A M. 2004.andencode subunits of a putative wave regulatory protein complex involved in plant cell morphogenesis., 2004, 16: 2335–2349.
[11] Yanagisawa M, Zhang C, Szymanski D B. ARP2/3-dependent growth in the plant kingdom: scars for life., 2013, 4: 166.
[12] Zhu X, Xiong L. Putative megaenzymeplays essential roles in drought resistance by regulating stress-induced wax deposition in rice., 2013, 110: 17790–17795.
[13] Seo P J, Lee S B, Suh M C, Park M J, Go Y S, Park C M. The MYB96 transcription factor regulates cuticular wax biosynthesis under drought conditions in., 2011, 23: 1138–1152.
[14] Mauricio R. Costs of resistance to natural enemies in field populations of the annual plant., 1998, 151: 20–28.
[15] Frank M J, Smith L G. A small, novel protein highly conserved in plants and animals promotes the polarized growth and division of maize leaf epidermal cells., 2002, 12: 849–853.
[16] Buckley T N. The control of stomata by water balance., 2005, 168: 275–291.
[17] Bergmann D C, Sack F D. Stomatal development., 2007, 58: 163–181.
[18] Liu T, Ohashi-Ito K, Bergmann D C. Orthologs ofstomatal bHLH genes and regulation of stomatal development in grasses., 2009, 136: 2265–2276.
[19] Kamiya N, Itoh J, Morikami A, Nagato Y, Matsuoka M. Thegene’s role in asymmetric cell divisions in rice plants., 2003, 36: 45–54.
[20] Apostolakos P, Livanos P, Giannoutsou E, Panteris E, Galatis B. The intracellular and intercellular cross-talk during subsidiary cell formation in: existing and novel components orchestrating cell polarization and asymmetric division., 2018, 122: 679–696.
[21] Wu Z L, Chen Li, Yu Q, Zhou W Q, Gou X P, Li J, Hou S W. Multiple transcriptional factors control stomata development in rice., 2019, 223: 220–232.
[22] Chater C C C, Caine R S, Fleming A J, Gray J E. Origins and evolution of stomatal development., 2017, 174: 624–638.
[23] Deeks M J, Kaloriti D, Davies B, Malho R, Hussey P J.NAP1 is essential for Arp2/3-dependent trichome morphogenesis., 2004, 14: 1410–1414.
[24] Zhang C, Mallery E L, Schlueter J, Huang S, Fan Y, Brankle S, Staiger C J, Szymanski D B.SCARs function interchangeably to meet actin-related protein 2/3 activation thresholds during morphogenesis., 2008, 20: 995–1011.
[25] Jorgens C I, Grunewald N, Hulskamp M, Uhrig J F. A role forin plant cell morphogenesis., 2010, 62: 925–935.
[26] Bai J T, Zhu X D, Wang Q, Zhang J, Chen H, Dong G, Zhu L, Zheng H, Xie Q, Nian J, Chen F, Fu Y, Qian Q, Zuo J. Riceencodes a suppressor of camp receptor-like protein that is important for actin organization and panicle development., 2015, 169: 1179–1191.
[27] Rao Y C, Yang Y L, Xu J, Li X, Leng Y, Dai L, Huang L, Shao G, Ren D, Hu J, Guo L, Pan J, Zeng D.encodes a SCAR-LIKE PROTEIN2 that affects water loss in rice., 2015, 169: 1225–1239.
[28] Eden S, Rohatgi R, Podtelejnikov A V, Mann M, Kirschner M W. Mechanism of regulation of WAVE1-induced actin nucleation byand, 2002, 418: 790–793.
[29] Welch M D, Mullins R D. Cellular control of actin nucleation., 2002, 18: 247–288.
[30] Kotchoni S O, Zakharova T, Mallery E L, Le J, El-Assal S E D, Szymanski D B. The association of theactin- related protein 2/3 complex with cell membranes is linked to its assembly status but not its activation., 2009, 151: 2095–2109.
[31] Frank M J. Threegenes have distinct functions in a common pathway promoting polarized cell division and cell morphogenesis in the maize leaf epidermis., 2003, 130: 753–762.
[32] Djakovic S, Dyachok J, Burke M, Frank M J, Smith L G. BRICK1/HSPC300 functions with SCAR and the ARP2/3 complex to regulate epidermal cell shape in., 2006, 133: 1091–1100.
[33] Basu D, El-Assal S E, Le J, Mallery E L, Szymanski D B. Interchangeable functions ofand the human WAVE complex subunitduring leaf epidermal development., 2004, 131: 4345–4355.
[34] Basu D, Le J, Zakharova T, Mallery E L, Szymanski D B. Asignaling complex controls actin-dependent cell morphogenesis through the heteromeric WAVE and ARP2/3 complexes., 2008, 105: 4044–4049.
[35] Jiang K, Sorefan K, Deeks M J, Bevan M W, Hussey P J, Hetherington A M. The ARP2/3 complex mediates guard cell actin reorganization and stomatal movement in., 2012, 24: 2031–2040.
[36] Singh D and Laxmi A. Transcriptional regulation of drought response: a tortuous network of transcriptional factors., 2015, 6: 895.
[37] 周文期. 调控水稻叶表皮发育的和基因克隆与功能分析. 兰州大学博士学位论文, 甘肃兰州, 2015.
Zhou W Q. The Cloning and Functional Analysis ofand, Two Genes, That Regulate the Epidermal Cell Development in Rice. PhD Dissertation of Lanzhou University, Lanzhou, Gansu, China, 2015 (in Chinese with English abstract).
[38] Huang X Y, Chao D Y, Gao J P, Zhu M Z, Shi M, Lin H X. A previously unknown zinc finger protein, DST, regulates drought and salt tolerance in rice via stomatal aperture control., 2009, 23: 1805–1817.
[39] 周文期, 寇思荣, 连晓荣, 杨彦忠, 刘忠祥, 王晓娟, 何海军, 周玉乾. 水稻和玉米叶表皮突变体的筛选和鉴定. 植物生理学报, 2020, 56: 189–199.
Zhou W Q, Kou S R, Lian X R, Yang Y Z, Liu Z X, Wang X J, He H J, Zhou Y Q. Screening and identification of leaf epidermal mutants in rice and maize., 2020, 56: 189–199 (in Chinese with English abstract).
[40] 周文期, 强晓霞, 聂永鑫, 卫万荣. 水稻基因克隆和遗传转化分析. 植物生理学报, 2020, 56: 1561–1572.
Zhou W Q, Qiang X X, Nie Y X, Wei W R. Cloning offrom rice and analysis of itsgenetic transformation., 2020, 56: 1561–1572 (in Chinese with English abstract).
[41] Chen Z, Borek D, Padrick S B, Gomez T S, Metlagel Z, Ismail A M, Umetani J, Billadeau D D, Otwinowski Z, Rosen M K. Structure and control of the actin regulatory WAVE complex., 2010, 468: 533–538.
[42] Huang L, Chen L, Wang L, Yang Y, Rao Y, Ren D, Dai L, Gao Y, Zou W, Lu X, Zhang G, Zhu L, Hu J, Chen G, Shen L, Dong G, Gao Z, Guo L, Qian Q, Zeng D. A Nck-associated protein 1-like protein affects drought sensitivity by its involvement in leaf epidermal development and stomatal closure in rice., 2019, 98: 884–897.
[43] Gao Y, Wu M, Zhang M, Jiang W, Liang E, Zhang D, Zhang C, Xiao N, Chen J. Roles of a maize phytochrome-interacting factors protein ZmPIF3 in regulation of drought stress responses by controlling stomatal closure in transgenic rice without yield penalty., 2018, 97: 311–323.
[44] Higaki T, Kutsuna N, Sano T, Kondo N, Hasezawa S. Quantification and cluster analysis of actin cytoskeletal structures in plant cells: role of actin bundling in stomatal movement during diurnal cycles inguard cells., 2010, 61: 156–165.
[45] Zhao Y, Zhao S, Mao T, Qu X, Cao W, Zhang L, Zhang W, He L, Li S, Ren S, Zhao J, Zhu G, Huang S, Ye K, Yuan M, Guo Y. The plant-specific actin binding protein SCAB1 stabilizes actin filaments and regulates stomatal movement in., 2011, 23: 2314–2330.
[46] Yoo C Y, Pence H E, Jin J B, Miura K, Gosney M J, Hasegawa P M, Mickelbart M V. TheGTL1 transcription factor regulates water use efficiency and drought tolerance by modulating stomatal density via transrepression of., 2010, 22: 4128–4141.
[47] Li X, Han H, Chen M, Yang W, Liu L, Li N, Ding X H. Chu Z H. Overexpression of, which encodes a novel cysteine-rich peptide, enhances drought tolerance and increases ABA concentration in rice., 2016, 93: 21–34.
[48] Park J J, Jin P, Yoon J, Yang J I, Jeong H J, Ranathunge K, Schreiber L, Franke R, Lee I J, An G. Mutation in() causes abnormal cuticle formation and rapid water loss in rice., 2010, 74: 91–103.
[49] Liu J, Zhang F, Zhou J, Chen F, Wang B, Xie X. Phytochrome B control of total leaf area and stomatal density affects drought tolerance in rice., 2012, 78: 289–300.
[50] Dey A, Samanta M K, Gayen S, Maiti M K. The sucrose non fermenting 1-related kinase 2 geneimproves drought tolerance and grain yield in rice by modulating cellular osmotic potential, stomatal closure and stress-responsive gene expression., 2016, 16: 158.
[51] Hetherington A M, Woodward F I. The role of stomata in sensing and driving environmental change., 2003, 424: 901–908.
[52] Pantin F, Blatt M R. Stomatal response to humidity: blurring the boundary between active and passive movement., 2018, 176: 485–488.
[53] Fang Y J, Xiong L Z. General mechanisms of drought response and their application in drought resistance improvement in plants., 2015, 72: 673–689.
[54] 刘延波, 项阳, 秦利军, 赵德刚. 转玉米基因烟草降低气孔密度提高抗旱性. 植物生理学报, 2014, 50: 1889–1898.
Liu Y B, Xiang Y, Qin L J, Zhao D G. Improvement of drought tolerance in transgenic tobacco expressed maizeby reducing stomatal density., 2014, 50: 1889–1898 (in Chinese with English abstract).
[55] 陈腾君, 曾丹, 张帆, 周永力, 石英尧, 黎志康.胁迫相关蛋白激酶OsSAPK9调控水稻对铝胁迫的反应. 植物遗传资源学报, 2018, 19: 1149–1153.
Chen T J, Zeng D, Zhang F, Zhou Y L, Shi Y Y, Li Z K. Stress-activated protein kinase OsSAPK9 is involved in regulating tolerant response to al stress in rice., 2018, 19: 1149–1153 (in Chinese with English abstract).
[56] Zhou W Q, Zhou Y Q, He C Y, Mou B Q, Zhou W. Over- expression ofenhances drought and salinity tolerance in rice., 2020, 67: 1152–1162.
[57] Isner J C, Xu Z, Costa J M, Monnet F, Batstone T, Ou X, Deeks M J, Genty B, Jiang K, Hetherington A M. Actin filament reorganization controlled by the SCAR/WAVE complex mediates stomatal response to darkness., 2017, 215: 1059–1067.
[58] Xiang Y, Sun X, Bian X, Wei T, Han T, Yan J, Zhang A. The transcription factorreduces stomatal density and improves drought tolerance in maize., 2021, 72: 1399–1410.
[59] Zhao B Y, Hu Y F, Li J J, Yao X, Liu K D., a bZIP transcription factor from rapeseed (L.), enhances drought and salt tolerance in transgenic., 2016, 57: 12–24.
Mechanism of drought and salt tolerance ofgene in rice
ZHOU Wen-Qi1,2, QIANG Xiao-Xia3, WANG Sen4, JIANG Jing-Wen1, and WEI Wan-Rong1,*
1Key Laboratory of Southwest China Wildlife Resources Conservation / College of Life Sciences, China West Normal University, Nanchong 637000, Sichuan, China;2Crops Research Institute, Gansu Academy of Agricultural Sciences, Lanzhou 730070, Gansu, China;3Lanzhou No. 4 High School, Lanzhou 730050, China;4Shannxi Province Animal Husbandry Industry Experimental Demonstration Center, Xianyang 713702, Shaanxi, China
Drought threatens global agricultural production and limits the prospects for sustainable agricultural development. Plant leaf epidermis plays a vital role in the process of growth, development, and resistance to adversity stress, and water and gas exchange with the external environment. In this study, compared with the wild-type Zhonghua 11 (ZH11), we found that mutants() and() were more sensitive to drought and salt stress response, and the survival rate after rewatering was extremely significantly reduced, which was less than half of the control. Compared with ZH11,andhad shorter plant height, shorter root length, significantly increased stomatal density and stomatal openings in the same phyllodes, and the serrated lobe of the epidermal cell margin becomes smoother, and the epidermal cell nesting was not tight, which might result in faster and more water loss ofandthan ZH11. The water loss experiment of separated leaves also proved that the water loss rate ofandleaves was higher than that of the ZH11 in equal time. Overexpression ofwas transferred into, and the/transgenic positive plants recovered the smooth epidermis ofand the sensitive phenotype to drought and salt stress. These results showed thatgene not only controlled the microfilament synthesis and morphogenesis of rice epidermal cells, but also played a key role in response to plant stress by regulating stomatal density, stomatal conductance, and root growth and development. This study provides a theoretical basis for revealing the molecular regulation mechanism ofin response to drought stress in rice.
rice; drought tolerance; salt resistance; SCAR/WAVE complex; plant leaf epidermis
10.3724/SP.J.1006.2022.12032
本研究由2020年甘肃省科协青年科技人才托举工程项目和甘肃省农业科学院农业科技创新专项——博士基金项目(2020GAAS34)资助。
This study was supported by the Young Scientific and Technological Talents Support Project of Gansu Association for Science and Technology in 2020 and the Agricultural Science and Technology Innovation Program of Gansu Academy of Agricultural Sciences (2020GAAS34).
卫万荣, E-mail: weiwr18@126.com
E-mail: zhouwenqi850202@163.com
2021-05-01;
2021-10-19;
2021-11-20.
URL: https://kns.cnki.net/kcms/detail/11.1809.S.20211117.2106.006.html

