典型学校社区环境指示菌耐药性时空分布
林永豪, 李晓东, 徐传芳, 胡 会, 陈欣然, 徐 睿, 谢美燕, 凌炎光, 俞道进, 黄一帆 [福建农林大学动物科学学院(蜂学学院),福建省中西兽医结合与动物保健重点实验室,福建 福州 350002]
摘要: 设立福建农林大学校园内17个水域位点,进行逐月采样,分离培养大肠杆菌和肠球菌并测定其对几种常用抗生素的耐药性.结果表明,在水环境中有74.52%的分离菌存在不同程度的耐药情况.其中肠球菌对利福平耐药率最高(65.82%),对万古霉素和环丙沙星较敏感,耐药率分别为5.06%和7.59%;大肠杆菌对四环素耐药率最高(43.59%),对环丙沙星和呋喃妥因较为敏感,耐药率均为7.69%.总体而言,9—10月环境指示菌的耐药程度高于11—12月.在17个采样点中,受污水影响较强的湿地公园和观音湖地区分离的细菌耐药性更强,并且较多为多重耐药菌株.
随着抗生素广泛应用于人类及动物的疾病防治、农业生产、畜牧及水产养殖等领域[1],抗生素耐药性(antimicrobial resistance, AMR)逐渐成为世界性的重大公共卫生问题,耐药细菌(antibiotic resistant bacteria, ARB)与耐药基因(antibiotic resistant gene, ARG)作为新型环境污染问题受到广泛关注[2].
我国抗生素生产量和使用量均位居世界第一[3].2013年中国的抗生素使用量达16.2×104t,其中52%为兽用,48%为人用[4].抗生素处方药占医院处方药50%以上,人均年消费抗生素量高达138 g[5,6].调查表明,我国整体地表水环境中抗生素浓度与美国、法国等国家相当或略高[7].近年来,福建省畜禽与水产养殖业发展迅速,抗生素使用较为广泛,其中福建省龙海市紫泥镇滩涂养殖区抗生素污染调查结果表明,该地区磺胺类和喹诺酮类抗生素污染严重,环境残余浓度达3.54~40.2 ng·L-1[8].
环境是耐药性传播的关键节点,而水环境具有较大的流动性和较高的生物承载量,成为ARB或ARG传播的重要途径.用于医药和畜牧渔业的抗生素总量有50%~80%直接转移到环境中[9].据报导,我国部分地区自来水中含有高达679.7 ng·L-1的抗菌残留药物[10].水环境细菌耐药已是全球化的常态现象[11,12],从美国俄亥俄州多个游泳池和热水浴缸中分离到的铜绿假单胞菌分离株有96%具有多重耐药性[13].中国九龙江流域中97.1%的分离菌株表现出不同程度的耐药性,其中,70.6%的菌株表现为多重耐药[14].目前在污水处理厂、养殖场、饮用水等不同环境介质中均已检测出ARB[15].但是对于典型社区,尤其是学校水环境细菌耐药性的研究较为缺乏.
肠球菌为革兰氏阳性球菌,大肠杆菌为革兰氏阴性短杆菌,两者广泛分布于生物体内与自然环境中,因此常常被当做环境指示菌.肠球菌能够对氨基糖苷类、头孢菌素类、亚麻酸类和链球菌类耐药[16],也可以通过可移动基因元件获得更广泛的耐药性[17].大肠杆菌对多种抗生素也产生耐药性,耐药机制主要涉及抗生素酶、药物渗透障碍、质粒介导、靶位点改变、生物被膜等5个方面[18].目前社会与环境中大肠球菌和肠球菌耐药研究集中在人源和动物源,对水环境指示菌的耐药调查较少[19].
学校作为特殊的人类社区,具有人员密集与较为封闭的特点,其水域环境细菌耐药研究具有重要意义.本试验选择福建农林大学作为研究对象,通过多次逐月采样,探究典型学校社区水环境中环境指示菌(大肠杆菌和肠球菌)对多种抗生素的耐药情况,并探究其空间分布与时间变化,为社区水环境耐药研究提供依据.
1 材料与方法
1.1 水样采集与前处理

1:瀑布,2:动科楼旁水沟,3~8:观音湖,9:田间实验室水沟, 10:蜂学学院旁湖,11~13:湿地公园,14~15:中华园, 16:创新楼旁水沟,17:海峡研究院旁水沟.图1 福建农林大学采样点分布Fig.1 Distribution of the sampling points across Fujian Agriculture and Forestry University campus
在福建农林大学金山校区设立17个采样点,于2020年9—12月逐月进行水样与底泥样品的采集(图1).每个采样点使用采水器在离岸3~5 m的水域下0.3~0.5 m深处进行采水,每份水样采集500 mL,且部分水域挖取底泥于无菌容器中.水样用0.22 μm滤膜过滤富集细菌后,所得滤膜置于3 mL肉汤进行下一步的培养,底泥直接取1 g置于3 mL BHI肉汤进行下一步培养.
1.2 细菌初步分离鉴定
将上述装有滤膜与底泥样品的BHI肉汤封装置于的摇床(37 ℃,190 r·min-1)培养8 h,增菌后的菌液划线接种于SBM(肠球菌选择培养基CM0377)培养基和MAC培养基.37 ℃恒温培养18~24 h,继续划线接种,纯化大肠杆菌和肠球菌.本试验所用质控菌株为粪肠球菌ATCC29212,所用大肠杆菌为大肠埃希氏菌ATCC25922,均购自中国药品生物制品检验所.
将初步鉴定后的肠球菌菌株接种到BHI肉汤,大肠杆菌菌株接种到LB肉汤,培养至对数期,取1 mL对数期菌液于灭菌离心管中,采用水煮法提取DNA[20].
用PCR法鉴定肠球菌和大肠杆菌.选取引物参考GenBank公布的大肠杆菌和肠球菌16SrRNA基因序列进行设计(表1).
根据PremixTaq说明书配制反应体系,设置反应条件,肠球菌反应条件:98 ℃预变性2 min,98 ℃变性10 s,退火10 s,72 ℃延伸10 s,33个循环,最后72 ℃延伸2 min.大肠杆菌反应条件:98 ℃预变性2 min,98 ℃变性10 s,退火10 s,72 ℃延伸10 s,33个循环,最后72 ℃延伸2 min.将PCR产物进行琼脂糖凝胶电泳检测.阴性对照为灭菌双蒸水.

表1 肠球菌和大肠杆菌特异性引物Table 1 Specific primers for Enterococcus and E.coli
1.3 药敏试验
严格根据美国临床与实验室标准协会(CLSI)微量肉汤稀释法[21],测定分离环境指示菌对几种常用抗生素(头孢唑林、头孢噻肟、氨苄西林、四环素、环丙沙星、呋喃妥因、氨苄西林、万古霉素、红霉素、利福平等购自中国药品生物制品检定所)的最小抑菌浓度(the minimum inhibitory concentration, MIC).
1.4 数据分析
使用Surfer (Golden Software, Golden, CO, USA)绘制福建农林大学环境指示菌耐药地理热图.
2 结果与分析
2.1 环境指示菌分离与鉴定
105份环境样品中分离出肠球菌79株,分离率为75.24%,水样品分离出65株,底泥样品分离出14株;分离出大肠杆菌78株,分离率为74.29%,其中水样品分离出57株,底泥样品分离出21株.
2.2 药敏试验
2.2.1 环境指示菌对抗菌药物的耐药情况 分离得到的79株肠球菌对红霉素和利福平的耐药率最高(表2),分别为62.03%(49/79),65.82%(52/79);对万古霉素最敏感,耐药率仅为5.06%(4/79).分离的大肠杆菌对氨苄西林和四环素的耐药率最高(表3),均为43.59%(34/78);对环丙沙星和呋喃妥因最敏感,耐药率仅为7.69%(6/78).本次底泥与水样来源的分离菌耐药性未体现规律性差异.在9、10月只采集到耐氨苄西林和耐万古霉素肠球菌;9—12月采集的肠球菌对呋喃妥因、氨苄西林、万古霉素的耐药率随时间推移而降低(图2、图3).本次采集的大肠杆菌对7种抗生素的耐药率在11月最低,且9—10月大肠杆菌对头孢唑林、头孢噻肟、呋喃妥因的耐药率高于11—12月.
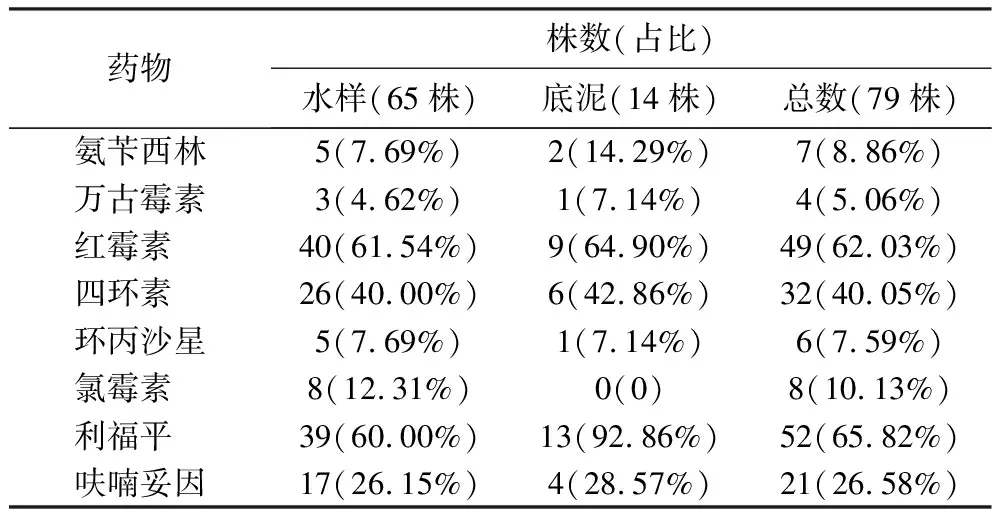
表2 79株肠球菌对8种抗菌药物的耐药情况Table 2 Drug resistance of 79 strains of Enterococcus to 8 kinds of antibiotics
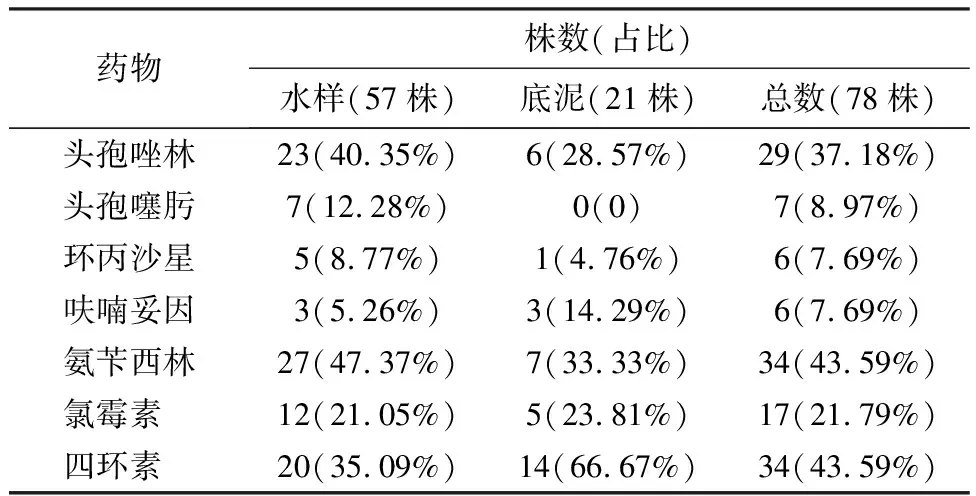
表3 78株大肠杆菌对7种抗菌药物的耐药情况Table 3 Drug resistance of 78 strains of E.coli to 7 kinds of antibiotics

图2 肠球菌的耐药变化趋势Fig.2 Variation trend of drug resistance of Enterococcus in different months
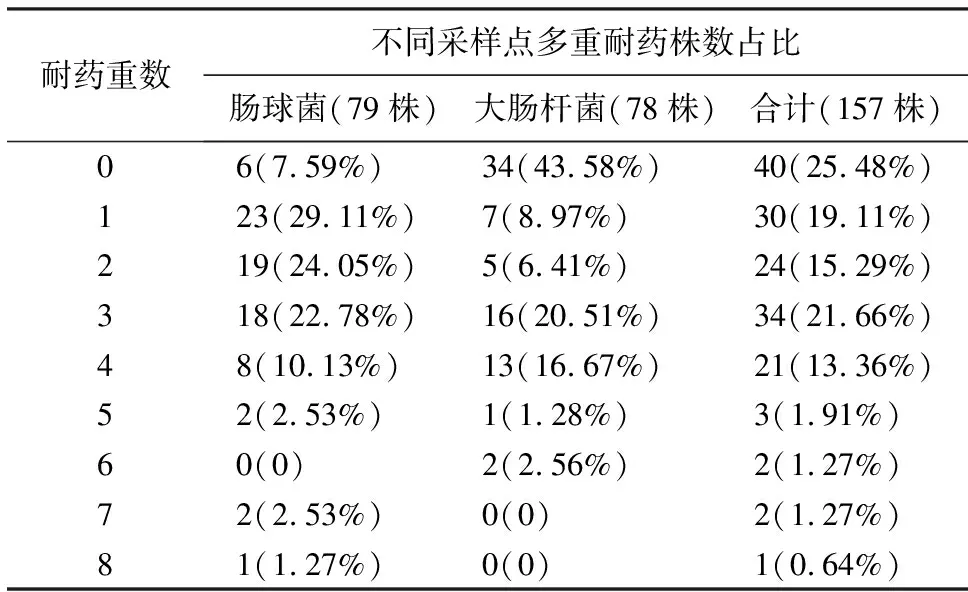
表4 肠球菌与大肠杆菌的耐药谱型Table 4 Drug resistance profile of Enterococcus and E.coli
2.2.2 环境指示菌的耐药谱 79株肠球菌对8种抗菌药物的耐药性分析表明(表4),多重耐药以1~3重为主,其中1重耐药最多(29.11%).共有2株肠球菌高达7重耐药,1株肠球菌高达8重耐药.78株大肠杆菌共有34株对7种抗菌药物均敏感,占总数的43.58%;其次以3,4重耐药为主,分别占20.51%和16.67%.共分离到1株5重耐药大肠杆菌和2株6重耐药大肠杆菌.
2.3 耐药菌空间分布
2.3.1 耐药肠球菌空间分布 9—11月,湿地公园与观音湖地区分离菌耐药性更强,且更容易分离到多重耐药细菌(图4a、图4b、图4c).9月份从湿地公园分离到1株7重耐药肠球菌;在观音湖分离到1株5重耐药肠球菌,其他地域的肠球菌耐药重数低于4重.10月份分离到1株8重耐药肠球菌,1株7重耐药肠球菌,都分离自湿地公园;在观音湖附近的水域分离到1株5重耐药肠球菌,其余肠球菌的耐药重数都低于5重.11月分离到19株肠球菌耐药重数最高仅4重,共分离到3株4重耐药肠球菌,分别采自观音湖,湿地公园和海峡研究所旁水沟.12月份肠球菌耐药重数最高是4重,共分离到2株4重耐药肠球菌(图4d),分别采自观音湖和中华园.
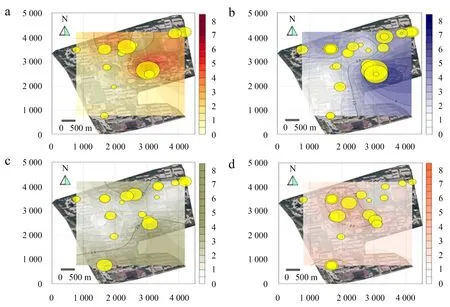
a:9月份肠球菌;b:10月份肠球菌;c:11月份肠球菌;d:12月份肠球菌.热图着色深浅和黄圈大小对应此区域分离菌耐药重数高低.图4 福建农林大学水域耐药肠球菌分布Fig.4 Distribution map of antibiotics-resistant of Enterococci in different sampling points across of Fujian Agriculture and Forestry University campus from September to December
2.3.2 耐药大肠球菌空间分布 9月份共分离出11株大肠杆菌,在湿地公园分离到1株6重耐药大肠杆菌(图5a).10月份观音湖与湿地公园的大肠杆菌耐药性高于其他地区,在湿地公园分离出1株6重耐药大肠杆菌,观音湖分离出1株5重耐药大肠杆菌,其余大肠杆菌的耐药重数均低于5重(图5b).11月份共分离出16株大肠杆菌,耐药重数最高为4重,仅1株且来自观音湖(图5c).12月份共分离出19株大肠杆菌,耐药重数最多的大肠杆菌采自湿地公园,高达5重耐药(图5d).
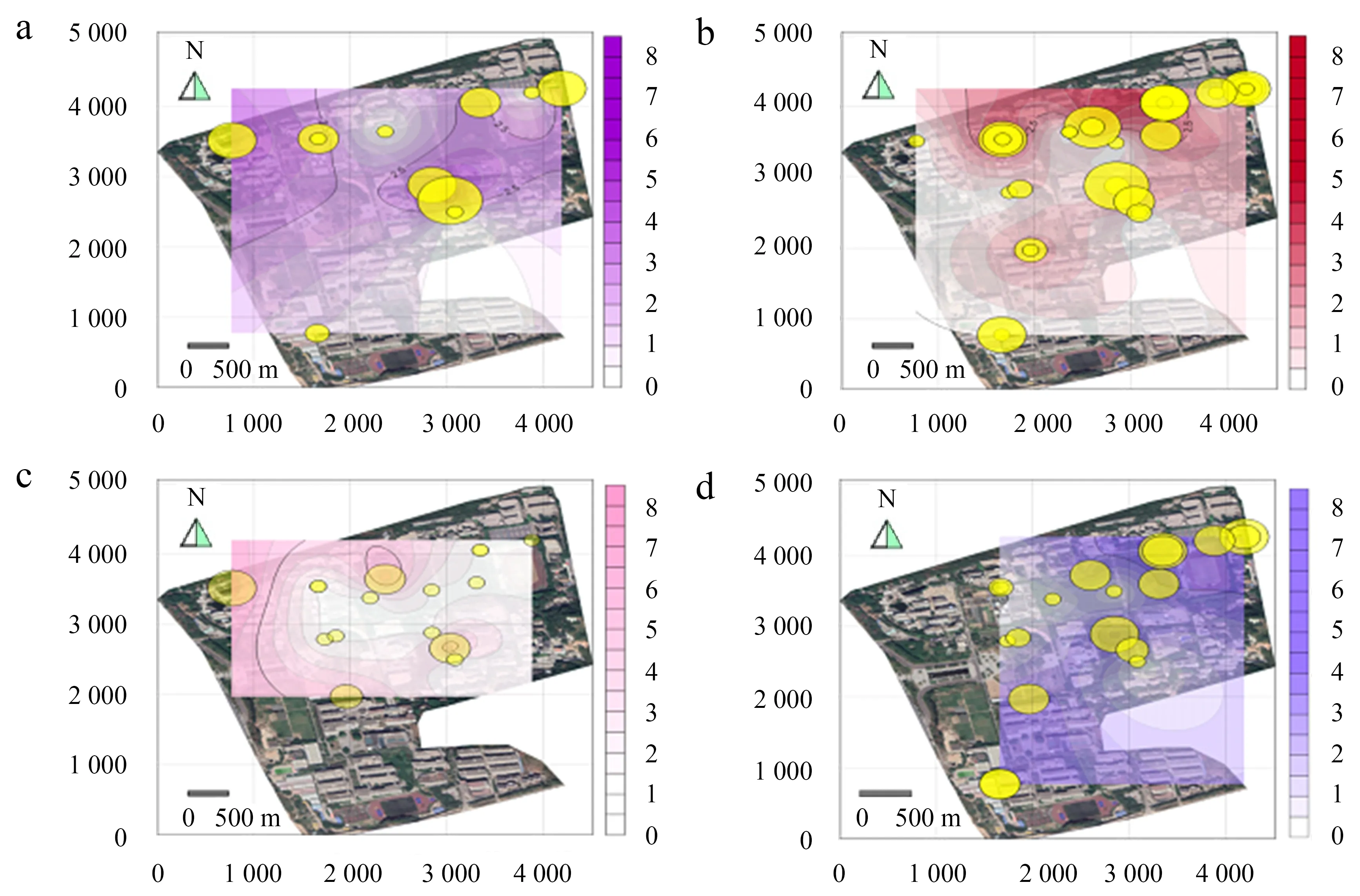
a:9月份大肠杆菌;b:10月份大肠杆菌;c:11月份大肠杆菌;d:12月份大肠杆菌.热图着色深浅和黄圈大小对应此区域分离菌耐药重数高低.图5 福建农林大学水域耐药大肠杆菌分布Fig.5 Distribution map of antibiotics-resistant of E.coli in different sampling points across Fujian Agriculture and Forestry University campus from September to December
3 讨论
水环境样品细菌分离率往往较低.本试验采用真空抽滤机和0.22 μm滤膜富集细菌的方法,提高了大肠杆菌和肠球菌的分离率.共分离出79株肠球菌,分离率为75.24%,高于福建闽江等地区(71.43%)[22];分离出78株大肠杆菌,分离率为74.29%,高于贵州地区(70.89%)[23].
试验结果表明,肠球菌耐药率为92.41%,对氨苄西林、万古霉素、环丙沙星较为敏感,对氯霉素的耐药率为10.13%,低于闽江地区水源性肠球菌对氯霉素的耐药水平[22],这可能与近年来氯霉素被禁止用作兽用抗生素有关.对红霉素的耐药率为62.03%,高于闽江流域的50%.对利福平的耐药率最高(65.82%),对四环素的耐药率为40.05%.大肠杆菌耐药率为62.82%,低于肠球菌耐药率,对环丙沙星和呋喃妥因较为敏感,对其他抗生素存在不同程度的耐药,尤其对四环素的耐药率最高(42.37%),这种耐药趋势与大部分研究结果相同[24-26].因此,福建农林大学水环境细菌耐药问题已较为严重.
温度是细菌繁殖的最强驱动因素之一,温度升高可加快细菌生长速度,并且还能促进耐药基因的水平转移[27].总体而言,在气温相对较高的9、10月,环境指示菌的耐药程度高于气温相对较低的11、12月,且只有在9、10月采集到耐氨苄西林和耐万古霉素肠球菌.世界卫生组织已经证实了气温升高对全球各种传染病的影响,然而气温变化对细菌耐药性变化的影响往往被忽视.气温的小幅度升高也能够引起细菌耐药率的升高.欧洲多个国家常见细菌抗生素耐药性生态学分析表明,较高的环境最低温度对细菌耐药性的增强有显著影响[28].气温变化还能影响人与动物活动强度,例如出游频率,随着人类活动的增加,可能会促进抗生素的使用.因而气温变化可能是9、10月环境指示菌抗生素耐药性更强的原因.水质参数的改变同样能影响细菌菌群的抗生素耐药性.福建有很多类似福建农林大学观音湖、湿地公园的水体,这种水环境相对较封闭,而学校小湖泊附近的各种污水、药物等排到湖泊里,经年累月不断积累,湖泊自身净化速度低于污染速度,水体急剧恶化形成富营养化水体,湖泊变成了污水、细菌、抗生素的富集库.因此,这种情况下的水环境细菌在污水、抗生素等选择压力下产生突变、抗性基因等以适应环境,加速了细菌对抗生素的耐药率、抗性基因的传播.
按取样地点对细菌耐药情况进行分类,取样点3、6、7、11、12、13更容易分离到多重耐药菌,分离菌耐药程度明显高于其他水域.耐药严重的地方有湿地公园与观音湖及进水口.进水口耐药的原因是引入的闽江水已被抗生素及其他污染物污染[29],引进水时将闽江的耐药菌一并带入校园水体,观音湖以及湿地公园水体均是闽江水,这两个地方的水体又是连通的,因此耐药率均较高.其次,研究表明,浮游藻类生物量与水体的营养状况呈正相关,偏高的营养盐水平为浮游藻类的生长与耐药菌的富集创造了有利条件[30].湿地公园水域常年呈现肉眼可见的深绿色,细菌富集阶段存在大量藻类,可能是水体富营养化,氮磷水平较高,附近有污水源的汇入,除了抗生素,污水中还有氮、磷、金属元素等,在环境选择压力下,细菌通过基因突变、菌株基因转移等方式获得耐药性以适应环境,最后出现多重耐药现象.
其他采样点分离菌耐药率相对较低.可能是因为水流动性强,相对独立,污水排放少,如10号采样点(蜂学学院旁的湖)、14、15号采样点(中华园池塘)比较独立,不受其他水体污染.而2、9、16、17号采样点为水沟,水流动性较强,抗生素等污染物和细菌随水流流动,不易为耐药菌提供富集场所,导致其细菌耐药率相对较低.
本试验中,福建农林大学各水体和底泥中1~8重耐药菌均出现,主要以1~4重耐药为主,2重以上耐药率为55.41%.且大部分采样点出现多重耐药菌,观音湖和湿地公园出现5重以上耐药情况.人与畜禽很容易通过饮水、淋浴等多种途径接触到水环境中的致病菌,给人畜健康带来巨大安全隐患,福建农林大学水环境的细菌耐药问题已不容忽视.如今,对所有抗生素均耐药的“超级细菌”越来越多,而新抗生素的开发越来越难.新药物的使用也会产生新的耐药.或许更应该溯源抗生素污染源,从源头治理以延缓和避免细菌耐药的发生.

