建立重症狼疮性肾炎模型并探索其与足细胞蛋白nephrin、P-cadherin的相关性
王晨 林栩 唐志明 韦美理 吴昱升 王蓉


【摘要】 目的 建立重癥MRL/lpr小鼠狼疮性肾炎(lupus nephritis,LN)动物模型,并对模型成功与否进行验证,进一步探索狼疮性肾炎与足细胞蛋白nephrin、P-cadherin的相关性。
方法 将实验动物分为三组:空白组、模型组和脂多糖组。空白组为雌性C57小鼠8只,模型组及脂多糖组为雌性MRL/lpr小鼠各8只,其中脂多糖组腹腔注射脂多糖(lipopolysaccharide,LPS),空白组及模型组每周注射等量生理盐水。20周后检测小鼠尿蛋白,处死动物,收集各组小鼠肾组织。苏木精-伊红染色法 (hematoxylin-eosin staining,HE)染色观察小鼠肾脏组织。RT-qPCR和Western blot检测肾组织中nephrin、P-cadherin的mRNA及蛋白表达。
结果 与空白组相比,模型组小鼠尿蛋白升高,肾脏病理损伤严重;与模型组相比,LPS组小鼠尿蛋白升高,肾脏损伤进一步加重;此外肾组织中nephrin、P-cadherin表达水平在三组间逐步下降(P<0.01)。
结论 用 LPS腹腔注射的 MRL/lpr小鼠可诱导加重狼疮,且狼疮性肾炎的严重程度与 nephrin及P-cadherin相关。
【关键词】 狼疮性肾炎;细菌脂多糖;足细胞损伤;nephrin;P-cadherin
中图分类号:R692 文献标志码:A DOI:10.3969/j.issn.1003-1383.2022.03.001
Establishment of a model of severe lupus nephritis and exploration of its correlation with podocyte proteins nephrin and P-cadherin
WANG Chen, LIN Xu▲, TANG Zhiming, WEI Meili, WU Yusheng, WANG Rong
(Nephrology Department of Affiliated Hospital, Guangxi Key Laboratory of Basic Medical Research Support for Immune Related Diseases,Youjiang Medical University for Nationalities, Baise 533000, Guangxi, China)
【Abstract】 Objective To establish the animal model of severe MRL/lpr mouse lupus nephritis (LN), and to verify the success of the model, so as to further explore correlation between LN and nephrin and P-cadherin of podocyte proteins.
Methods Experimental animals were divided into three groups: blank group, model group and lipopolysaccharide group. There were 8 female C57 mice in the blank group, 8 female MRL/lpr mice in the model group and 8 female MRL/lpr mice in the lipopolysaccharide group, the lipopolysaccharide group were injected intraperitoneally with lipopolysaccharide (LPS), while the blank group and the model group were injected with the same amount of normal saline every week. After 20 weeks, the urine proteins of mice were detected, the animals were killed, and the renal tissues of mice in each group were collected. And then, hematoxylin-eosin staining (HE) was used to observe the renal tissues of mice, and RT-qPCR and Western blot were used to detect the mRNA and protein expressions of nephrin and P-cadherin in renal tissues.
Results Compared with the blank group, the urinary proteins in the model group increased and the pathological damage of kidney was serious; compared with the model group, the urinary proteins in the LPS group increased, and the renal injury was further aggravated. In addition, the expression levels of nephrin and P-cadherin in renal tissues decreased gradually among the three groups(P<0.01).
Conclusion MRL/lpr mice injected intraperitoneally with LPS can induce and aggravate lupus, and the severity of lupus nephritis is related to nephrin and P-cadherin.
【Key words】 LN; LPS; podocyte injury; nephrin; P-cadherin
狼疮性肾炎(lupus nephritis,LN)是系统性红斑狼疮整体发病率及死亡率高的主要危险因素,且维持临床狼疮患者的肾功能至关重要。狼疮性肾炎临床上以免疫抑制剂治疗为主,缺乏特异性。有研究指出Ⅰ型狼疮性肾炎及Ⅱ型狼疮性腎炎不需特殊治疗,Ⅲ型及Ⅳ型则需要免疫治疗,而Ⅴ型及Ⅵ型的治疗方案则仍然存在争议。因此,针对不同类型的狼疮开发个性化疗法,进一步完善治疗方案,改善狼疮病人的生存质量非常必要。同时nephrin作为足细胞标志蛋白,其表达的变化反映足细胞损伤轻重程度,P-cadherin则参与足细胞上皮间质转化影响肾小球硬化的进程。故本研究使用脂多糖(LPS)建立重症狼疮模型,探究狼疮与足细胞损伤的相关性,为进一步探讨其发病机制,建立狼疮的治疗框架提供理论支持。
1 材料与方法
1.1 实验动物
8周龄 MRL/lpr 雌性小鼠(B6.MRL Faslpr/Nju)16只及C57BL/6雌性小鼠8只(SPF级,上海斯莱克公司)。实验过程中对动物的处置符合实验动物伦理学标准。
1.2 实验试剂
LPS(美国Sigma),尿蛋白试剂盒(南京建成),TRIzol Reagent(invitrogen),BeyoRTTMIIcDNA第一链合成试剂盒(D7168M),引物(上海生工),引物序列见表1。RIPA(强)、PMSF、BCA试剂盒(碧云天),P-cadherin抗体(13773-1-AP),nephrin抗体(ab216341),β-actin抗体(66009-1-lg)。
1.3 实验方法
1.3.1 小鼠模型制备
将MRL/lpr小鼠随机分成 2组, LPS组每周腹腔注射LPS(1 mg/kg),模型组及空白组腹腔每周注射生理盐水。
1.3.2 组织病理学分析造模
12周后取小鼠肾脏,固定、脱水、石蜡包埋、切片、苏木精-伊红(HE)染色,脱水、透明、封片,光学显微镜下观察肾脏切片病理变化并拍照。
1.3.3 肾功能检测
给药最后一周用代谢笼收集小鼠尿液,尿蛋白试剂盒检测尿蛋白。
1.3.4 qRT-PCR检测
(1)TRIzol抽提RNA,测定A260/280及RNA 浓度,RNA纯度均在1.8~2.0之间。(2)取2.5 μg总RNA反转录合成cDNA, 具体操作按照碧云天逆转录试剂盒说明书进行。(3)LightCycler96实时荧光定量PCR仪进行扩增。(4)数据处理:以GAPDH作为内参,检测P-cadherin、nephrin的mRNA表达,以2-△△CT法计算两者mRNA相对表达量。
1.3.5 Western blot法检测
(1)提取蛋白质:收集处理好的各实验组小鼠肾脏,加入裂解液及蛋白酶抑制剂30分钟,12 000 g离心10分钟后提取总蛋白。(2)BCA法测定蛋白浓度。(3)取蛋白加入上样缓冲液煮沸10分钟后,进行电泳、转膜、封闭、一抗二抗孵育。稀释比例为nephrin(1∶1000)、P-cadherin(1∶1000)、 GAPDH(1∶20 000)抗体,二抗(1∶6000)。(4)显影:利用Image J软件进行半定量分析。
1.4 统计学方法
统计图表用 Graph Pad Prism 8.0绘制。用Excel 建立数据库,采用SPSS 24.0软件进行统计分析,数据符合正态分布,采用(±s)表示,多组均数的比较采用单因素方差分析(One-way ANOVE),两两比较选择LSD-t分析法,检验水准:α=0.05,双侧检验。
2 结 果
2.1 小鼠外形的观察
实验期间每天观察小鼠精神及身体状态,空白组小鼠进食正常,精神状态好,体重持续增长。模型鼠体重前期正常增长,12周龄后体重不增反降,毛发有部分脱落,一些小鼠出现明显的红斑样病变,LPS组出现如图1所示颈部、腋下等全身多处淋巴结肿大。
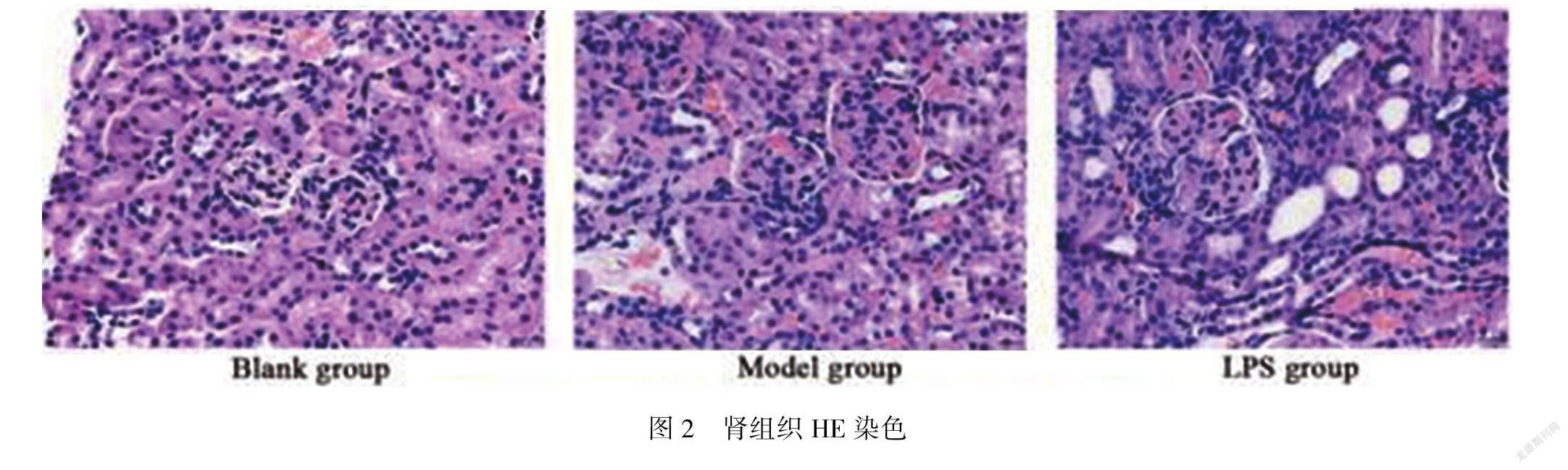
2.2 HE染色
结果显示:对照组小鼠肾脏结构清晰,未见增生和炎症细胞浸润。模型组出现轻度的肾小球系膜细胞增生,伴有少量淋巴细胞浸润。LPS组镜下观则有肾小球细胞明显增大,且有大量淋巴细胞浸润。见图2。
2.3 尿蛋白水平
尿蛋白检测结果显示,各组与空白组相比,尿蛋白的表达水平差异有统计学意义(P<0.001)。模型组小鼠尿蛋白与空白组相比有增长趋势(P<0.001)。LPS组小鼠注射 LPS后,尿蛋白含量较模型组相比有明显增长趋势(P<0.001)。如下表2、图3所示。
2.4 RT-PCR检测P-cadherin、nephrin的mRNA的表达
各组与空白组相比,P-cadherin、nephrin的mRNA表达水平差异有统计学意义(P<0.001);与模型组比较,LPS组足细胞蛋白P-cadherin、nephrin明显下降,差异有统计学意义(P<0.001)。见图4。
2.5 Western blot法检测P-cadherin、nephrin蛋白的表达
与空白组比较,其余两组P-cadherin、nephrin蛋白表达均降低(P<0.0001),与模型组比较,LPS组P-cadherin、nephrin蛋白表达进一步降低(P<0.05)。各组蛋白电泳图及柱状分析图见图5。
3 讨 论
MRL/lpr小鼠是一种自发性狼疮模型鼠,约20周龄可自发狼疮性肾炎。其肾炎表现与人类相似,是较为常用的狼疮模型。本研究采用自发性狼疮小鼠MRL/lpr作为轻型模型组,LPS诱导 MRL/lpr 小鼠产生重型狼疮性肾炎,并检测三组间nephrin及P-cadherin的表达,探讨LN是否发生足细胞损伤,且足细胞损伤是否与狼疮病情的发展有相关性。
MRL/lpr小鼠缺点是个体差异大,不能保证发病情况的同一性。LPS是革蘭阴性菌的外膜成分,其中脂A是最具生物活性的部分,是内毒素和主要毒力因子,起促进感染过程的核心作用。脂多糖组以LPS加快 MRL/lpr小鼠狼疮发病进程,与不注射LPS的模型组小鼠相比肾脏病变更加统一,尿蛋白水平显著升高,肾脏病理炎性改变明显,狼疮足细胞相关蛋白表达减少,且随着狼疮病情的加重可进一步下降。这表明足细胞损伤是狼疮性肾炎发病机制之一,且与病情的发展密切相关;足细胞的损伤是LN进展的原因之一,可通过减少足细胞的损伤延缓狼疮性肾炎的发展。
足细胞是肾小球滤过屏障(glomerular filtration barrier,GFB)的基本成分,在其特殊分子和电荷特性中起着重要作用。足细胞的结构完整及功能正常对于肾脏维持正常的生理功能至关重要。肾小球疾病患者往往与足细胞损伤相关。足细胞损伤在狼疮性肾炎前期的发病过程中就可能起到至关重要的作用。研究表明足细胞裂孔蛋白nephrin可以激活整合素β1,影响足细胞与细胞外基质的附着,从而使足细胞丢失和肾小球基底膜剥脱,最终导致慢性肾脏病。为了进一步探讨狼疮分子水平的发病机制,在建立轻重狼疮模型的基础上我们进一步将足细胞相关蛋白nephrin纳入研究范畴,以期发现狼疮性肾炎进展的分子基础。
同时肾小球的硬化也是肾脏疾病需要关注的一大方向,延缓肾小球的硬化对于改变狼疮病人的预后有着举足轻重的作用。上皮间充质转换(epithelial-mesenchymal transition,EMT)即上皮细胞失去上皮细胞的特征,获得间充质细胞的特征。在乳腺癌的研究中发现P-cadherin是乳腺癌发生中一个重要的临床预后因素和可能的治疗靶点,可以作为EMT的标志物。Jagge/Notch等多种途径信号通路可诱导糖尿病肾病中足细胞EMT发生。临床研究证明Jagge/Notch在狼疮病人足细胞中的表达可能是蛋白尿和肾小球硬化发展的共同(下游)途径。足细胞属于一种上皮细胞,在受外界损伤性刺激时会发生足细胞上皮间充质转化。足细胞EMT发生后,nephrin、podocin、ZO-1表达下调,缝隙横膈膜(slit diaphragm,SD)改变,肌动蛋白细胞骨架重新排列,2型EMT是从E-cadherin到N-cadherin的转换,不同于2型EMT的是,足细胞EMT上皮样表型标志蛋白P-cadherin会转变为N-cadherin,也是导致肾小球硬化的重要病理机制。本研究通过PCR和Western blot考察裂孔蛋白nephrin与跨膜蛋白P-cadherin的表达情况,进一步验证狼疮与足细胞损伤及肾小球硬化的相关性。
本研究LN模型成功建立证明MRL/lpr小鼠模型具备面部红斑等典型症状及淋巴结肿大、肾小球病变等临床特征。且使用LPS诱导MRL/lpr小鼠建立LN模型在加重小鼠狼疮病情同时可确保发病时机一致,减少狼疮重症造模过程中小鼠的意外死亡。可以为LN发病机制及临床治疗研究提供良好的前期基础,同时本研究将足细胞损伤及狼疮性肾炎联系起来,进一步探索发现足细胞相关蛋白nephrin及P-cadherin参与了狼疮性肾炎的发病机制,且与病情进展一致,可作为LN疾病进展的标志,为狼疮性肾炎的治疗提供了靶点,针对足细胞相关蛋白的治疗可以应用于临床狼疮的治疗,也可作为预后分析指标对临床用药起指示作用,为新的特异性药物的研发提供了指导作用。
参 考 文 献
[1]ALMAANI S,MEARA A,ROVIN B H.Update on lupus nephritis.Clin J Am Soc Nephrol,2017,12(5):825-835.
[2]MAHAJAN A,AMELIO J,GAIRY K,et al.Systemic lupus erythematosus,lupus nephritis and end-stage renal disease:a pragmatic review mapping disease severity and progression.Lupus,2020,29(9):1011-1020.
[3]AZIZ F,CHAUDHARY K.Lupus nephritis:a treatment update.Curr Clin Pharmacol,2018,13(1):4-13.
[4]CRAMPTON S P,MORAWSKI P A,BOLLAND S.Linking susceptibility genes and pathogenesis mechanisms using mouse models of systemic lupus erythematosus.Dis Model Mech,2014,7(9):1033-1046.
[5]SANTIAGO-RABER M L,LAPORTE C,REININGER L,et al.Genetic basis of murine lupus.Autoimmun Rev,2004,3(1):33-39.
[6]FARHANA A, KHAN Y S. Biochemistry, Lipopolysaccharide.In: StatPearls.Treasure Island (FL): StatPearls Publishing, 2021.
[7]MASON R M,WAHAB N A.Extracellular matrix metabolism in diabetic nephropathy.J Am Soc Nephrol,2003,14(5):1358-1373.
[8]郑心彤,凌霄雁,古贤君,等.miR-155在TGF-β1诱导足细胞损伤中的表达及其与synaptopodin、CD2AP表达的相关性.中国免疫学杂志,2019,35(7):786-791.
[9]YOU H,GAO T,RAUP-KONSAVAGE W M,et al.Podocyte-specific chemokine (C-C motif) receptor 2 overexpression mediates diabetic renal injury in mice.Kidney Int,2017,91(3):671-682.
[10]HAN T S,SCHWARTZ M M,LEWIS E J.Association of glomerular podocytopathy and nephrotic proteinuria in mesangial lupus nephritis.Lupus,2006,15(2):71-75.
[11]KRAFT S W,SCHWARTZ M M,KORBET S M,et al.Glomerular podocytopathy in patients with systemic lupus erythematosus.J Am Soc Nephrol,2005,16(1):175-179.
[12]DLUGOS C P,PICCIOTTO C,LEPA C,et al.Nephrin signaling results in integrin β1 activation.J Am Soc Nephrol,2019,30(6):1006-1019.
[13]RIBEIRO A S,PAREDES J.P-cadherin linking breast cancer stem cells and invasion:a promising marker to identify an "intermediate/metastable" EMT state.Front Oncol,2014,4:371.
[14]YING Q D,WU G Z.Molecular mechanisms involved in podocyte EMT and concomitant diabetic kidney diseases:an update.Ren Fail,2017,39(1):474-483.
[15]MUREA M,PARK J K,SHARMA S,et al.Expression of Notch pathway proteins correlates with albuminuria,glomerulosclerosis,and renal function.Kidney Int,2010,78(5):514-522.
[16]MAY C J,SALEEM M,WELSH G I.Podocyte dedifferentiation:a specialized process for a specialized cell.Front Endocrinol (Lausanne),2014,5:148.
[17]WANG X L,GAO Y B,TIAN N X,et al.Astragaloside IV inhibits glucose-induced epithelial-mesenchymal transition of podocytes through autophagy enhancement via the SIRT-NF-κB p65 axis.Sci Rep,2019,9(1):323.
(收稿日期:2021-10-21 修回日期:2021-12-11)
(編辑:梁明佩)

