二十碳五烯酸对高果糖诱导的胰岛素抵抗大鼠骨骼肌GLUT4和p-Akt表达的影响
斯日古楞 郝丹丹 李天柱 乌英嘎 田慧敏 张凤宁 白春英 瑞云


摘 要:目的:探讨二十碳五烯酸(eicosapentaenoic acid, EPA)对高果糖诱导的胰岛素抵抗大鼠中骨骼肌葡萄糖转运蛋白4(glucose transporter 4, GLUT4)和蛋白激酶B(protein kinaze B, Akt)表达的作用。方法:将大鼠随机分为对照组(CON)、高果糖组(HF)和高果糖+EPA组(HF+EPA)。EPA组为高果糖饲料添加6%的EPA。EPA摄入4周后,分别检测各组大鼠空腹血糖(FBG)、空腹血清胰岛素(FIns)及计算胰岛素抵抗指数(HOMA-IR),研究EPA对胰岛素敏感性的作用。采用Western Blot方法检测骨骼肌GLUT4和p-Akt的表达。结果:与CON组比较,HF组睾丸周围脂肪湿重显著升高(P<0.05);与HF组比较,HF+EPA组睾丸周围脂肪湿重显著降低(P<0.05)。与CON组比较,HF组FBG、FIns、HOMA-IR均显著升高(P<0.05);与HF组比较,HF+EPA组FBG、FIns、HOMA-IR均显著降低(P<0.05)。与CON组比较,HF组骨骼肌GLUT4和p-Akt表达显著减少(P<0.05);与HF组比较,HF+EPA组骨骼肌GLUT4和p-Akt表达显著增加(P<0.05)。结论:EPA能够显著改善高果糖诱导的骨骼肌胰岛素抵抗,机制涉及EPA能上调骨骼肌GLUT4和p-Akt的表达,调控胰岛素信号分子蛋白表达,从而改善骨骼肌胰岛素抵抗。
关键词:二十碳五烯酸;胰岛素抵抗;GLUT4;Akt
中图分类号:R587.1 文献标识码:A 文章编号:1673-260X(2022)03-0028-03
胰岛素抵抗(Insulin resistance, IR)是指机体靶器官、靶组织对生理浓度的胰岛素生物效应的反应性下降或丧失而产生的病理状态[1]。骨骼肌是利用葡萄糖和维持血糖平衡的重要组织,发生胰岛素抵抗的主要部位。在骨骼肌细胞中,在胰岛素的信号刺激下,骨骼肌中的葡萄糖摄取主要葡萄糖转运蛋白4(glucose transporter 4, GLUT4)的介导,胰岛素与其受体结合,激活蛋白激酶B(protein kinaze B, Akt)分子,从而改变GLUT4的转位和利用,促进骨骼肌的葡萄糖摄取[2]。胰岛素信号转导障碍是IR发生的主要机制之一。二十碳五烯酸(又称十二碳五烯酸,eicosapentaenoic acid,EPA)是一种n-3系列多不饱和脂肪酸(n-3 PUFAs),具有降低心血管疾病风险、减少血中中性脂肪值、缓和炎症性疾病的症状等作用[3-5]。由胰岛素抵抗的改善是n-3 PUFAs的生物效应引起的疾病预防主要机制之一。目前未报到EPA摄入对高果糖诱导大鼠骨骼肌胰岛素抵抗的作用。本研究选择胰岛素抵抗大鼠,观察EPA对其骨骼肌组织中GLUT4和p-Akt表达的影响及其作用机制。
1 实验材料与方法
1.1 实验材料
1.1.1 实验动物
Wistar大鼠24只(雄性,体重220~230g)购自北京维通利华实验动物技术有限公司。将大鼠在恒温(23±2℃)的实验室饲养,自由饮食、饮水,明暗交替时间12h/12h。
1.1.2 主要试剂
二十碳五烯酸(纯度98%)购自上海源叶生物科技有限公司;D-果糖购自上海生工生物工程有限公司;胰岛素放射免疫试剂盒购自上海沪峰生物科技有限公司;GLUT4抗体、Akt抗体购自上海雅吉生物科技有限公司。
1.2 實验方法
1.2.1 动物分组和模型制造
适应饲养1周,将大鼠随机分为3组,即对照组(CON)、高果糖组(HF)和高果糖+EPA组(HF+EPA),每组8只。对照组给予普通饲料喂养,HF组给予高果糖饲料喂养,HF+EPA组给予高果糖饲料添加6%的EPA喂养。每周称体重1次。4周高果糖饲料喂养建立胰岛素抵抗模型[6]。
1.2.2 标本采集
EPA摄入4周后,将各组大鼠放入代谢笼禁食、禁水12h,尾静脉取血待测;腹主动脉取血,以3000r/min离心20min,分离血清,-20℃保存待测。断颈处死大鼠,解剖取骨骼肌样本,-80℃冻存待测;同时取睾丸周围脂肪组织,测量湿重。
1.2.3 测定空腹血糖、血清胰岛素
EPA摄入4周后,将各组大鼠放入代谢笼禁食、禁水12h,血清标本采集,次日采用葡萄糖氧化酶法测定空腹血糖(FBG)、放免法测定血液中胰岛素(FIns)的浓度。具体按照试剂盒说明书操作。
1.2.4 计算胰岛素抵抗指数
使用稳态模型(HOMA)评估胰岛素抵抗指数(HOMA-IR)[7]。HOMA-IR模型公式为HOMA-IR =FBG(mg/dl)×FIns(ng/ml)/22.5。
1.2.5 检测GLUT4和p-Akt表达
采用Western blot检测GLUT4、Akt1/2和p-Akt,方法进行[8]。使用SDS-PAGE分离了10μg来自肌肉的蛋白质提取物,将蛋白质转移到PVDF膜上。在室温下用5%脱脂奶粉盐缓冲液(TBS)封闭1h后,将膜与1:1000稀释的一抗在4°C振荡孵育过夜。然后TBS-T洗三次,并与1:1000加入辣根过氧化物标记相应的二抗在室温下震荡孵育1h,TBS洗三次。使用ECL试剂盒进行荧光显示反应。暗室中曝光,显影,使用Image-J软件进行分析。
1.3 统计学处理
实验数据以均数±标准差(x±s)的形式表示。应用GraphPad Prism 8.0软件进行统计分析,组间比较单因素方差分析,P<0.05为有显著差异。
2 结果
2.1 各组大鼠体重、睾丸脂肪组织湿重比较
EPA摄入4周后,各组之间体重无明显差异(P>0.05)。与CON组比较,HF组睾丸周围脂肪组织湿重显著升高(P<0.05);与HF组比较,HF+EPA组睾丸周围脂肪组织湿重显著降低(P<0.05),如表1所示。
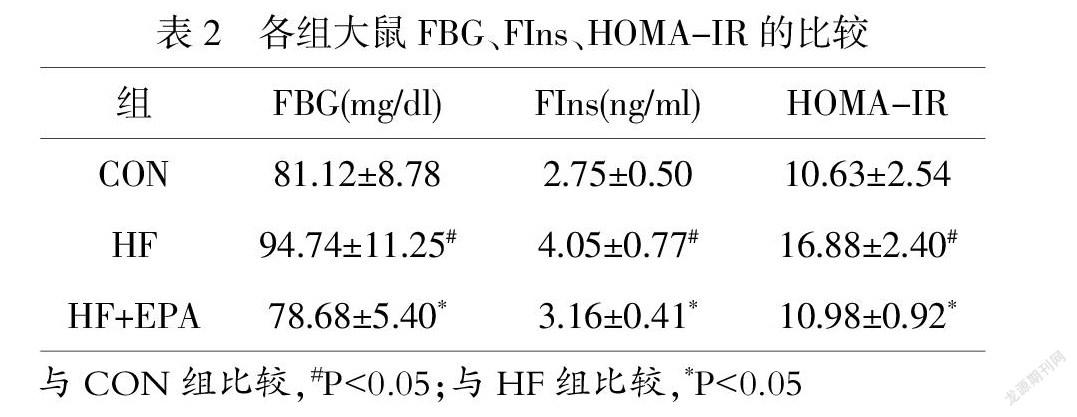
2.2 各组大鼠空腹血糖(FBG)、胰岛素(FIns)、胰岛素抵抗指数(HOMA-IR)的比较
EPA摄入4周后,与CON组比较,HF组FBG、FIns均显著增加(P<0.05);与HF组比较,HF+EPA组FBG、FIns均显著减少(P<0.05)。与CON组比较,HF组HOMA-IR显著升高(P<0.05);与HF组比较,HF+EPA组HOMA-IR显著降低(P<0.05),如表2所示。
2.3 各组大鼠GLUT4和p-Akt表达的比较
EPA摄入4周后,各组之间Akt1/2蛋白表达无明显差异。与CON组比较,HF组骨骼肌组织中GLUT4、p-Akt的表达量显著减少(P<0.05)。与HF组比较,HF+EPA组骨骼肌组织中GLUT4、p-Akt的表达量显著增加(P<0.05),如表3和图1所示。
3 讨论
目前,随着社会经济的发展,生活方式的改变,尤其是果糖大量摄入导致肥胖、2型糖尿病等疾病已成为全球人们的健康问题。这些疾病的最主要病理生理机制是胰岛素抵抗(IR)。如果机体胰岛素分泌障碍,胰岛素信号通路异常,会导致葡萄糖转运和利用降低,诱导IR的发生[9]。胰岛素的主要信号通路是PI3K/Akt信号转导途径。研究表明,IR使胰岛素刺激引起的PI3K/Akt信号转导途径发生障碍,骨骼肌对血糖的吸收减弱[10]。GLUT4能在胰岛素刺激下使骨骼肌摄取葡萄糖。PI3K激活Akt后,通过GLUT4分子促进葡萄糖的利用,从而发挥胰岛素代谢调節作用。在胰岛素和运动的刺激下,GLUT4从细胞内转位至细胞膜上,膜上的葡萄糖转运中起到作用[11,12]。因此,GLUT4和p-Akt表达是改善IR的关键环节之一。
近期研究发现,高果糖诱导的动物模型中n-3 PUFAs防止高果糖引起的胰岛素敏感组织的脂肪酸谱变化,从而改善IR[13]。糖尿病模型中,n-3 PUFAs之一的EPA可改变胰岛素信号转导通路,使骨骼肌中GLUT4的表达增加[14]。但EPA对高果糖引起的IR大鼠骨骼肌中GLUT4和p-Akt的作用仍未报道。本研究用高果糖喂养的大鼠建立胰岛素抵抗模型,并进行EPA摄入方式。研究结果表明,各组大鼠体重无显著差异,但HF组睾丸周围脂肪湿重、FGB、FIns、HOMA-IR均升高,表明高果糖诱导的IR模型建立成功;EPA摄入后,睾丸周围脂肪湿重、FGB、FIns、HOMA-IR均降低。这些结果表明EPA能改善高果糖诱导的IR。Western Blot结果显示,HF组中骨骼肌GLUT4表达水平减少,表明高果糖摄入使葡萄糖转运和利用下降;EPA摄入后,骨骼肌GLUT4表达水平显著增加,表明EPA明显改善葡萄糖转运和利用。为了进一步观察EPA改善IR大鼠骨骼肌GLUT4的表达,是否与胰岛素信号传导通路相关。检测胰岛素信号中的分子p-Akt的表达水平。与GLUT4的结果一致,IR大鼠EPA摄入后骨骼肌p-Akt明显上调。提示EPA可上调PI3K/Akt信号通路,通过GLUT4分子促进葡萄糖的转运和利用,改善胰岛素抵抗。
综上所述,高果糖诱导的大鼠产生IR,并存在骨骼肌组织胰岛素信号通路异常。EPA可能上调骨骼肌GLUT4和p-Akt的表达,调控胰岛素信号分子蛋白表达,从而改善骨骼肌胰岛素抵抗。
——————————
参考文献:
〔1〕Gariani K, Marques-Vidal P, Gérard W,et al.Salivary cortisol is not associated with incident insulin resistance or type 2 diabetes mellitus [J]. Endocrine Connections, 2019, 8(07):870-877.
〔2〕Govers R.Cellular regulation of glucose uptake by glucose transporter GLUT4 [J]. Advances in Clinical Chemistry, 2014, 66:173-240.
〔3〕Miller M, Ballantyne CM, Bays HE, et al. Effects of icosapent ethyl (eicosapentaenoic acid ethyl ester) on atherogenic lipid/lipoprotein, apolipoprotein, and inflammatory parameters in patients with elevated high-sensitivity C-reactive protein (from the ANCHOR Study) [J]. Am J Cardiol, 2019, 124(05):696 -701.
〔4〕丁凌玉,汪艳蛟,马晓慧,等.深海鱼油对血脂异常人群的血脂和血糖的影响[J].营养学报,2020, 42(01):25-29.
〔5〕Manson JE, Cook NR, Lee IM, et al. Marine n-3 fatty acids and prevention of cardiovascular disease and cancer [J]. N Engl J Med, 2019, 380(01):23-32.
〔6〕Li P, Koike T, Jiang HY, et al. Acute treatment with candesartan cilexetil, an angiotensin Ⅱ type 1 receptor blocker,improves insulin sensitivity in high fructose-diet fed rats [J]. Horm Metab Res, 2012, 44(04):286-290.
〔7〕Olatunji LA, Soladoye AO. Increased magnesium intake prevents hyperlipidemia and insulin resistance and reduces lipid preoxidation in fructose-fed rants [J]. Pathophysiology, 2007,14:11-15.
〔8〕Siriguleng, Koike T, Natsume Y, Iwama S, OSHIDA Y. Effect of Prior Chronic Aerobic Exercise on Overload-Induced Skeletal Muscle Hypertrophy in Mice [J]. Physiol Res, 2018, 67: 765-775.
〔9〕Pessin JE, Saltiel AR. Signaling pathways insulin action: molecular targets of insulin resistance [J]. J Cli Invest, 2000, 106:165-169.
〔10〕Cusi K, Maezono K, Oaman A, et al. Insulin resistance differentially affects the pi3-kinase- and MAP kinase-mediated signaling in human muscle [J]. J Cli Invest, 2000, 105:311-320.
〔11〕Goodyear LJ, Kahn BB: Exercise, glucose transport, and insulin sensitivity[J]. Annu Rev Med, 1998, 9:235-261.
〔12〕衣雪潔,孙玉霞,姚婷婷,等.急、慢性运动对2型糖尿病大鼠脂肪PI3K/AKT/GLUT4通路的影响[J].中国应用生理学杂志,2020,36(01):12-16.
〔13〕Robbez Masson V, Luccas A, Gueugneau AM, et al. Long-chain (n-3) polyunsaturated fatty acids prevent metabolic and vascular disorders in fructose-fed rats[J]. J Nutr, 2008, 138:1915-1922.
〔14〕Figueras M, Olivan M, Busquets S, Lopez-soriano FJ, Argiles JM. Effects of eicosapentaenoic acid (EPA) treatment on insulin sensitivity in an animal model of diabetes: improvement of the inflammatory status [J]. Obesity (Silver Spring, Md), 2011, 19:362-369.

