茶籽皂苷改善高脂饮食诱导的肥胖小鼠脂肪代谢及氧化应激水平
曹文瀞,刘爽,苏彦民,李嘉丽,覃会珊,曾榛,2*,宋家乐,3,4*
(1.桂林医学院公共卫生学院,广西桂林 541199)(2.中南大学湘雅公共卫生学院,湖南长沙 410000)(3.桂林医学院第二附属医院临床营养科,广西桂林 541109)(4.广西卫生健康委员会全生命周期健康保健研究实验室,广西环境暴露组学与全生命周期健康重点实验室,广西桂林 541199)
肥胖是一种以白色脂肪组织增大和体内脂肪异常蓄积为主要表现的慢性代谢性疾病[1]。据2016年世界卫生组织(WHO)的调查数据显示,全世界有超过19亿成年人存在超重或肥胖,发生率达38.9%[2]。随着人们生活水平和经济条件的提高,肥胖已经成为全世界主要卫生问题之一。有研究表明,脂质过度堆积引起体内氧化应激增加是肥胖相关代谢综合征的重要致病机制之一[3]。氧化应激是由于细胞和组织中活性氧簇(reactive oxygen species,ROS)的产生速度远高于机体清除速度,从而造成大量ROS积累在体内各处并引发组织器官的氧化损伤[4]。正常生理条件下,细胞表现出一种自我保护的抗氧化活性,从而防止由酶和非酶引起的氧化损伤[5]。长期摄入高脂饮食(High fat diet,HFD)则会诱导肥胖,导致机体能量摄入与消耗的不平衡,造成大量ROS的产生及游离脂肪酸的增加和释放入血,最终引起机体的脂质代谢紊乱及氧化应激状态,而这一系列事件均与心血管疾病、糖尿病及各种癌症的发生存在有密切的联系[6-8]。已有研究表明,脂肪堆积与高氧化应激状态有关,而通过改善机体的氧化应激状态有助于起到改善肥胖状态的目的[9,10]。
茶是中国及世界范围内最受欢迎的健康饮料之一。茶叶中富含有许多对人体有益的天然化合物(如儿茶素、茶黄素和类黄酮等)。茶籽皂苷(Tea seed saponin,TSS)又称为茶皂素,是一类天然存在的齐墩果烷型五环三萜类皂苷化合物,广泛存在于山茶科植物的种子、根、茎、叶和花中[11]。现有的研究提示,TSS具有降血脂[11]、抗癌[12]、抗病毒[13]、抗真菌[14]、降血糖[15,16]、调节肠道菌群[17]、预防阿尔茨海默氏病[18]等生物学作用。但对于茶籽皂苷在降脂减肥、改善氧化应激等方面相关作用机制的研究报道则较少。
AMP激活的蛋白激酶(Adenosine 5-monophosphate (AMP)-activated protein kinase,AMPK)是生物体内重要的能量感应器,主要参与维持着机体能量代谢平衡。烟酰胺腺嘌呤二核苷酸辅酶(nicotinamide adenine dinucleotide,NAD+)依赖性蛋白脱乙酰酶(Sirtuin1,SIRT1)/AMPK途径是重要的能量代谢通路之一,可调节肝脏中的脂质和葡萄糖代谢[19]。过氧化物酶体增殖物激活受体γ辅激活物1-alpha(peroxisome proliferater activated receptorγcoactivator-1α,PGC-1α)与线粒体能量代谢密切相关且能被上游因子SIRT1激活[20]。过氧化物酶体增殖物激活受体γ(peroxisome proliferator-activated receptorγ,PPAR-γ)属于过氧化物酶体增殖物激活受体PPARs(peroxisome proliferator activated-receptors)家族,可协同AMPK增加线粒体的生物发生,促进脂肪酸的β-氧化[21]。基于上述研究,以高脂饮食诱导的肥胖小鼠为模型,观察茶籽皂苷干预对肥胖小鼠脂质代谢及氧化应激的影响,探究茶籽皂苷是否通过调控AMPK/SIRT1/PGC-1α通路及PPAR-γ来实现其抗肥胖、抗氧化作用。
1 材料与方法
1.1 材料与试剂
普通维持饲料(AIN-93M)及HFD饲料,购于常州鼠一鼠二生物科技有限公司;HFD(60%脂肪供能比)组分为玉米淀粉22.75%、酪蛋白20%、麦芽糊精13.2%、猪油17%、蔗糖10%、玉米油7%、纤维素5%、矿物质混合物3.5%、维生素混合物1%、蛋氨酸0.3%、酒石酸氢胆碱0.25%;茶籽皂苷(批号:F02040019122601),购自湖南汉清生物技术有限公司;羧甲基纤维素钠(sodium carboxymethyl cellulose,CMC)购自中国汕头西隆科技有限公司;总胆固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)、低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)、高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)生化试剂盒均购于江苏科特生物科技有限公司;超氧化物歧化酶(superoxide dismutase,SOD)、丙二醛(malonic dialdehyde,MDA)、谷胱甘肽(glutathione,GSH)试剂盒均购于南京建成生物工程研究所;甘油醛-3-磷酸脱氢酶(GAPDH)购自武汉塞维尔生物科技有限公司;PPAR-γ、AMPK、p-AMPK、SIRT1、PGC-1α抗体购自上海碧云天生物技术有限公司。
1.2 仪器与设备
FA2004电子天平,上海舜宇恒平科学仪器有限公司;Eppendorf 5424R型冷冻离心机,德国Eppendorf公司;ELx808酶标仪,美国BioTek公司;DM4B正置荧光显微镜,德国LEICA公司;FluorChem M超灵敏多色荧光化学发光成像分析系统,美国ProteinSimple公司;KZ-II高速组织研磨仪,武汉塞维尔生物科技有限公司。
1.3 实验动物
SPF级雄性C57BL/6J小鼠(共35只,四周龄,体重17~22 g),购自湖南斯莱克景达实验动物有限公司(实验动物生产许可证号:SCXK(湘)2019-0004),饲养于桂林医学院公共卫生学院SPF级动物房(实验设施使用许可证号:SYXK(桂)2020-0005)。所有小鼠饲养环境保持室内温度23±3 ℃,相对湿度50%~60%,每日光照时间12 h,室内通风良好,自由摄食,清洁饮水。
1.4 实验方法
1.4.1 实验动物分组及高脂小鼠模型构建
总35只小鼠经适应性喂养1周后,随机分为正常组(N=7)和肥胖模型组(N=28)。造模期间,正常组饲喂普通维持饲料,模型组饲喂HFD饲料。6周后,如模型组小鼠体重高于正常组小鼠平均体重20%以上,则判定为造模成功[22]。
1.4.2 茶籽皂苷干预处理
将肥胖模型组28只小鼠随机分为肥胖对照组、茶籽皂苷低、中、高剂量组。各组干预方式如表1所示,药物干预组分别给予持续4周的不同剂量的茶籽皂苷(以0.5%的CMC液配制)灌胃。茶籽皂苷干预期间,每3 d进行体质量监测,每日进行摄食量和精神状态的监测,所有小鼠自由摄食及清洁饮水。
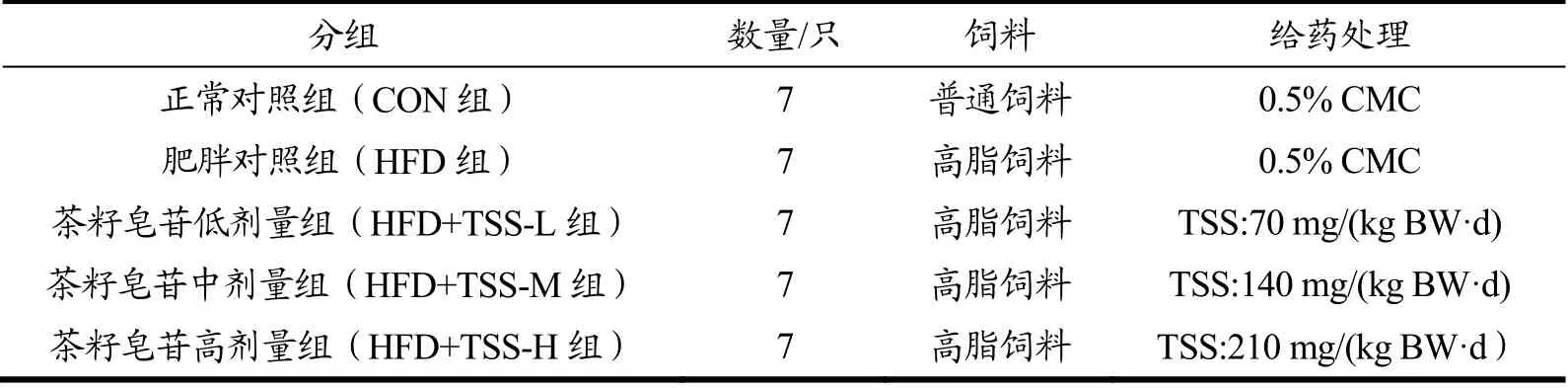
表1 动物分组及干预处理Table 1 Animal grouping and intervention methods
1.4.3 血液及器官组织的取材
给药干预四周后,各组小鼠禁食不禁水12 h,测量小鼠体重及体长。腹腔注射1%戊巴比妥钠(0.1 mL/10 g)麻醉后,腹主动脉取血1 mL置于干净的EP管内。在4 ℃,3500 r/min的条件下离心10 min后取血清。将取血后的小鼠置于冰上并迅速分离肝脏、附睾脂肪、肾周脂肪及腹部脂肪,保存于-80 ℃冰箱备用。
1.4.4 血清中生化指标及氧化应激指标的测定
根据试剂盒说明书,检测依1.4.3中所述制备得的小鼠血清生化指标(TC、TG、HDL-C、LDL-C)和氧化应激指标(SOD、MDA、GSH)水平。
1.4.5 肝脏组织形态学观察
取各组小鼠相同部位的肝组织,10%的多聚甲醛固定后,进行石蜡包埋并进行H&E染色,显微镜下观察各组小鼠脂肪变性程度,拍照记录。
1.4.6 Western Bolt法检测肝脏组织中相关蛋白的表达
称取一定质量小鼠肝脏组织(50~60 mg),用预冷的磷酸盐缓冲液(PBS)清洗血污,滤纸吸干,按比例加入组织蛋白裂解液(含PMSF),破碎匀浆,提取组织总蛋白。在4 ℃,12000 r/min的条件下离心10 min,收集上清液采用BCA法测定蛋白浓度,将所有组织样品蛋白浓度调整为1.9 mg/mL。配制SDS-聚丙烯酰胺凝胶电泳(SDS-PGCE)胶,每孔加样20 μL,浓缩胶80 V,分离胶120 V,电泳120 min。恒定电流240 mA湿法转膜1 h,将转膜完的NC膜放于5%的脱脂牛奶中封闭4 h。孵育一抗过夜,用1×TBST溶液洗膜后慢摇孵育二抗1 h,1×TBST溶液洗膜3次后,加入特超敏ECL化学发光试剂,自动化学发光成像仪检测相关蛋白的表达情况。
1.5 数据处理与统计分析
本研究中实验结果以均值(means)±标准偏差(SD)表示。所得实验数据运用SPSS 23.0统计软件进行单因素方差分析与统计处理,当p<0.05时差异具有统计学意义。
2 结果与讨论
2.1 茶籽皂苷干预对高脂饮食诱导的肥胖小鼠体重和Lee's指数的影响
小鼠灌胃给药期间,正常对照组小鼠精神状态良好,反应迅速,活动敏捷,采食正常。HFD组小鼠体型增大,活动减少,抓取时反应迟钝。与HFD组相比,茶籽皂苷不同处理组小鼠的精神状态有所改善,活动增多,体态变小。造模期结束后,造模组28只小鼠体质量均大于正常组小鼠体质量20%,可纳入实验组进行后续实验。由表2可知,与正常对照组相比,高脂饮食造模后HFD组初始体重增加了36.54%(p<0.05),茶籽皂苷各剂量组初始体重较HFD组差异无统计学意义(p>0.05)。给药干预期结束后,与HFD组相比,茶籽皂苷各剂量组体重分别下降了9.80%、16.25%及23.25%(p<0.05)。Lee's指数可作为评价小鼠肥胖程度的有效指标[23]。与正常对照组相比,HFD组小鼠Lee's指数显著增加了9.49%(p<0.05),与HFD组相比,茶籽皂苷处理能够显著降低高脂饮食诱导肥胖小鼠的Lee's指数,分别下降了1.88%、4.83%及6.38%(p<0.05)。

表2 茶籽皂苷对高脂饮食诱导的小鼠体质量和Lee's指数的影响Table 2 Effects of tea seed saponin on body weight and Lee's index in high fat diet fed mice
通过对小鼠每日摄食量的检测,给予高脂饲料喂养的各组小鼠给药干预期间的摄食量如表3所示。给药干预4周内,与HFD组比较,茶籽皂苷各剂量组小鼠的摄食量无显著性差异(p>0.05),林玲[11]等的研究结果也提示,给予茶籽皂苷干预并不会影响大鼠的饮水量和饮食量,可排除茶籽皂苷对小鼠的降体重作用是通过减少摄食量实现的可能。

表3 各组高脂饮食小鼠摄食量Table 3 The diet of high fat diet fed mice in each group
2.2 茶籽皂苷对高脂饮食诱导的肥胖小鼠器官质量的影响
由图1可知,相比正常组,HFD组的附睾脂肪、肾周脂肪和腹部脂肪重量显著升高(p<0.05)。与HFD组相比,给药处理4周后,茶籽皂苷各剂量组附睾脂肪、肾周脂肪和腹部脂肪重量明显降低,且脂肪重量降低的程度与给药剂量呈正比关系。HFD+TSS-L组、HFD+TSS-M组和HFD+TSS-H组的附睾脂肪脏器指数分别下降18.85%、33.40%和43.85%;肾周脂肪脏器指数分别下降15.28%、36.90%和55.42%;腹部脂肪脏器指数分别下降17.20%、40.93%和49.10%,除HFD+TSS-L组无显著性差异外,其他两组差异具有统计学意义(p<0.05),且茶籽皂苷高剂量组的干预效果最好。这一结果提示,茶籽皂苷可以通过降低小鼠脂肪组织的重量,缓解脂肪组织堆积抑制小鼠体重的增加。
2.3 茶籽皂苷对高脂饮食诱导的小鼠肝脏指数和肝脏脂肪变性的影响
肝脏指数可以反映肝脏的损伤程度,当肝脏出现水肿、增生和充血等病理变化时,肝脏指数增大,肝脏指数下降则说明器官出现萎缩和退行性病变等[24]。由图2可知,与正常对照组相比,HFD组的肝脏指数显著增加(p<0.05)。与HFD组相比,干预给药4周之后,茶籽皂苷各剂量组小鼠的肝脏指数分别下降了15.73%、22.49%和21.83%,差异具有统计学意义(p<0.05),但茶籽皂苷各剂量组之间无显著性差异。这一结果提示茶籽皂苷能够改善高脂饮食诱导肥胖小鼠肝脏的损伤程度。而给予不同剂量茶籽皂苷干预(50~150 mg/kg)能够显著降低高脂饮食所致高脂血症大鼠肝脏指数的升高[11]。
由图2可知,正常对照组小鼠肝脏组织细胞大小均一,排列紧密,细胞轮廓清晰,核仁明显。与正常对照组相比,HFD组肝脏组织脂肪变性程度明显,组织中脂滴增多,细胞间空隙增大,部分细胞出现气球样病变和水肿现象。而经茶籽皂苷干预4周后,肥胖小鼠的肝脏脂肪变性程度得到明显改善,主要表现为脂滴明显减少,细胞间空隙缩小,细胞轮廓逐渐清晰,且HFD+TSS-H组与正常对照组相比无显著性差异。本研究结果提示,茶籽皂苷干预能够改善肝脏脂肪变性的程度,且改善程度与给药剂量呈剂量依赖性。而这一实验结果与林玲等[11]研究中茶籽皂苷能够改善大鼠肝脏细胞脂肪变性的结果较为接近。同时,茶籽皂苷干预也能改善HFD联合链脲佐菌素(STZ)所诱发2型糖尿病大鼠的肝脏脂肪变性程度[16,25]。
2.4 茶籽皂苷对高脂饮食诱导的小鼠血清脂代谢水平的影响
如图3所示,与正常对照组相比,高脂肪组血清TC、TG、LDL-C水平显著升高(p<0.05),血清HDL-C水平降低,但无显著性差异。茶籽皂苷干预后,小鼠血清中TC、TG、LDL-C水平显著降低(p<0.05),HDL-C水平升高,且呈剂量依赖性。与模型组相比,茶籽皂苷各剂量组小鼠血清TC水平分别降低3.47%、25.72%和37.83%,TG水平降低40.84%、50.30%和64.77%,LDL-C水平降低52.17%、69.99%和76.83%,血清HDL-C水平分别升高17.05%、37.74%和67.26%。这一结果说明,茶籽皂苷干预后能有效恢复小鼠因高脂饮食喂养后引起的血脂代谢紊乱,对调节机体脂代谢具有良好的作用。而在高血脂症大鼠和2型糖尿病大鼠模型中,茶籽皂苷的干预同样也能够分别有效改善血清代谢指标(即降低TC、TG和LDL-C,并升高HDL-C水平)[11,16,25],同时降低了高脂血症大鼠的动脉硬化指数(atherosclerosis index,AI)水平[11]。
2.5 茶籽皂苷对高脂饮食小鼠肝脏AMPK/SIRT1/PGC-1α通路的影响
AMPK和PGC-1α是机体能量代谢的关键调节因子,在机体各种能量代谢过程中都发挥着重要作用[26-28]。SIRT1是烟酰胺腺嘌呤二核苷酸依赖性脱乙酰基酶,调节参与葡萄糖和脂质代谢的各种基因的表达,有研究报道,SIRT1可以通过其去乙酰化作用调节细胞代谢[27]。由图4可知,与正常对照组相比,模型组中磷酸化的AMPK、SIRT1和PGC-1α蛋白表达水平显著降低(p<0.05)。茶籽皂苷干预后能够显著促进AMPK的磷酸化并对SIRT1和PGC-1α蛋白上调水平且呈剂量依赖性。其中,磷酸化的AMPK蛋白表达水平分别增加3.92倍、4.95倍和6.63倍,SIRT1蛋白表达水平分别增加了0.86倍、1.36倍和1.77倍,PGC-1α蛋白表达水平分别增加3.10倍、3.11倍和4.33倍。由此可得,茶籽皂苷能够改善高脂饮食摄入后引起的能量紊乱,抑制小鼠体内的脂质积累,该作用可能是通过激活AMPK/SIRT1/PGC-1α信号通路实现的。
2.6 茶籽皂苷对高脂饮食小鼠肝脏中PPAR-γ蛋白表达的影响
PPAR-γ作为PPAR家族的关键成员,具有复杂多样的生物学功能。研究表明,PPAR-γ有能够促进游离脂肪酸代谢,调节糖、脂代谢的作用[28]。如图5所示,与正常对照组相比,经高脂饮食诱导的HFD组小鼠肝脏中PPAR-γ的表达水平降低了41.42%(p<0.05)。与HFD组相比,茶籽皂苷干预能显著上调小鼠肝脏组织中PPAR-γ蛋白水平(p<0.05),且蛋白表达程度与给药剂量成正比,分别增加了2.83倍、4.27倍和5.51倍。而激活PPAR-γ能够减少转运至肝脏和肌肉的脂肪酸数量,从而减少脂肪的合成[29]。由此可得,茶籽皂苷可能通过激活PPAR-γ,改善脂质沉积,调控脂质代谢。
2.7 茶籽皂苷对高脂饮食小鼠血清氧化应激水平的影响
长期的高脂饮食会导致血液内游离脂肪酸增加,造成肝脏脂肪过量和脂毒性环境,导致线粒体功能障碍及大量ROS的产生,最终引起机体氧化应激[30]。SOD是体内广泛存在的自由基清除剂,对于缓解体内氧化应激状态起到重要作用;MDA是脂质过氧化反应产生的醛类物质,可以反映机体过氧化程度;GSH是体内良好的抗氧化剂,具有清除和中和体内自由基和过氧化物的作用[31,32]。如图6所示,HFD组小鼠血清中SOD水平显著低于正常对照组小鼠(p<0.05),经茶籽皂苷处理后,小鼠血清中SOD水平分别上升59.28%、57.03%和88.19%,与HFD组差异均有显著性差异(p<0.05)。茶籽皂苷各剂量组小鼠血清中MDA水平较HFD模型组分别降低67.17%、69.42%和81.65%,差异均具有统计学意义(p<0.05)。此外,茶籽皂苷干预能够上调血清中GSH水平,较HFD组分别提高8.28%、26.82%和84.18%。林玲等[11]的研究发现,茶籽皂苷干预能够提升高脂血症大鼠血清中SOD活性并降低MDA水平,从而增强机体的整体抗氧化水平,这与本研究结果较为接近。因此,本实验结果提示茶籽皂苷具有通过清除自由基,增强体内抗氧化酶活力,抑制ROS的产生从而改善氧化应激状态的作用。
3 结论
经4周茶籽皂苷的干预能够有效抑制HFD诱导的小鼠体重增加,并通过降低小鼠脂肪组织的重量来缓解脂质堆积。茶籽皂苷处理同时也能够显著降低小鼠的肝脏指数和Lee's指数,改善肝脏组织脂肪变性的程度。茶籽皂苷干预还能增强小鼠肝脏组织中p-AMPK、SIRT1、PGC-1α、PPAR-γ的蛋白表达,不仅通过促进机体脂肪酸分解代谢以此来改善机体脂质代谢的紊乱,还能增加抗氧化酶的活性。此外,茶籽皂苷干预还能增强血清中SOD和GSH的水平,降低MDA水平,来改善肥胖小鼠体内的氧化应激状态。综上所述,茶籽皂苷对高脂饮食诱导的小鼠肥胖有一定的改善作用,该作用可能与抑制脂质过氧化、调节能量代谢、降低氧化应激反应等机制有关。

