胞外超氧化物歧化酶(EC-SOD)抗辐射作用的研究进展
朱梦梅,欧阳涛,华天桢,李 琨,于 兵
(1.海军军医大学(第二军医大学)基础医学院,上海 200433;2.海军军医大学(第二军医大学)基础医学院细胞生物学教研室,上海 200433)
辐射在我们的生活中无处不在。电离辐射对机体损伤分为直接作用和间接作用,直接作用是指造成DNA双链断裂等损伤,间接作用主要是通过促进活性氧簇(ROS)如羟自由基和超氧阴离子(O2-)的生成对机体造成损伤[1]。机体在受到辐射后,组织器官可持续数天至数月释放ROS,引起DNA链断裂、细胞膜脂氧化、形成有毒的过氧亚硝基离子等,进一步引起细胞凋亡,尤其是生成白细胞和血小板的骨髓造血干细胞以及形成胃肠道黏膜的肠道干细胞,引起免疫系统、凝血功能和胃肠道的损伤和紊乱,造成人体损伤[2]。超氧化物歧化酶(superoxide dismutase, SOD)对辐射的防护作用已在实验中得到部分证实[3-4]。SOD的主要功能是将机体代谢产生的超氧阴离子自由基通过歧化反应转变成对人体无害的过氧化氢和氧气[5]。SOD分为三类:胞质铜锌SOD(Cu/Zn-SOD)、线粒体锰SOD(Mn-SOD)、胞外SOD(EC-SOD)。EC-SOD是唯一能被分泌到细胞外的SOD亚型,主要存在于细胞外基质中。近年来,EC-SOD在医药和农业等多个领域展现出了巨大的应用价值和开发前景。大量研究表明EC-SOD主要通过清除自由基(ROS),防止ROS引起DNA损伤并调节氧化还原敏感基因的表达,在炎症过程中发挥保护作用[6]。而电磁辐射、电离辐射、光辐射等辐射在导致神经系统、呼吸系统、造血系统以及皮肤等组织器官损伤时常伴有ROS的激活和DNA损伤等。因此,本文主要讨论EC-SOD在辐射导致的呼吸系统疾病、造血系统疾病、皮肤病以及肿瘤与放射病等各种病理损伤中的修复作用。
1 SOD的分类、结构和功能
超氧阴离子自由基是生物体内代谢产生的一种活性氧自由基,过量累积的自由基将使细胞膜的脂质过氧化,导致细胞膜结构被破坏、通透性增加,最终使细胞水肿并破裂。SOD是生物体中一种重要的抗氧化剂,能够通过自身的金属活性中心,将氧自由基转换成水、过氧化氢和氧气,减轻自由基对人体的损伤,维持机体内环境稳定和代谢平衡[5]。SOD的存在范围甚广,许多动物、植物和微生物体内都存在SOD。
SOD属于金属酶,根据其催化中心金属离子的不同,大致可以分为以下三类:Cu/Zn-SOD、Fe-SOD和Mn-SOD。其中Cu/Zn-SOD主要存在于动物、植物等真核细胞的细胞质基质中。此外,植物细胞的叶绿体和少量原核生物(如细菌等)的细胞质基质中也存在Cu/Zn-SOD[7]。Mn-SOD主要定位于真核生物和原核生物的线粒体中,Fe-SOD则主要存在于原核生物中,并且在少数种类植物叶绿体中也发现Fe-SOD。已有研究表明,原核生物细胞质基质和植物叶绿体中的Fe-SOD的基因序列具有很高程度的相似性[8]。
在人体等哺乳动物中起作用的主要是上述三类SOD中的Cu/Zn-SOD。Cu/Zn-SOD的相对分子质量为32 000,由2个亚基组成,每个亚基都包含一个铜离子和一个锌离子,Cu在亚基的活性中心起催化作用,是该金属酶最重要的成分之一;而Zn则起到维持亚基空间构象的作用[9]。实际上三种类型的SOD在结构上大致相同,只是亚基的数量和催化中心原子不尽相同。
根据SOD的亚细胞学水平定位,人体内的超氧化物歧化酶可分为以下三类:定位于细胞质中的SOD1、定位于线粒体中的SOD2和定位于细胞外的SOD3。人体内的SOD亚基组成、活性中心金属原子和相对分子质量各不相同,SOD1为二聚体Cu/Zn-SOD,分子量为88 kD;SOD2为四聚体Mn-SOD,分子量为32 kD;SOD3为四聚体Cu/Zn-SOD,分子量约为135 kD[10](图1)。其中,SOD3于1982年被Marklund发现,并命名为胞外SOD (extracellular-SOD, EC-SOD)[11]。
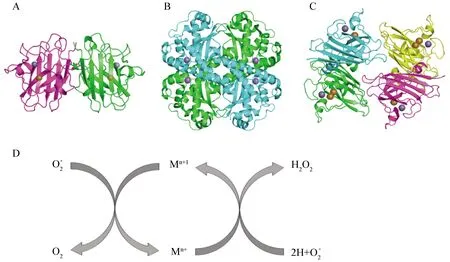
A:人SOD1酶的晶体结构,结合铜离子(橙色球)与锌离子(灰色球);B:人SOD2酶的晶体结构,结合锰离子(紫色球);C:人四聚体SOD3酶的晶体结构,结合铜离子(橙色球)与锌离子(灰色球);D:超氧化物歧化酶所催化的超氧化物的歧化反应可以分为两步,第一步为M(n+1)+ - SOD + O2- → Mn+ - SOD + O2,第二步为Mn+ - SOD +O2- + 2H+ → M(n+1)+ - SOD+ H2O2。其中,M可以表示Cu (n=1);Mn (n=2)。图1 SOD晶体结构与反应机理示意图Fig.1 The crystal structure of SOD and the reaction mechanism diagram
SOD已经在抗衰老、调节机体免疫功能、预防疾病发生发展中有极为广泛的应用[12]。此外,有报道表明,SOD在治疗心肌梗死、新生儿呼吸困难综合征、胶原病、肺气肿、氧中毒等疾病的治疗中有重大潜力,并有望应用在治疗银屑病、皮炎等风湿性疾病和湿疹、瘙痒症等皮肤性疾病中[13]。
2 EC-SOD的结构和功能
EC-SOD主要存在于血浆、淋巴液和滑膜囊液、浆膜腔液等细胞外液中,负责清除细胞外液中游离的氧自由基,以减少机体的氧化损伤。EC-SOD分子量约为135 kD,是由2个双亚基通过半胱氨酸的二硫键连接形成的4亚基结构[14]。
EC-SOD由三个结构域组成:包含Asn89糖基化位点的氨基末端残基1~95的酶溶解协助结构域,与SOD1高度同源的包含氨基酸残基96~193的活性结构域,包含氨基酸残基194~222的EC-SOD特异性的羟基末端正电荷结构域[15]。
Edward D Levin等人发现EC-SOD能够降低外周血中的游离氧自由基,从而减少其对神经系统的损伤,并进一步缓解年龄相关的认知功能下降,预示着EC-SOD在延缓认知功能下降方面的巨大应用前景[16]。EC-SOD在鼻息肉、肺癌、前列腺癌等肿瘤的调控通路中的作用也逐步得到阐明。研究结果提示EC-SOD基因突变与上述肿瘤的发病率增加有关,同时EC-SOD也能对上述肿瘤的发生发展起到一定的负向调控作用[17]。近年来,EC-SOD的抗辐射作用得到逐步重视,并且已有大量相关文献报道。Radoslaw Rola 团队发现,EC-SOD对于辐射条件下神经系统的正常发育有重要影响,EC-SOD能够更有效的降低辐射条件下氧自由基对于神经发生的不良影响[18]。Zou Yani等人进一步发现EC-SOD在神经系统中抗辐射功能主要定位于海马区[19]。此外,也有研究表明EC-SOD在辐射损伤后肺功能的重建和恢复中起到重要作用,足量的EC-SOD能在一定程度上预防辐射后的急性肺损伤[20]。
EC-SOD的抗氧化损伤作用及其在肿瘤信号通路的调控作用预示着其良好的临床应用潜能,同时,EC-SOD的抗辐射功能也进一步提示其在预防核辐射、医疗辐射、工业辐射方面的巨大应用潜力。
3 EC-SOD在抗辐射损伤中的作用
3.1 EC-SOD在神经系统辐射损伤中的作用
EC-SOD与电离辐射条件下神经系统海马区的功能改变和神经发生有着密切关系。海马区是大脑边缘系统的一部分,位于大脑皮质下方,发挥着短期记忆、长期记忆以及空间定位的作用。海马神经发生在齿状回和海马回路的功能维持中起作用,该过程对氧化还原平衡的变化非常敏感[21]。
放射治疗是治疗脑部肿瘤的一种有效方式,但通常会导致海马相关的学习和记忆功能缺陷,这很可能是由于照射过程中氧自由基的持续升高导致海马神经的发生受到抑制。EC-SOD转基因小鼠模型和EC-SOD基因敲除小鼠模型是研究EC-SOD在神经发生和其抗辐射作用的最为理想的动物模型。Zou等人在EC-SOD基因敲除小鼠模型中发现,在辐射条件下EC-SOD的缺乏不利于海马齿状回的祖细胞增殖和新生神经元的长期存活,而颗粒细胞中高水平的EC-SOD支持树突状细胞发育和新生神经元的长期存活。并且,与野生型小鼠和EC-SOD转基因小鼠相比,EC-SOD基因敲除小鼠新生神经元的数量仍然很少[19]。这些研究结果提示EC-SOD水平的改变和颅骨辐射会影响海马神经发生,但是,以前的研究仅在雄性小鼠中进行,尚不清楚雌雄之间是否存在差异。因此,Zou等人对雌性小鼠进行了研究,并将结果与早期雄性小鼠的研究结果进行比较。结果表明,就海马神经发生而言,在同一年龄的不同性别研究组中,EC-SOD缺乏和辐射的总体效果相同[22]。综上所述,EC-SOD在辐照条件下对海马神经发生的各个阶段及其相关的认知功能中都发挥着重要作用。
3.2 EC-SOD在呼吸系统辐射损伤中的作用
放射治疗是最广泛使用的癌症治疗方法之一,尽管放疗技术日益精进,其带来的不良反应仍不可避免。肺对放疗的毒性反应敏感,是放射治疗最主要的剂量限制器官[23]。放射性肺损伤(radiation induced lung injury, RILI)是胸部放疗后发生的严重并发症,包括急性放射性肺炎和慢性放射性肺纤维化,主要表现为气短、低热、咳嗽等,严重影响患者的生活质量。目前研究表明RILI的发生机制主要包括靶细胞学说、细胞因子学说、自由基学说、血管内皮细胞损伤学说[24-25]等。RILI的始动因素一方面来自于电离辐射能量直接作用于DNA,另一方面来自水分子受激发和电离后产生大量ROS间接作用导致蛋白质、核酸等生物大分子的氧化损伤,从而导致细胞损伤或死亡。ROS的损伤作用贯穿整个RILI病程,不仅作用于照射早期,还可持续至纤维化形成阶段;不但引起辐照部位损伤,还可引起非辐照部位损伤[26]。
随着对RILI分子机制和病理机制的逐步阐明,抗氧化治疗显得日益重要。EC-SOD是肺中一种重要的抗氧化剂,其基因序列变异、表达异常或丢失均能导致肺部疾病的发生。Rabbani等人在EC-SOD过表达的转基因型(XRT-TG)和野生型(XRT-WT)动物中进行完整胸腔辐射(单剂量,15 Gy),通过评估呼吸频率、右肺重量、总/差异白细胞计数以及活化的TGF-β1及其信号转导途径的关键蛋白(Smad 3和p-Smad 2/3)的表达变化,以确定肺损伤程度。这项研究表明,EC-SOD的过表达对于放射诱发的急性肺损伤具有保护作用,可能的途径在于减弱巨噬细胞反应、抑制TGF-β1的激活,并下调促纤维化TGF-β信号通路的活性[27]。Huang等人的研究进一步明确了辐射诱发的肺损伤与长时间的氧化应激有关。转基因小鼠肺中EC-SOD的过表达能够相应减弱氧化应激,防止辐射诱发的肺损伤,这提示EC-SOD可能是潜在的放射防护剂[20]。
3.3 EC-SOD在造血系统辐射损伤中的作用
急性放射综合症(ARS)会导致出血过多和多器官衰竭。造血干细胞的移植为放射诱发的造血功能低下提供了治疗选择,但是这种治疗方法受到多方面的限制,如供体可用性低、免疫调节能力下降、细胞存活时间短等[28]。众多研究表明,具有多向分化潜能、造血调控和免疫调节等作用的间充质干细胞(mesenchymal stem cells, MSCs)移植已成为急性辐射损伤治疗的新方法之一[29]。MSCs的抗氧化活性可能与MSCs表达EC-SOD有关。除了超氧化物清除特性外,EC-SOD还以酶促和非酶促方式表现出抗血管生成、抗趋化和抗炎的功能[30]。营养限制会降低MSCs的移植存活率,EC-SOD的过表达减弱了饥饿诱导的MSCs凋亡,并增加了MSCs的自噬作用。具体来说,EC-SOD通过激活细胞外信号调节激酶,调节AMP激活的蛋白激酶/ sirtulin 1,保护MSCs免受血清缺乏的营养限制,并促进叉头转录因子(Forkhead Box O3A, FOXO3)转运到细胞核,从而促进MSCs的存活[31]。
Gan等人使用EC-SOD修饰的脐带间充质基质细胞(UCMSCs)治疗ARS,结果表明静脉输注EC-SOD-UCMSCs能够保护小鼠免受亚致死剂量的辐射,并通过促进多谱系造血功能恢复来提高存活率[32]。Hu等人对MSCs在造血恢复中减少辐照小鼠骨髓细胞凋亡效应的作用和机制进行研究,确定了全身辐照小鼠进行MSCs治疗的安全有效剂量(TBI)[33]。综上,EC-SOD促进了MSCs的存活,EC-SOD和MSCs结合具有治疗ARS的临床潜力,有可能成为对抗辐射诱发的造血功能衰竭的有效治疗方法。
3.4 EC-SOD在皮肤辐射损伤中的作用
近几十年来,空气污染加剧和气候变化导致紫外线(UV)透射率增加。紫外线辐射对人类正常的皮肤造成的伤害主要是晒黑、晒伤症状的红斑、局部或全身的免疫抑制[34]。紫外线通过损害细胞外基质并诱导细胞死亡,在皮肤中引起氧化应激,导致皮肤稳态下降,是皮肤癌和许多其他皮肤炎性疾病的致病因素。在非黑色素瘤和黑色素瘤皮肤癌的发生中,紫外线也作为致癌物起作用,从而导致皮肤细胞增殖失控[35]。
EC-SOD凭借其强大的抗氧化功能,作为抗黑色素生成因子,在一些皮肤病的治疗中发挥效用。Kim Hae-Young 等人利用EC-SOD转基因模型小鼠在UVB暴露条件下,评估EC-SOD的抗黑色素生成作用。黑色素含量及酪氨酸酶活性测定的测量结果表明EC-SOD可通过抑制黑色素细胞增殖和ROS产生来抑制黑色素生成。EC-SOD主要通过抑制黑皮质素1受体(MC1R)、干细胞因子(SCF)、内皮素1(ET-1)和Wnt7a等黑色素合成的关键介质防止色素的沉着。此外,EC-SOD也能通过抑制转化生长因子-β1(TGF-β1)使其ET-1信号通路失活,从而发挥抑制黑色素生成的作用[36]。另外,Nguyen等人以EC-SOD作为治疗性蛋白在炎症性疾病(如皮肤,自身免疫性疾病)中的研究为基础,进一步讨论其在调节疾病发病中的免疫应答和信号启动机制[37]。在慢性炎症性皮肤病(如牛皮癣)中,EC-SOD的过表达降低了缺氧诱导的角质形成细胞的生成,减轻了接受UVB照射的EC-SOD转基因小鼠的表皮水肿、血管形成和炎症细胞浸润。总的来说,EC-SOD的抗血管生成和抗炎作用可能是由于其抑制了HIF-1α和NF-κB的表达[38]。同样作为抗氧化剂,EC-SOD可能具有与Mn-SOD和Cu/Zn-SOD不同的防御作用,以抵抗光辐射对皮肤的伤害[39]。
放射性皮炎是放射治疗恶性肿瘤的常见并发症,主要表现为红斑、脱屑和溃疡等,严重影响患者的生活质量。放射性皮炎发病机制未完全阐明,目前认为主要与放射线直接或间接诱导细胞DNA损伤,引起细胞凋亡、坏死相关[40]。已有许多药物和敷料可用于预防和治疗放射性皮肤损伤,如皮质类固醇、黄嘌呤衍生物、透明质酸、三乙醇胺、硫糖铝乳膏等[41]。此外,已有研究探究单独使用SOD或SOD联合其他药物在放射性皮炎中的预防与治疗作用。Doctrow等人建立皮肤照射损伤大鼠模型,并在照射后 48 小时开始全身给予SOD/过氧化氢酶模拟物,即EUK-207。结果表明,在给药后能够降低组织氧化应激指标,减轻放射性皮炎损伤程度,并促进伤口愈合[42]。Manzanas García等人对57 名伴发急性放射性皮炎的肿瘤患者局部应用 SOD药膏,每日两次涂用,每周使用40 mg,并持续随访 12 周。在12周的疗程结束时,57名患者的放射性皮炎均被治愈[43]。目前尚无相关研究表明EC-SOD对放射性皮炎具有防护作用。
3.5 EC-SOD在肿瘤及放射治疗中的作用
恶性肿瘤是严重威胁人类健康的常见病和多发病。目前恶性肿瘤的治疗方式包括手术、放射疗法、化学疗法、免疫疗法和激素疗法等。其中放射疗法是癌症治疗的重要组成部分,大约50%的癌症患者在病程中接受放射治疗[44]。与大多数抗癌疗法相似,放射疗法通过诱导不同类型的细胞死亡来达到其治疗效果。除了有效的肿瘤控制作用外,放射治疗也会对正常细胞或组织造成损害,甚至引起二次/继发癌症发展[45-46]。辐射诱导的氧化损伤和DNA损伤所产生的急性促炎细胞因子可提高肿瘤的异质性和可塑性。总之,辐照不仅是肿瘤的有效治疗方法,同时,辐照也可造成组织损伤、增加肿瘤的异质性和可塑性,进而导致肿瘤的进一步恶变与复发。
目前,与细胞内的两种SOD相比,人们对EC-SOD在肿瘤发生、发展过程中的作用了解得较少。几项研究的普遍共识是,EC-SOD的水平降低,具有促肿瘤发生与发展的作用,将EC-SOD的表达降低到生理水平可以在体外和体内增加恶性细胞的生长[47]。而EC-SOD的过表达可能通过调节肿瘤微环境(TME)影响肿瘤发生。已有研究显示EC-SOD的过表达抑制了人胰腺癌细胞中缺氧诱导因子1α(HIF-1α)的积累,进而抑制肿瘤的转移[48]。越来越多的研究表明EC-SOD能在一定程度上降低细胞癌变概率。在由肿瘤放射治疗引起某些细胞和全身性炎症事件中,EC-SOD能够转移至损伤组织,使损伤组织内的细胞增殖增加、凋亡减少以及炎症细胞浸润减少,从而促进其愈合[49]。EC-SOD可通过降低ROS水平,维持氧化还原稳态,并与肿瘤相关靶标基因相互作用等方式抑制癌细胞的增殖与迁移,因此,EC-SOD有希望成为肿瘤辐照过程中发挥抗辐射与抑癌双重作用的新型肿瘤治疗药物[6,48,50]。
4 EC-SOD在抗辐射损伤中的应用
我们总结了EC-SOD在不同疾病状况下的辐射防护作用机制(表1),并进一步探讨其在辐射防护中的应用。多数研究者通过过表达EC-SOD的方式探究其在辐射损伤中的防护作用[20,27,48]。此外,SOD模拟物或类似物,如GC4419、 MnTnBuOE-2-PyP(MnBuOE 或 BMX-001)或SOD联合过氧化氢酶模拟物 (EUK-134) 在减少放疗和化疗引起组织损伤方面的功效也受到关注[51-53]。近年来,间充质干细胞在组织损伤修复和再生方面取得了很多研究进展[54]。它们具有一定的抗辐射特性,即使在高剂量的电离辐射中仍能保持其干细胞特性。MSCs的再生能力和抗辐射特性使得它们被考虑用于治疗由电离辐射引起的组织损伤。已有研究表明,单独使用MSCs 可通过旁分泌作用改善小鼠的放射性肺纤维化,而给予 EC-SOD修饰的MSCs具有更加显著的改善效果,表明EC-SOD修饰的MSCs是一种潜在疗法[55]。许多分子能够调节EC-SOD的表达,10-羟基-2-癸烯酸(10H2DA, 2)通过组蛋白乙酰化作用增加单核细胞中EC-SOD的表达[56],环磷酸腺苷 (cAMP)类似物和腺苷酸环化酶调节剂同样刺激 EC-SOD 表达[57],而这些物质能否通过促进EC-SOD的表达或其他机制发挥辐射损伤的防护作用仍需进一步研究明确。

表1 EC-SOD在不同疾病状况下的辐射防护作用机制Tab.1 The mechanism of EC-SOD in anti-radiation protection from different diseases
5 结语
电磁辐射、电离辐射、光辐射等辐射所致的相关性疾病在生活中越来越常见,如肿瘤放射治疗过程中常会引起急慢性的放射性肺损伤、放射性皮炎等。辐射所致的相关性疾病的发生与发展过程中常伴有ROS的激活和DNA损伤等现象。目前,众多研究表明具有抗氧化功能的EC-SOD及其模拟物或类似物在多种组织器官的辐射损伤中有着抗辐射的保护作用,但它们在抗辐射损伤中的作用机制仍不是十分明确,还有待进一步研究阐明,尤其重要的是EC-SOD在治疗辐射损伤过程中的给予方式需要进一步明确,进而确定最佳的应用方式。随着EC-SOD及其模拟物或类似物在抗辐射损伤中应用的研究深入,它们有望成为辐射损伤引起的相关性疾病的治疗手段之一。

