锁阳多糖的提取及纯化工艺
吕 鑫,顾志荣,祁 梅,张 锐,郭 燕,毛小文,葛 斌*
(1.甘肃中医药大学药学院,甘肃 兰州 730000;2.甘肃省人民医院药剂科,甘肃 兰州 730000)
锁阳是锁阳科多年生肉质寄生草本植物锁阳(Cynomorium songaricumRupr.)的干燥肉质茎,主要分布于甘肃、内蒙古、新疆、青海等地区的沙漠和半沙漠[1]。其性甘、温,归肝、肾、大肠经,功能补肾阳,益精血,润肠通便,传统医学则用以治疗早泄、阳痿、性欲低下、遗精绞痛及胃溃疡等[2-3]。锁阳中含有黄酮类、多糖类、三萜类、儿茶素类鞣质、有机酸、多种氨基酸及微量元素等多种化学成分[4-5]。其药效成分锁阳多糖(Cynomorium songari‑cum polysaccharide,CSP)具有抗衰老、抗氧化、免疫调节等生物活性[6]。现代研究表明,CSP能显著改善衰老模型小鼠的学习记忆、记忆保持能力及认知功能,增加清除自由基能力,降低脑组织脂质过氧化损伤程度,保护海马区神经元,改善学习记忆[7-8]。随着CSP在临床的参与度增加,为了提高药物的利用率,优化提取工艺和纯化工艺,本研究主要针对CSP提取工艺、脱蛋白方法及脱色工艺,采用单因素实验和正交实验相结合的方法对CSP的提取工艺进行优选;比较Sevage法、三氯乙酸(Trichloroacetic acid,TCA)法、木瓜蛋白酶法及醋酸铅法对CSP蛋白脱除的效果,选择最佳方法;采用单因素试验和响应面试验相结合的方法对CSP脱色工艺进行分析与优化。本研究旨在优选出较高的提取率、最佳的脱蛋白方法与较好的脱色率,为CSP的提取纯化工艺研究提供稳定可靠的理论依据,为CSP的工业化加工生产提供指导,为CSP生物活性研究奠定理论基础。
1 仪器与试药
UV8100A型紫外-可见分光光度计(北京莱伯泰科仪器有限公司),HY-4调速多用振荡器(常州普天仪器制造公司),小型高速粉碎机,AL204型万分之一电子天平(瑞士梅特勒-托利多公司),SB25-12DTD型超声波清洗机(宁波新芝生物科技股份有限公司),HH-6型数显恒温水浴锅(西安超杰仪器有限公司),DZF-6090型真空干燥箱(上海一恒科学仪器有限公司),DD-5M型低速大容量离心机(湘仪离心机仪器有限公司),EV351旋转蒸发仪(北京莱伯泰科仪器有限公司),透析袋MD44,AB-8、HPD826、HPD100、D-101型大孔吸附树脂(武汉市伟琪博星生物科技有限公司)。
锁阳于2021年3月采集自内蒙,经甘肃中医药大学中药鉴定教研室李硕副教授鉴定为锁阳的干燥肉质茎。采集的新鲜药材晾至完全干透,粉碎后过二号筛,60℃烘干,置干燥器中备用。葡萄糖(B21882-100 mg),购自上海源叶生物科技有限公司。石油醚(30~60)、无水乙醇、苯酚、丙酮、浓硫酸、氢氧化钠、盐酸、考马斯亮蓝G-250、牛血清白蛋白、三氯乙酸、木瓜蛋白酶等均为分析纯。水为纯化水。
2 方法与结果
2.1 标准曲线的制作[9]
精密称取充分干燥至恒重的10 mg葡萄糖对照品,加50 mL纯化水溶解,然后精密吸取1,2,3,4,6,7,8,9 mL置于25 mL量瓶中。分别从各容量瓶中吸取2 mL于25 mL具塞试管中,加入5%的苯酚溶液1 mL,摇匀后迅速加入5 mL浓硫酸显色,振荡,沸水浴15 min,取出冰水浴终止反应。以空白为参比,紫外分光光度计在490 nm处测得吸光度,以葡萄糖质量浓度X为横坐标,吸光度Y为纵坐标,绘制标准曲线Y=13.382X+0.011 5,R2=0.999 4,由方程可知当葡萄糖质量浓度在0.008~0.072 mg·mL-1时,直线线性关系良好。
2.2 提取工艺操作过程
精密称取锁阳药材粉末置于圆底烧瓶中,分别以料液比、提取时间、提取温度、提取次数4个因素为对象进行提取,合并提取液后煮沸加热30 min,冷冻静置24 h,滤过,取上清液浓缩至一定体积后,经4 000 r·min-1离心10 min,取上层清液加入5倍体积的无水乙醇,4℃静置12 h后离心,将所得沉淀用无水乙醇、丙酮、石油醚依次洗涤,每次至滤液几乎澄清,所得沉淀即为锁阳粗多糖。
2.2.1 单因素试验设计
2.2.1.1 提取时间对CSP得率的影响
在提取温度80℃、料液比(g∶mL)1∶20,提取次数1次的条件下,分别设定提取时间为60,90,120,150和180 min,探讨提取时间对CSP提取率的影响。结果如图1所示,多糖得率随提取时间的增加而增加,在150 min达到最大值,再增加提取时间,多糖得率反而出现了下降的趋势。可能是CSP随提取时间的延长而不断溶出的同时,长时间的高温加热也会导致CSP结构的破坏和分解,且也可能存在因CSP分子内部沸腾引起扩散通道堵塞的情况,使其难以溶出导致得率降低[10]。因此,最佳提取时间为150 min。

图1 提取时间对多糖得率的影响Fig.1 Effect of extraction time on the extraction yield of poly‑saccharide
2.2.1.2 料液比对CSP得率的影响
在提取温度80℃,提取时间150 min,提取次数1次的条件下,分别设定料液比(g∶mL)为1∶10,1∶20,1∶30,1∶40,1∶50,探讨料液比对CSP得率的影响。结果如图2所示,不同料液比对CSP得率影响较大,随着加水倍量的增加,CSP得率逐渐增大,在料液比为1∶30时达最大值,随后再增加加水倍量,多糖得率有所下降。可能是随着加水倍量的增加使细胞内外渗透压迅速改变,使其他物质溶出速度提高,影响到CSP的溶出,并且液料比过大,不仅延长了浓缩时间,浪费能源,而且会加大多糖的损失[11-12]。因此,最佳料液比为1∶30。
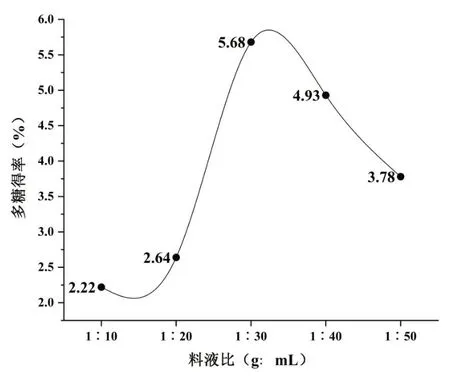
图2 料液比对多糖得率的影响Fig.2 Effect of ratio of material and liquid on the extraction rate of polysaccharide
2.2.1.3 提取温度对CSP得率的影响
在料液比(g∶mL)1∶30,提取时间为150 min,提取次数1次的条件下,分别设定提取温度为60,70,80,90和100℃,探讨提取温度对CSP得率的影响。结果如图3所示,提取温度为60~90℃之间,随着提取温度的上升,CSP得率呈现先快速增加,后缓慢增加,再快速增加的趋势。在90℃达到最大值,而将提取温度升至100℃时,多糖得率呈现下降趋势,可能是长时间的高温使CSP结构遭到一定程度的破坏或使CSP出现降解[13]。因此,最佳提取温度为90℃。
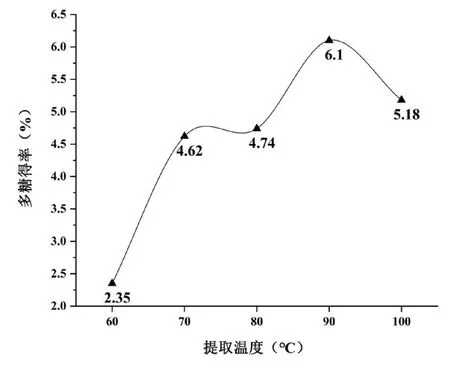
图3 提取温度对多糖得率的影响Fig.3 Effect of extraction temperature on the extraction yield of polysaccharide
2.2.1.4 提取次数对CSP得率的影响
在提取温度为90℃,料液比(g∶mL)1∶30,提取时间为150 min的条件下,分别设定提取次数为1,2,3,4和5,探讨提取次数对CSP得率的影响。结果如图4所示,当提取次数为3次时,CSP得率迅速增加,为7.91%,随后随着提取次数的增加,多糖得率增加缓慢,为节省提取时间减少能源损耗,提取次数为3次较为合适。

图4 提取次数对多糖得率的影响Fig.4 Effect of extraction times on the extraction yield of poly‑saccharide
2.2.2 正交试验设计与分析
根据单因素及预试验结果选定水提时影响CSP提取率的提取时间(A)、料液比(B)、提取温度(C)和提取次数(D)作为考察因素,以得率为考察指标,选用L9(34)正交表进行试验。因素水平选取见表1,试验设计及结果见表2,方差分析见表3。

表1 因素水平表Tab.1 Factors and levels

表3 方差分析Tab.3 Analysis of variance
由表2~3可知,各因素对CSP提取率的影响大小依次为C>B>A>D,最优组合为A1B3C3D2,即确定CSP的最佳提取工艺为:将锁阳药材干燥至恒重,粉碎后,在提取时间为120 min,料液比为1∶40,提取温度为100℃的情况下提取3次。将工艺放大50倍,在最佳条件下进行3次平行实验,多糖提取率分别为8.27%、8.18%、8.02%,平均提取率为8.16%。
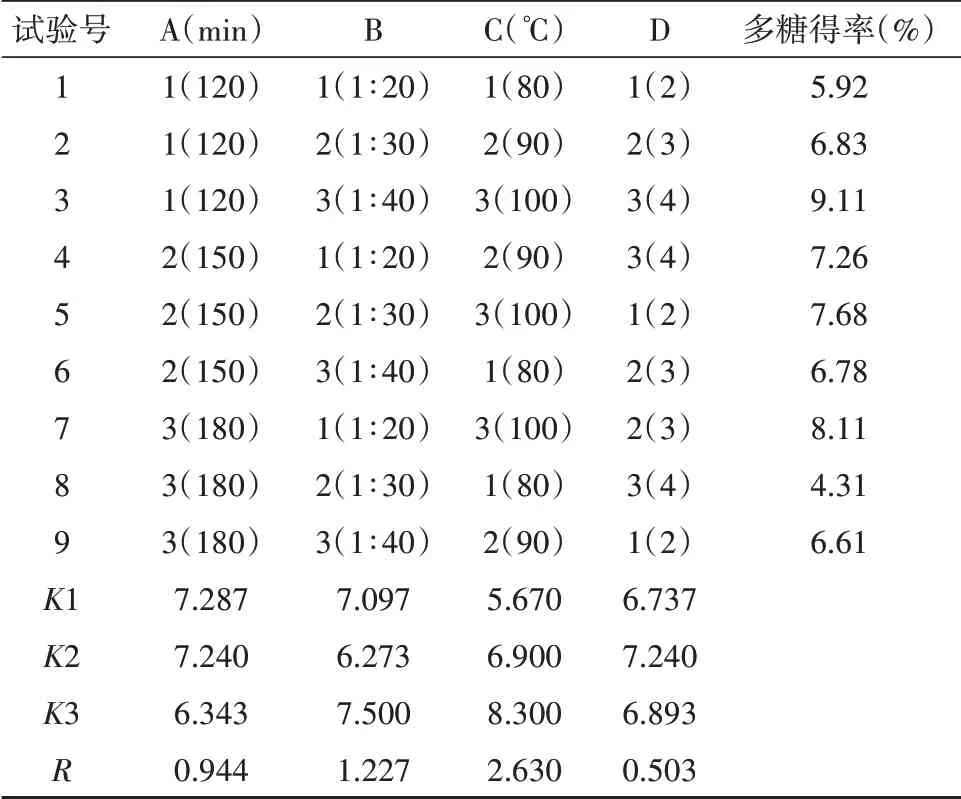
表2 正交试验设计及结果Tab.2 Design and results of orthogonal test
2.3 脱蛋白工艺
2.3.1 蛋白质的含量测定[14]
称取考马斯亮蓝G-250 10 mg溶于5 mL的95%乙醇中,加入85%磷酸10 mL,加水稀释至100 mL,置于棕色量瓶中,得考马斯亮蓝溶液。精密称取牛血清白蛋白10 mg,用少量水溶解并定容至100 mL,得0.1 g·L-1蛋白质标准溶液,置4℃冰箱中保存。精密量取蛋白标准溶液0.2,0.4,0.8,1.2,1.6,2.0,2.5,3.0 mL,分别置于10 mL量瓶中,各加入考马斯亮蓝溶液5.0 mL,加水定容,摇匀,室温反应10 min。以水为空白。在595 nm处测定A,以A为纵坐标,质量浓度C为横坐标,得回归方程A=25.714C+0.022 2(R2=0.995 2),线性范围0.002~0.03 mg·mL-1。
2.3.2 脱蛋白方法比较
来源于不同中药的多糖,由于其理化性质的差异,脱蛋白工艺也不尽相同。如龙葵果[15]、骏枣多糖[16]用三氯乙酸法蛋白脱除效果最佳,肉苁蓉[9]、马齿苋[17]多糖用木瓜蛋白酶法蛋白脱除效果最佳。通过比较Sevage法、三氯乙酸(TCA)法、木瓜蛋白酶法、醋酸铅法等脱蛋白方法,采用综合评分的方法,优选适合于CSP的脱蛋白工艺。公式如下:

2.3.2.1 Sevage法 量取CSP含量为5 mg·mL-1的多糖溶液,加入1/4倍量Sevage试剂[三氯甲烷-正丁醇(4∶1)(V/V)],置于振荡器上剧烈振摇20 min,4 000 r·min-1离心10 min,去除下层有机相及中间层蛋白质与Sevage试剂生成的乳胶物沉淀,收集上清液,重复操作7次。结果如图5所示,随着重复次数的增加,蛋白脱除率也随之增大,但多糖的损失率也逐渐升高,可能是在去除游离蛋白的同时少数CSP也随Sevage试剂沉淀了[18]。从综合评分可以看出,Sevage法脱蛋白次数为1次时,蛋白脱除率为80.67%,多糖保留率为91.61%。

图5 Sevag法脱蛋白结果Fig.5 Results of Sevag method
2.3.2.2 TCA法脱蛋白[19]
量取CSP含量为5 mg·mL-1的多糖溶液10 mL置于离心管中,分别加入不同梯度20%的TCA(0.5,1.0,1.5,2.0,2.5,3.0 mL),置于振荡器上振摇20 min后静置过夜,4 000 r·min-1离心10 min,取上清测定吸光度并计算蛋白质及多糖含量。结果如图6所示,随着TCA用量的增加,蛋白脱除率逐渐增加,当TCA用量达到1.5 mL时,蛋白脱除率基本趋于平衡。对多糖保留率而言,随着TCA用量的增加,呈显著下降趋势。这是因为TCA与蛋白质结合沉淀时会吸附一定量的CSP,导致CSP含量下降[16]。综合两者结果得出,三氯乙酸用量为0.5 mL时,蛋白质脱除率为81.43%,多糖保留率为87.97%,综合评分为84.70,此时脱蛋白效果最佳。

图6 三氯乙酸法脱蛋白结果Fig.6 Results of removing protein of three chlo-roacetic acid method
2.3.2.3 醋酸铅法脱蛋白[20]
量取CSP含量为5 mg·mL-1的锁阳粗多糖溶液20 mL,加入不同体积(0.1,0.2,0.3,0.4,0.5,0.6 mL)5%醋酸铅溶液,室温静置1 h后4 000 r·min-1离心10 min,取上清液测定蛋白质含量和多糖含量。结果如图7所示,随着醋酸铅添加量的增加,蛋白脱除率呈缓慢上升,而多糖保留率显著下降。根据综合评分,发现醋酸铅添加量在0.1 mL时CSP脱蛋白效果相对最好,蛋白脱除率为85.34%,多糖保留率为90.51%。
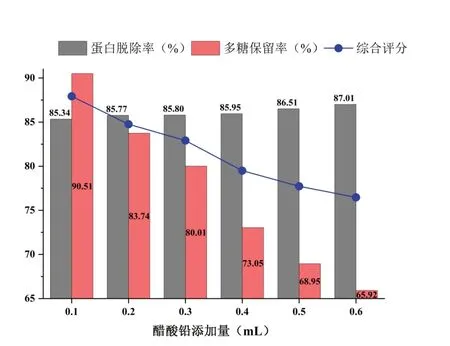
图7 醋酸铅脱蛋白结果Fig.7 Deproteinization effect of lead acetate addition method
2.3.2.4 木瓜蛋白酶法脱蛋白[21]
量取CSP含量为5 mg·mL-1的锁阳粗多糖溶液10 mL置于具塞试管中,加入不同浓度的木瓜蛋白酶,在pH为7的条件下,先于37℃水浴中预热10 min,然后在60℃的水浴条件下酶解3 h,最后沸水浴中灭活10 min,4 000 r·min-1离心10 min,取上清液测定蛋白质含量和多糖含量。结果如图8所示,随着酶浓度的增加,对蛋白脱除率无明显影响,但对CSP的损耗逐渐增大。
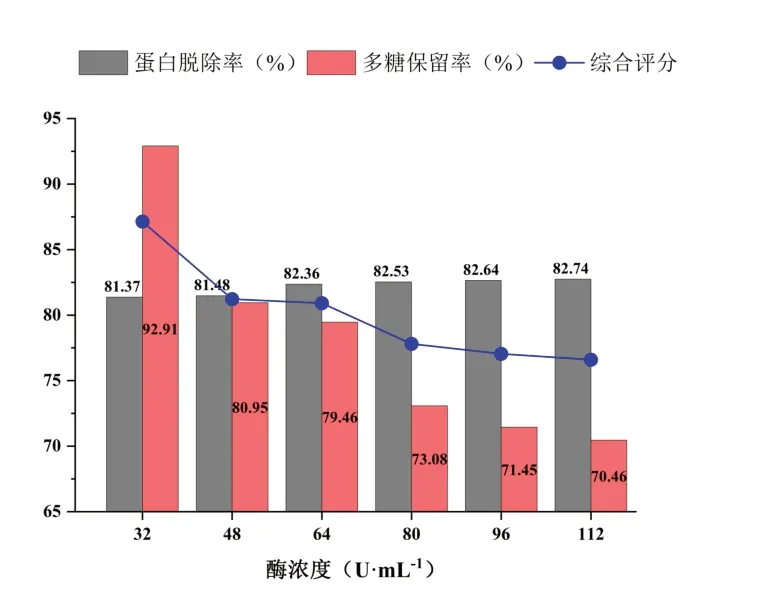
图8 木瓜蛋白酶脱蛋白结果Fig.8 Deproteinizing effect of papain
2.3.3 四种脱蛋白方法的比较
由表4所示,醋酸铅法脱蛋白,蛋白脱除率为85.34%,多糖保留率为90.51%,综合评分为87.93,优于其他三种方式。
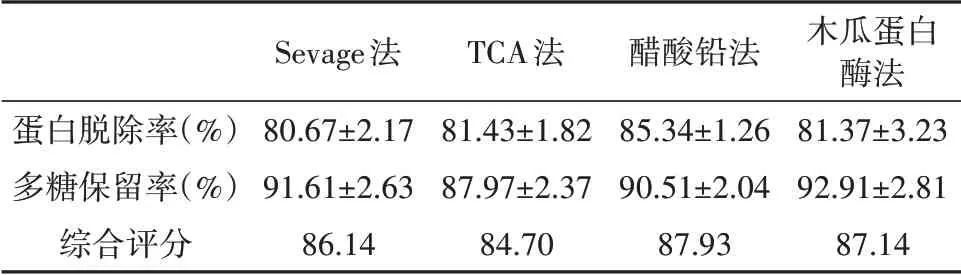
表4 四种脱蛋白方法的比较(n=3)Tab.4 Comparison of performance of four deprmteinization methods(n=3)
2.4 脱色工艺
2.4.1 大孔吸附树脂筛选
经醋酸铅对CSP脱蛋白后,CSP溶液中仍有大量色素共存,这不仅影响CSP的纯度,而且也会为CSP含量的测定带来干扰。因此,色素的脱除也是多糖纯化中必不可少的过程。而不同型号的树脂,包括其结构、极性、平均孔径、比表面积等参数的不同,对色素和多糖的吸附也各有差异。因此,本研究精密称取经预处理的AB-8、HPD826、HPD100、D-101型大孔吸附树脂各1 g,置于100 mL具塞三角瓶中,取20 mL脱蛋白后的CSP溶液加入锥形瓶中,置于振荡器上匀速振荡120 min,4 000 r·min-1离心10 min,收集上清液,测定脱色率和多糖保留率,并采用综合评分的方式,优选最佳树脂。由表5所示,HPD100对CSP溶液的脱色率和多糖保留率均最好,分别为73.16%和90.76%。其中,本研究所选4种树脂均具有较大的比表面积,因此4种树脂间脱色率差异不大;HPD100型大孔树脂平均孔径最小,CSP损耗最小;D101树脂平均孔径最大,CSP损耗高达55.21%。由此可见,大孔树脂的平均孔径可能会影响多糖保留率。

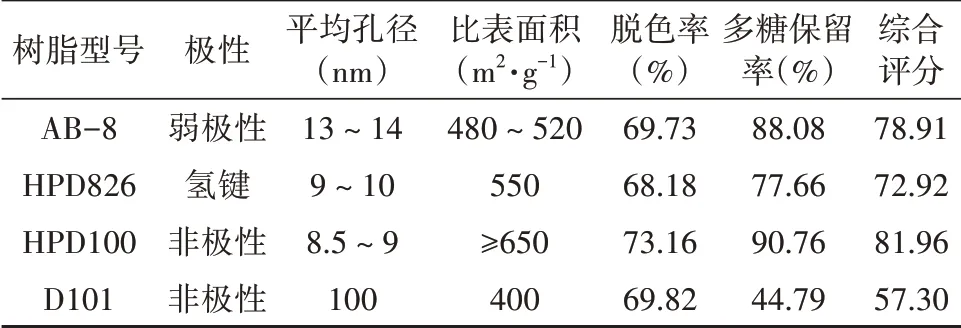
表5 4种大孔吸附树脂脱色效果Tab.5 Effect of decoloration of 4 types of macroporous adsorp‑tion resin

2.4.2 静态吸附动力学研究
精密称取HPD100型大孔吸附树脂5 g置于100mL具塞三角瓶中,加入100 mL脱蛋白CSP溶液,在室温下置于振荡器上匀速振荡,每隔30 min取样一次,测定多糖保留率和脱色率,绘制吸附动力学曲线。结果如图9所示,在前150 min以内,随着脱色时间的延长HPD100型大孔吸附树脂脱色率明显增加,累计脱色率为72.95%,而之后脱色率增加缓慢,累计增加5.62%。因此,选择150min作为最优脱色时间。
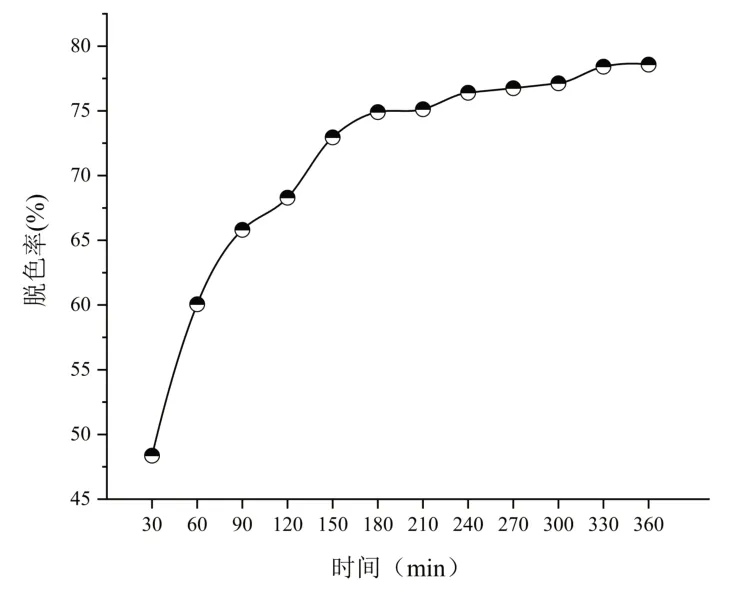
图9 树脂静态吸附动力学曲线Fig.9 Dynamic decolorization on curves of HPD100 macropo‑rousresin
2.4.3 静态吸附单因素参数优化
2.4.3.1 CSP含量对多糖保留率和脱色率的影响
在脱色pH为7、脱色时间150 min,树脂用量(质量与体积比mg·mL-1)为5%的条件下,设定CSP含量分别为2,6,8,10,12 mg·mL-1。结果如图10所示,随着糖液浓度的增加,多糖保留率和脱色率都呈下降趋势,但多糖保留率下降的趋势较为平缓。其中,糖液浓度在2~6 mg·mL-1间时多糖保留率与脱色率均无明显变化。因此,选择6 mg·mL-1为CSP含量的中心点进行后续优化。
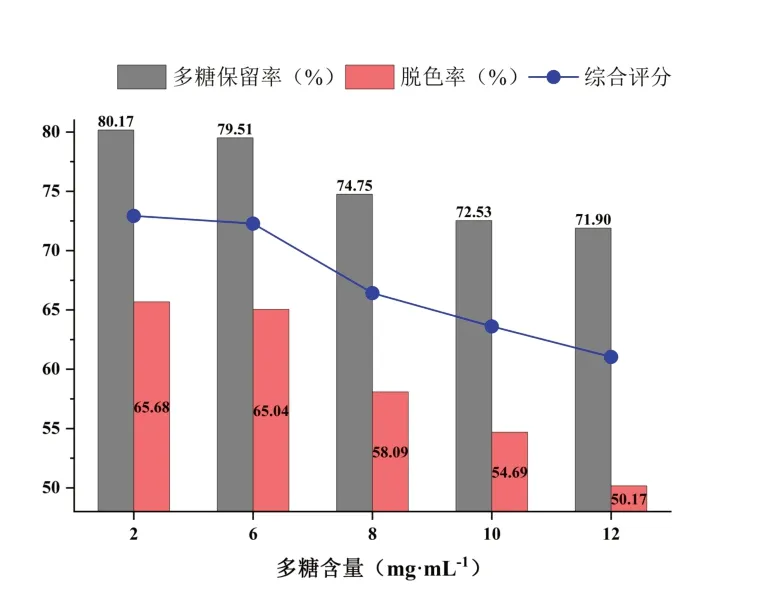
图10 多糖含量对脱色效果的影响Fig.10 Effect of polysaccharide content on decolorization
2.4.3.2 树脂用量对多糖保留率和脱色率的影响
在脱色pH为7、脱色时间150 min,CSP含量为6 mg·mL-1的条件下,设定树脂用量分别为5%,10%,15%,20%,25%。结果如图11所示,随着树脂用量的增加,脱色率逐渐升高,多糖保留率逐渐降低。根据综合评分,当树脂用量为10%时,脱色率为83.21%,多糖保留率为80.85%。因此,选择10%作为树脂用量的中心点进行后续优化。
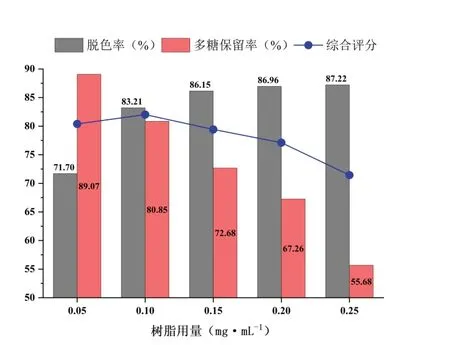
图11 树脂用量对脱色效果的影响Fig.11 Effect of resin addition on decolorization
2.4.3.3 糖液pH对多糖保留率和脱色率的影响
在脱色时间150 min,CSP含量为6 mg·mL-1,树脂用量为10%的条件下,设定pH分别为4.0,4.5,5.0,5.5,6.0,6.5,7.0。结果如图12所示,随着pH的增加,脱色率逐渐减低,多糖保留率先升高再降低,在pH为5.5时,脱色率为85.46%,多糖保留率为83.16%。因此,选择5.5为pH的中心点进行后续优化。

图12 糖液pH对脱色效果的影响Fig.12 Effect of pH on decolorization
2.4.4 响应面设计及结果[22]
依据单因素考察结果,选取CSP含量(A)、树脂用量(B)、糖液pH(C)、脱色时间(D)作为影响因素,脱色率作为评价指标(Y),通过Design-Expert 12软件进行响应面设计。因素水平表见表6,试验设计与结果见表7,方差分析见表8。
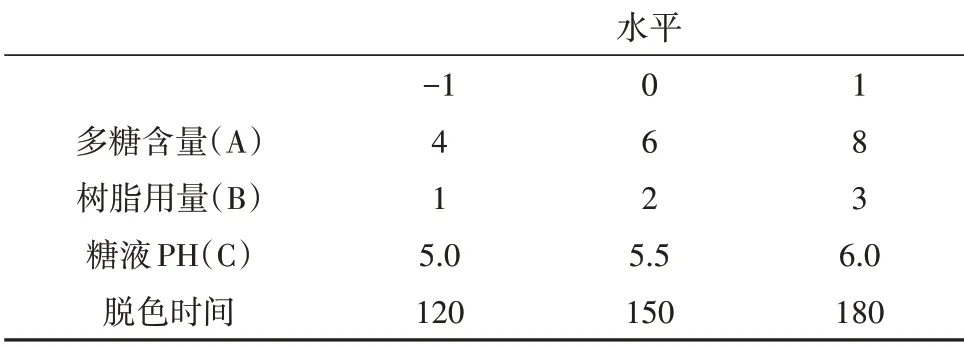
表6 因素水平Tab.6 Factors and levels
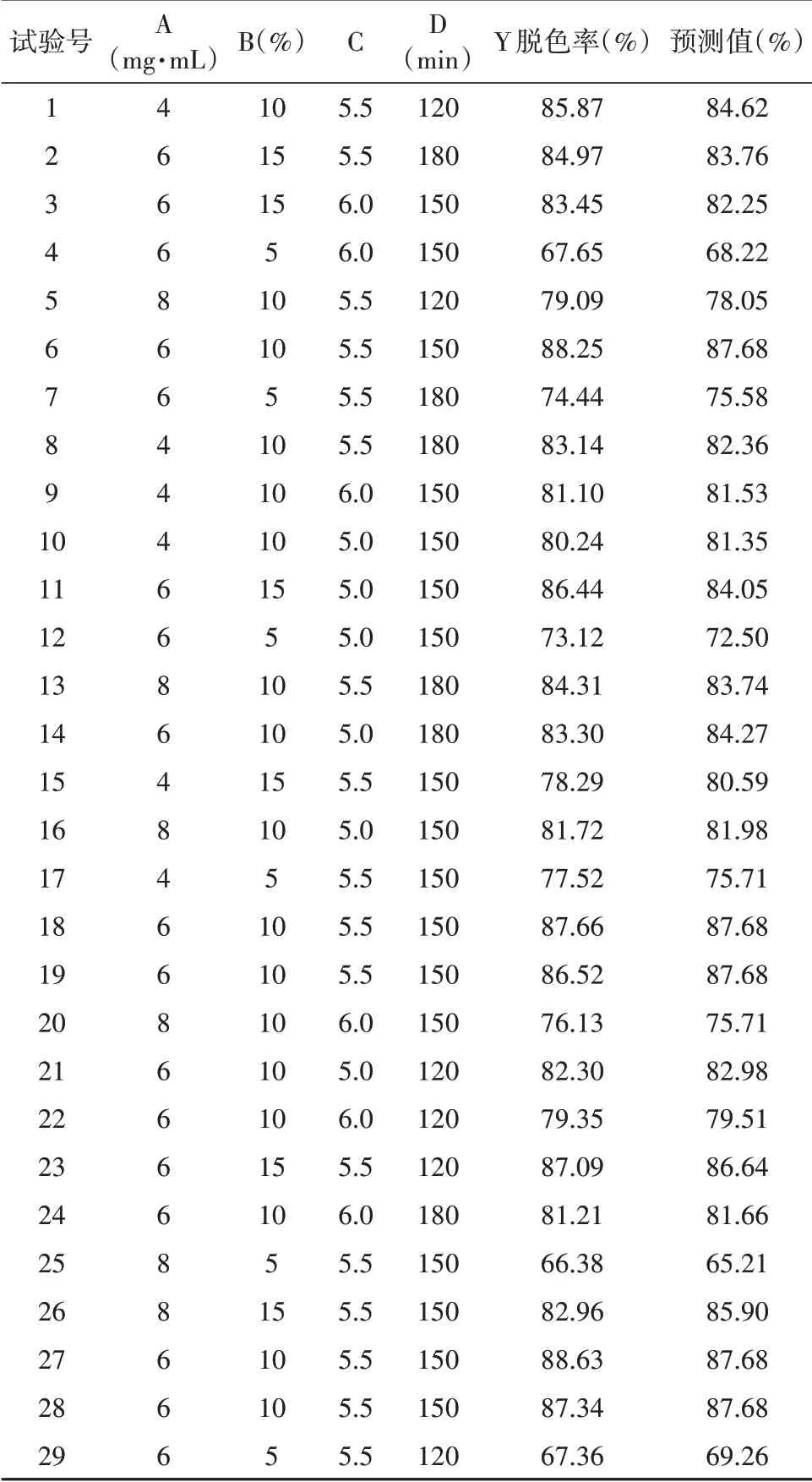
表7 试验设计与结果Tab.7 Experimental design and results
表8 方差分析Tab.8 Analysis of variance
对试验结果进行多元回归分析,得方程Y=87.68-1.30A +6.39B -1.52C +0.86D +3.95AB -1.61AC +1.99AD +0.62BC -2.30BD +0.21CD -3.72A2-7.11B2-3.82C2-1.76D2。由方差分析得,模型显著性检验P<0.05,表明该模型具有统计学意义,自变量一次项A、B、C,二次项AB、AD、BD、A2、B2、C2、D2有显著影响。失拟项P>0.05,表明无失拟因素存在,可用上述回归方程代替实验真实点对试验结果进行分析。模型R2=0.961 3,进一步说明模型拟合优度较好,可用来进行HPD100型大孔吸附树脂对CSP脱色工艺的初步分析和预测。最终确定,最优脱色工艺为:CSP含量为6.23 mg·mL-1,树脂用量为12.38%,糖液pH为5.41,脱色时间为149.59min,脱色率为89.26%。
通过Design expert 8.0.6软件进行响应面分析,结果如图13所示。由此可知,与因素A方向比较,B效应面曲线较陡,表明树脂用量对脱色率的影响高于多糖含量;与A方向比较,C效应面曲线略陡,表明pH对脱色率的影响高于多糖含量;与D方向比较,A效应曲线略陡,表明CSP含量对脱色率的影响高于脱色时间;与C方向比较,B效应面曲线较陡,表明树脂用量对脱色率的影响高于PH;与D方向比较,B效应曲线较陡,表明树脂用量对脱色率的影响高于脱色时间;与D方向比较,C效应曲线较陡,表明pH对脱色率的影响高于脱色时间。综上所述,各因素影响程度依次为B>C>A>D。考虑实际操作情况,将优化的脱色条件调整为CSP含量为6.0 mg·mL-1,树脂用量为12.5%,糖液pH为5.4,脱色时间为150 min。在此条件下进行3次重复实验,发现脱色率为88.03%,88.13%,88.31%,平均脱色率为88.16%,与预测值仅差1.10%。多糖保留率为81.92%,80.21%,82.39%,平 均 多 糖 保 留 率 为81.51%。因此,利用Design-Expert.V8.0.6.1软件Box-Behnken设计模型对CSP的脱色率进行分析与预测是可行的。
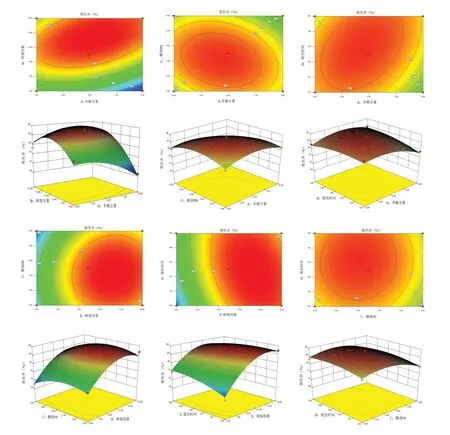
图13 响应面分析Fig.13 Response surface analysis
2.5 透析除杂
为进一步精制CSP,除去小分子杂质,脱蛋白过程中残留铅离子,将脱蛋白、脱色后的CSP溶液经减压浓缩后装入经预处理的透析袋,在4℃条件下蒸馏水透析48 h,白天每4 h换一次水,夜间12 h换一次水。透析后加入无水乙醇使含醇量达到80%以上,静置隔夜后离心,沉淀经真空干燥得到锁阳精制多糖。
3 讨论
本研究通过正交实验优化CSP提取工艺,发现该方法操作简便,易于推广应用。在提取过程中发现提取液冷却后会析出絮状沉淀,加热或者搅拌又使之澄清,并且醇沉后将沉淀复溶,静置后底部仍有絮状沉淀。研究组初步认为絮状沉淀可能为鞣质类化合物和黏液质。有文献报道[23],锁阳鞣质含量约在4.35%~9.79%范围之内。为了排除鞣质等成分对多糖含量测定的影响,最终确定提取工艺为:提取时间为120 min,料液比为1∶40,提取温度为100℃,提取次数为3次,合并提取液将其煮沸加热30 min后,再4℃静置24 h,滤过,取上清液浓缩至一定体积后,经4 000 r·min-1离心10 min,取上层清液加入无水乙醇使含醇量达到80%以上,4℃静置12 h后离心,将所得沉淀用无水乙醇、丙酮、石油醚依次洗涤,每次至滤液几乎澄清,所得沉淀即为锁阳粗多糖。在此工艺条件下,将所得粗多糖复溶,溶液澄清,所得提取率更为合理。
比较4种脱蛋白方法发现,无论何种方法,随着脱蛋白次数的增加或试剂添加量的增加,蛋白脱除率虽逐渐增加,但增幅较小,反观对多糖保留率的影响极为敏感。一般情况下,Sevage法需多次振摇离心脱蛋白,方法繁琐且操作耗时;TCA法已造成多糖结构的改变,且需静置过夜,耗时长且会损失多糖的药理活性;木瓜蛋白酶虽安全环保,但由于酶的专一性蛋白脱除效果并不理想,实验过程中发现改变多糖溶液pH、酶解时间、酶解温度等因素均不能明显改变蛋白脱除率;所选醋酸铅脱蛋白,不仅有较好的脱色率和多糖保留率,而且操作简单,耗时短,成本低,适合工业化生产。但基于安全角度考虑,又进一步进行透析处理,旨在除去小分子杂质,在进一步纯化CSP的同时,去除脱蛋白后CSP溶液中可能残留的铅离子。
大孔吸附树脂具有大孔网状结构及较大比表面积,具有吸附体积大、选择性好、吸附快速、再生方便、价格便宜等优点,与化学脱色方法相比几乎不发生多糖降解[24-25]。本研究通过筛选合适树脂,利用响应面法设计CSP的脱色条件,构建脱色率与CSP含量、树脂用量、糖液pH和脱色时间四者之间的数学模型,确定最佳脱色工艺。研究过程中发现,在室温下脱色效果最好。因此,因素考察中没有涉及到脱色温度。通过优化CSP的水提工艺、脱蛋白及脱色工艺,旨在为更好的开发CSP提供一定的参考意义,为CSP的分离纯化、结构解析及药理活性探讨奠定了一定的基础。

