少根紫萍干粉对典型锕系核素的吸附分离研究*
聂小琴,董发勤,刘 宁,刘明学
(1.西南科技大学 核废物与环境安全省部共建协同创新中心,四川 绵阳 621010;2.西南科技大学 固体废物处理与资源化教育部重点实验室,四川 绵阳 621010;3.四川大学 原子核科学技术研究所,辐射物理及技术教育部重点实验室,四川 成都 610064;4.西南科技大学 生命科学与工程学院,四川 绵阳 621010)
0 引言
近年来,国内外学者逐渐意识到来自废弃矿山的铀污染是一个较为严重的放射性污染,铀与湿地土壤和水体中的铁和有机物结合会提高其活动性,从而导致潜在释放,这意味着铀并非十分容易被还原和固化,其活动性被严重低估[1]。
在进行核试验或发生核事故的过程中,大气沉降灰中的放射性核素或不正常排放的放射性物料将会引起地下水及海水的239Pu污染[2];同位素应用如火灾报警源的生产及回收等的过程中会产生241Am污染[3];在核燃料循环的后处理过程中含有铀、钚、镅等锕系元素的高中水平放射性废液虽经过固化后深地质处置,但因为这些铀及超铀元素半衰期极长,所以仍面临若干年的迁移转化难题;考虑到U、Pu、Am等超U元素对环境的长期潜在威胁,如何有效治理锕系核素污染的环境问题已成为目前的研究热点。从铀矿区、铀尾矿堆和放射性废物地质处置库分离的一些细菌在一定条件下对放射性核素的吸附率超过99%,吸附容量在100~600 mg/g(干质量)[4];然而利用微生物净化水体中放射性核素存在固液分离困难、难以大规模工程应用等问题;相比之下,培养更具优势的植物或开发生物质吸附剂已成为学者关注的另一热点[5-7]。MKANDAWIRE等[8]利用浮萍对铀尾矿水中的铀和砷进行了原位修复研究,结果表明,在21 d室内实验期间,浮萍体内铀的质量分数达(896.9±203.8)mg/kg;在7 d内浮萍可将1 000 L水中的铀质量浓度从100 μg/L降至德国规定的地表水中铀的质量浓度限值(30 μg/L)以下。植物与水体放射性核素的作用大体分为以物理吸附和表面络合为主的代谢不依赖过程,以及以吸收积累、区室化隔离及根际多相界面诱导生物沉积、矿化、还原等的代谢依赖过程。有研究表明,重金属或放射性元素与生物质界面接触后,会优先与细胞表面丰富的含氧、氮和磷的官能团发生配位络合,进而矿化发生还原等作用[9-11],因此有必要进一步探索细胞表面基团在放射性核素与生物质相互作用中的具体贡献。组织中氮磷含量极高的常见浮萍——少根紫萍因其繁殖速度快和无性繁殖可以获取较单一的原材料,因此被认为是植物基础研究理想的模式植物[12]。本文通过化学试剂屏蔽法结合红外光谱分析,系统考查了少根紫萍干粉基团修饰前后对典型长寿命锕系元素吸附分离性能的影响及其作用方式。
1 材料与方法
1.1 少根紫萍干粉制备
采集长相均匀的水生植物少根紫萍,用自来水和超纯水各冲洗3次,然后用质量分数为1%的NaClO溶液消毒2 min,再用超纯水洗3次,以去除根际黏附的细菌和藻类;将其置于装有灭菌Hoagland's营养液的SPX-B-G型光照培养箱中预培养,控制温度(夜20 ℃/昼25 ℃)、相对湿度(65%)和光照强度(10 000 lx),光照时间为12 h/d,每两天更换一次营养液。预培养一周后,挑选长势一致的少根紫萍,经超纯水清洗后,在恒温干燥箱中60 ℃烘干,磨碎过40目筛,筛下物料即为少根紫萍干粉吸附材料。
1.2 少根紫萍干粉基团修饰[13-16]
a.酯基修饰(G1):在225 mL 丙酮中加入3 g 少根紫萍干粉,60 ℃加热水浴6 h,去离子水反复洗涤离心3次,以4 000 r/min转速离心 20 min后收集少根紫萍干粉,60 ℃烘干,研磨备用。
b.羧基修饰(G2):在150 mL 甲醇中加入3 g 少根紫萍干粉和0.5 mL 浓硝酸,30 ℃下以150 r/min转速振荡6 h,洗涤、离心、烘干后备用(步骤同a)。
c.氨基修饰(G3):在120 mL 甲酸中加入3 g 少根紫萍干粉和60 mL 甲醛,30 ℃下以150 r/min转速振荡6 h,洗涤、离心、烘干后备用。
d.磷酸基修饰(G4):在100 mL 磷酸三乙酯中加入3 g 少根紫萍干粉和100 mL 硝基甲烷,静置0.5 h,30 ℃下以150 r/min转速间歇搅拌2 h,洗涤、离心、烘干后备用。
e.羟基修饰(G5):在60 mL 甲醛中加入3 g 少根紫萍干粉,30 ℃下以150 r/min转速振荡6 h,洗涤、离心、烘干后备用。
为了对比,未修饰基团的少根紫萍干粉用G0表示。
1.3 试剂与仪器
1)实验试剂
①混合掩蔽剂:准确称取2.0 g氟化钠和0.930 6 g乙二胺四乙酸二钠,溶于100 mL超纯水中;②显色剂:将0.025%偶氮氯膦Ⅲ溶于100 mL超纯水中;③硝酸:0.1 mol/L;④铀标准溶液:将基准八氧化三铀在850 ℃马弗炉内灼烧4 h,取出冷却;准确称取0.295 g置于50 mL烧杯内,滴入2~3滴水加湿后,加入5 mL 6.0 mol/L的浓硝酸,于电热板上加热溶解并蒸至近干,然后用0.1 mol/L硝酸溶解,转入250 mL容量瓶中,最后用0.1 mol/L硝酸定容至刻度,摇匀,即得质量浓度为1 g/L的铀标准溶液。⑤239Pu标准溶液(1.0×107Bq/L)、241Am标准溶液(1.0×107Bq/L):239Pu、241Am的质量和放射性活度的关系为1 mg239Pu的活度=2.27×106Bq、1 mg241Am 的活度=1.27×108Bq。⑥Hisafe3闪烁液:美国PE公司。实验所用其他试剂均为分析纯级和优级纯级试剂。
2)分析方法
a.铀的分析:用偶氮氯膦Ⅲ分光光度法测试上清液中残余铀浓度,加约5 mL 浓度为0.1 mol/L的HNO3浸湿25 mL比色管,移取0.1~1 mL试样,依次加入0.5 mL混合掩蔽剂、2 mL显色剂,每加入一种试剂均应摇匀,然后用浓度为0.1 mol/L的 HNO3定容至25 mL,摇匀,同时做空白实验。用1 cm比色皿在波长652 nm处测吸光度。
b.239Pu及241Am分析:取一定体积(0.1~1 mL)的待测溶液加入到20 mL聚乙烯闪烁瓶中,然后加入10 mL Hisafe 3闪烁液,摇匀后用液闪仪测放射性计数。
3)实验仪器
Wallac 1414液闪仪,X'Pert PRO 多功能X射线衍射仪,Nicolet-5700型傅里叶变换红外光谱仪,722分光光度计,雷磁PHS-3C型精密pH计,800型离心沉淀器,BS210S型电子天平,六联磁力搅拌器,真空干燥箱,马弗炉。
1.4 吸附实验
1)铀的吸附
配制一定质量浓度的铀溶液,然后采用0.1 mol/L HNO3、10 g/L Na2CO3、5 g/L NaHCO3的缓冲溶液调节溶液pH至所需值;取200 mL 铀溶液于250 mL 锥形瓶中,加入一定质量的少根紫萍干粉,在常温下置于恒温振荡器中以150 r/min转速静态吸附一定时间后,取10 mL吸附铀后的溶液于4 000 r/min转速下离心20 min,取上清液分析铀质量分数。每组实验设3个平行样。
2)239Pu或241Am的吸附
将含有239Pu或241Am的溶液 的pH调至所需值,取20 mL置于25 mL锥形瓶中,加入一定量少根紫萍干粉,置于六联磁力搅拌器上,在恒温下搅拌吸附0.5~2 h后在离心机上以4 000 r/min的转速离心 20 min,取上清液0.1~3 mL置于液闪测量瓶中,加入闪烁液,摇匀,利用液体闪烁计数器对上清液中剩余239Pu或241Am进行闪烁计数,计算239Pu或241Am的放射性活度,及相应的吸附率和吸附容量。吸附率R和吸附容量Q分别按式(1)和式(2)计算,放射性活度A的计算如式(3)所示。
(1)
(2)
A=(N-α本底)·e(α)/(t·V1),
(3)
式中:C0为溶液初始U质量浓度(mg/L)或初始239Pu、241Am放射性活度浓度(Bq/L);Ct为吸附t时刻溶液的U质量浓度(mg/L)或239Pu、241Am放射性活度浓度(Bq/L);V为溶液体积(L);m为少根紫萍干粉质量(g);t为计数时间(s);V1为分析取样体积(mL);N为总α闪烁计数值(次/min);α本底=0.8;e(α)为探测效率。
3)表征手段及样品制备
将少根紫萍干粉与100 mg/L铀溶液作用后,取样,经4 000 r/min离心20 min,弃上清液,沉淀物45 ℃烘干备用,利用XRF、FTIR分别进行元素分布、表面基团分析。FTIR的波数范围为4 000~400 cm-1。
2 结果与讨论
2.1 少根紫萍干粉对铀、钚、镅的吸附行为
2.1.1 pH对少根紫萍干粉吸附铀、钚、镅的影响
1)pH对少根紫萍干粉吸附U(Ⅵ)的影响
pH是影响生物吸附铀的重要因素之一,因为不同pH溶液中铀的存在形态不同,并且酸度还会影响生物体的表面电荷。在V=200 mL、m=0.25 g、pH=3~7、t=30 min、C0=5 mg/L的条件下考查pH 对少根紫萍干粉吸附U(Ⅵ)的影响以及在[U (Ⅵ)]总=l.71×10-4mol/L、离子强度=0.1 mol/L的条件下考查U(Ⅵ)在不同pH溶液中的种态分布,结果见图1。
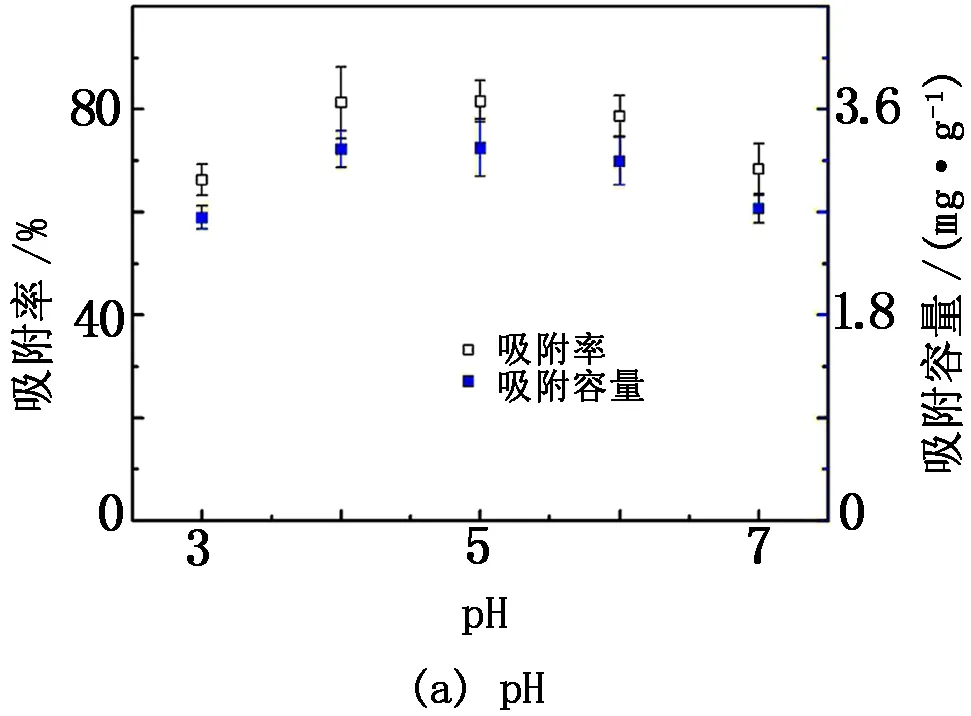
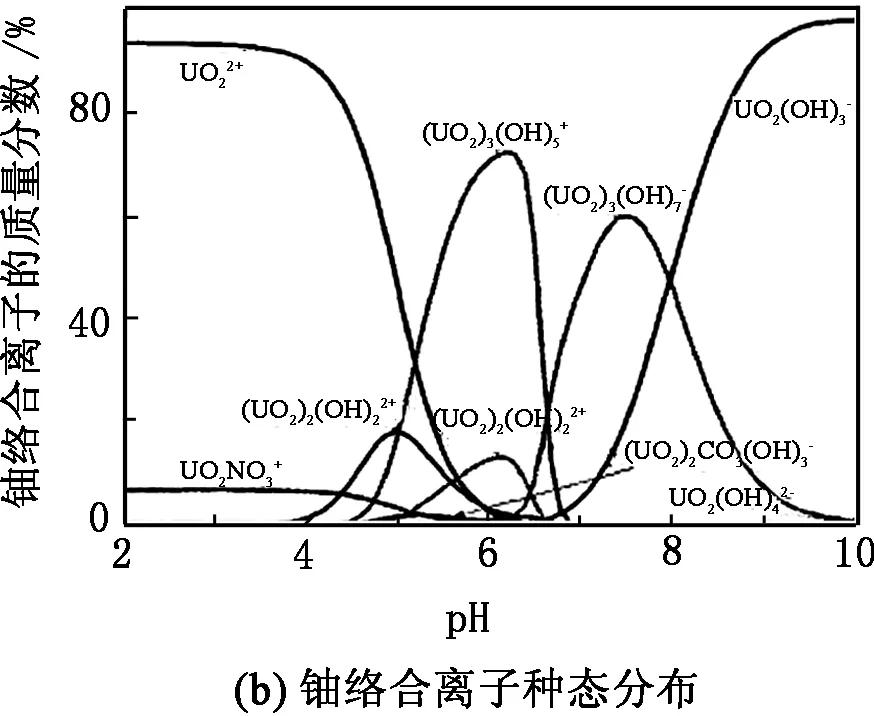
图1 pH 对U(Ⅵ)在少根紫萍干粉上吸附的影响及不同pH下U(Ⅵ)在溶液中的种态分布
由图1(a)可知:当pH<4时,吸附率随着pH的增大而升高;最佳pH在4~5,少根紫萍干粉对溶液中U(Ⅵ)的吸附率均超过80%,与文献[17-18]报道的U(Ⅵ)生物吸附最佳pH一致。由图1(b)可知:pH为4~5时,U(Ⅵ)主要以UO22+存在, UO22+先因受静电吸引而快速接近少根紫萍干粉带负电荷的表面;当pH>5时,铀的去除率随溶液pH的增大反而降低。因为随着pH的增大,UO22+逐渐水解成(UO2)3(OH)5+等,因这些络合阳离子的半径较大,导致其与少根紫萍干粉表面的活性位点结合数量减少;当pH>6后,(UO2)3(OH)7-、UO2(OH)3-等络阴离子逐渐成为溶液中铀络合离子的主要种态,其与少根紫萍干粉表面的负电荷产生静电斥力,导致吸附率逐渐下降。
2)pH对少根紫萍干粉吸附239Pu的影响
在pH=1.0~11.0、C0=1.04×106~1.31×106Bq/L、m=0.10 g、V=20 mL、t=30 min的条件下,考查溶液pH对少根紫萍干粉吸附239Pu的影响,结果见图2。
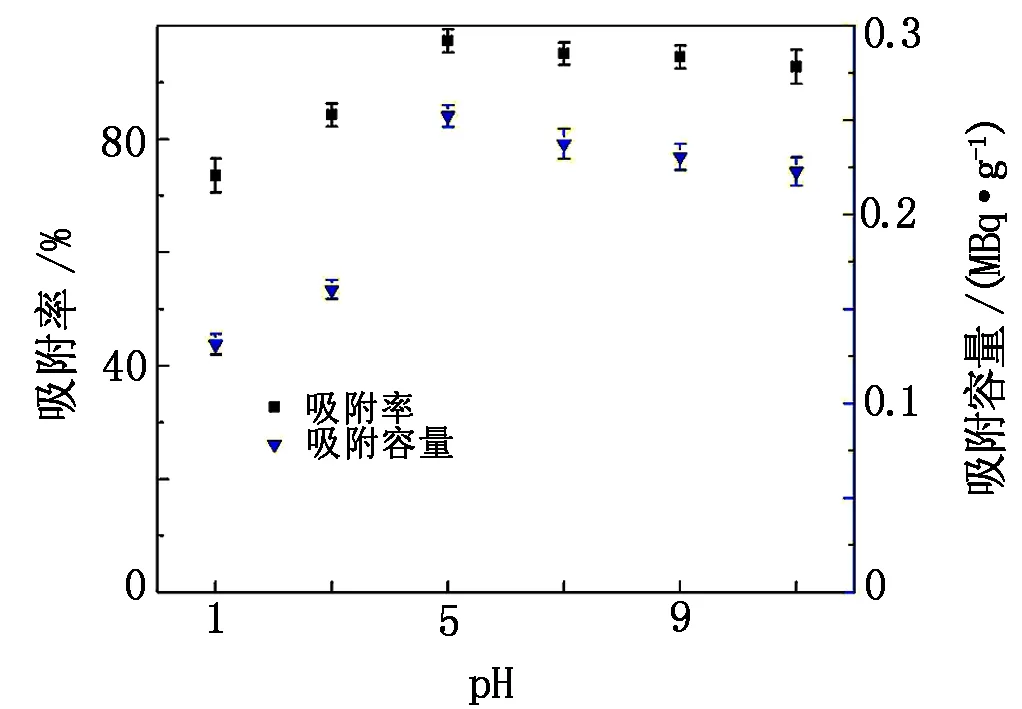
图2 pH对少根紫萍干粉吸附239Pu的影响
由图2可以看出:pH对少根紫萍干粉吸附239Pu的行为有显著影响,其最适宜pH为5~11,此时少根紫萍干粉对239Pu的吸附率和吸附容量分别为97.32%~92.75%和0.25~0.22 MBq/g;当溶液pH为1~3时,随着酸度的增加,239Pu的吸附能力随之下降;随着溶液中pH的增大,239Pu逐渐从Pu4+转变为Pu3+、PuO22+、PuO2+等自由阳离子及其水解成为氢氧化物络合阳离子[19-21],这些水解产物极易吸附于溶液中的少根紫萍干粉悬浮颗粒而被除去。
3)pH对少根紫萍干粉吸附241Am的影响
在pH=1~9、C0= 5.24×107~9.39×107Bq/L、m=0.1 g、V=5 mL、t=30 min的条件下,考查溶液pH对少根紫萍干粉吸附241Am的影响,结果见图3。

图3 pH对少根紫萍干粉吸附241Am的影响
由图3可以看出:pH对少根紫萍干粉吸附241Am的行为有一定影响,主要体现在241Am在水溶液中存在的种态和少根紫萍干粉表面电荷分布两个方面;当pH=1时,少根紫萍干粉对241Am的吸附率和吸附容量最高,分别为84.21%和3 160 Bq/g,这与文献[22-23]报道的微生物吸附241Am的最佳pH一致;随着溶液pH的增加,241Am水解为氢氧化物,以胶体形式存在的可能性增大,导致部分241Am极易吸附在反应容器壁上而降低了241Am的放射性活度;因此随着pH从1增至9,相应的吸附容量从3 160 Bq/g降至2 000 Bq/g。
2.1.2 少根紫萍干粉对239Pu和241Am的批次吸附实验
在pH=1.75、C0=6.78×106Bq/L、m=0.05 g、V=10 mL、t=30 min和pH=1.77、C0=1.29×105Bq/L、m=0.05 g、V=10 mL、t=30 min的条件下分别进行少根紫萍干粉对239Pu和241Am的6批次和3批次吸附实验,结果见图4。

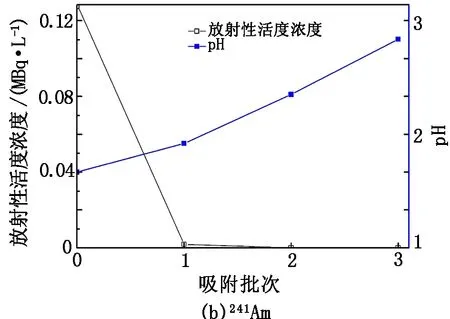
图4 少根紫萍干粉对239Pu和241Am的批次吸附放射性活度浓度及pH变化图
在更换少根紫萍干粉不换239Pu溶液的条件下,经过连续6批次少根紫萍干粉吸附,溶液中239Pu放射性活度浓度从6.78 MBq/L梯次递降至3.20 ×103Bq/L [见图4(a)],pH由1.75升至5.30;当第4次吸附时,溶液pH为5.03,总的吸附率已达到99.42%。在更换少根紫萍干粉不换241Am溶液的条件下,经过连续3批次少根紫萍干粉吸附,溶液中241Am放射性活度浓度从1.29×105Bq/ L 梯次递降至2.00 Bq/L [见图4(b)],接近GB 8978—1996 《污水综合排放标准》中规定的∑α放射性活度浓度(1 Bq/L)标准,pH由1.77升至3.12;经过2次吸附,放射性活度浓度下降了99.98%。
2.2 基团修饰对少根紫萍干粉吸附铀、钚、镅的影响
2.2.1 基团修饰对少根紫萍干粉吸附U(Ⅵ)的影响
在V=200 mL、m=1 g、pH=5、t=2 h,C0= 50 mg/L的条件下进行基团修饰对少根紫萍干粉吸附U(Ⅵ)的影响实验,结果见图5。由图5可知:含铀溶液经酯基、羧基、氨基、磷酸基、羟基屏蔽处理后的少根紫萍干粉吸附2 h后,铀的去除率分别达到93.80%、83.80%、93.00%、96.80%、96.20%,剩余铀质量浓度分别为3.10、8.10、3.50、1.60、1.90 mg/L;而未经基团屏蔽的少根紫萍干粉对铀的去除率达到99.84%,剩余铀质量浓度仅为0.08 mg/L。由此表明,少根紫萍干粉表面的羧基、氨基、酯基、磷酸基和羟基均对铀的吸附有一定贡献。

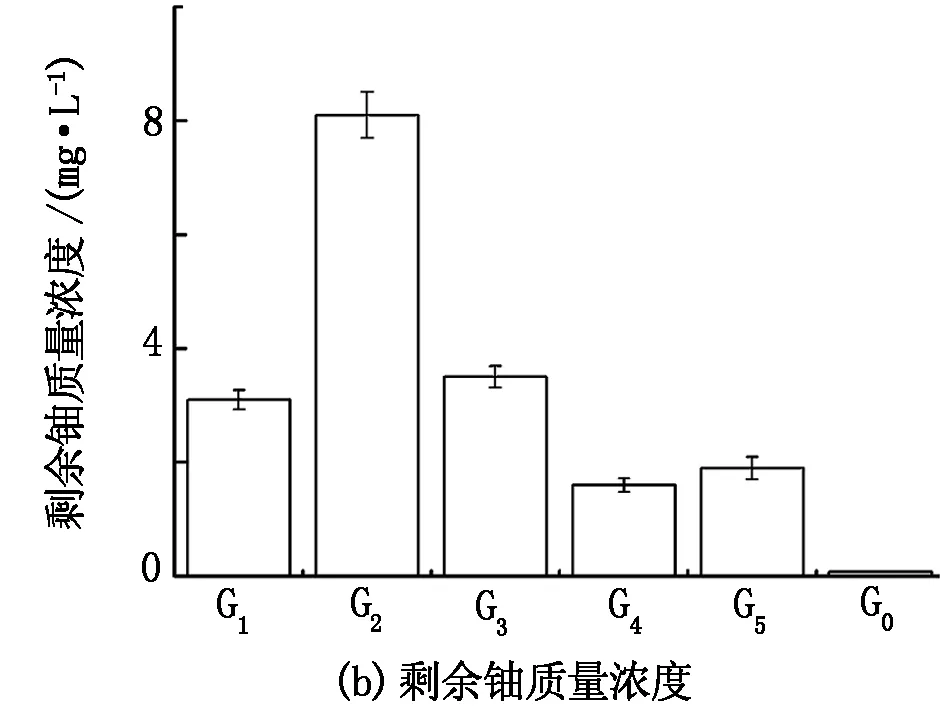
图5 基团修饰对U(Ⅵ)在少根紫萍干粉上吸附的影响
2.2.2 基团修饰对少根紫萍干粉吸附Pu(Ⅳ)的影响
在V=5 mL、m=0.1 g、pH=5、t=30 min、C0= 1.11×107Bq/L的条件下进行基团修饰对少根紫萍干粉吸附Pu(Ⅳ)的影响实验,结果见图6。由图6可知:含钚溶液经酯基、羧基、氨基、磷酸基、羟基屏蔽处理后的少根紫萍干粉吸附30 min后,钚的去除率分别达到80.92%、87.56%、93.12%、86.59%、82.79%,剩余放射性活度浓度分别为2.12、1.38、0.76、1.49、1.92 MBq/L;而未经基团屏蔽的少根紫萍干粉对钚的去除率达到96.23%,剩余钚放射性活度浓度仅为0.42 MBq/L。由此表明,少根紫萍干粉表面的羧基、氨基、酯基、磷酸基和羟基均对钚的吸附均有一定贡献。

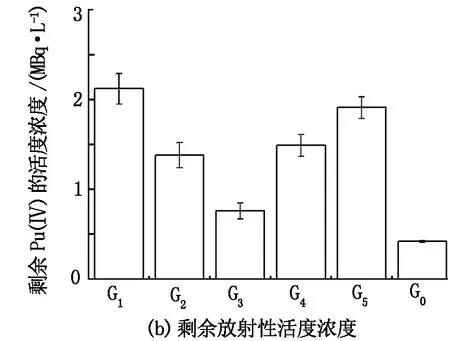
图6 基团修饰对Pu(Ⅳ)在少根紫萍干粉上吸附的影响
2.2.3 基团修饰对少根紫萍干粉吸附Am(Ⅲ)的影响
在pH=1.77、C0=1.29×105Bq/L、m=0.1 g、V=10 mL、V1=0.2 mL、t=30 min的条件下进行基团修饰对少根紫萍干粉吸附Am(Ⅲ)的影响实验,结果见图7。
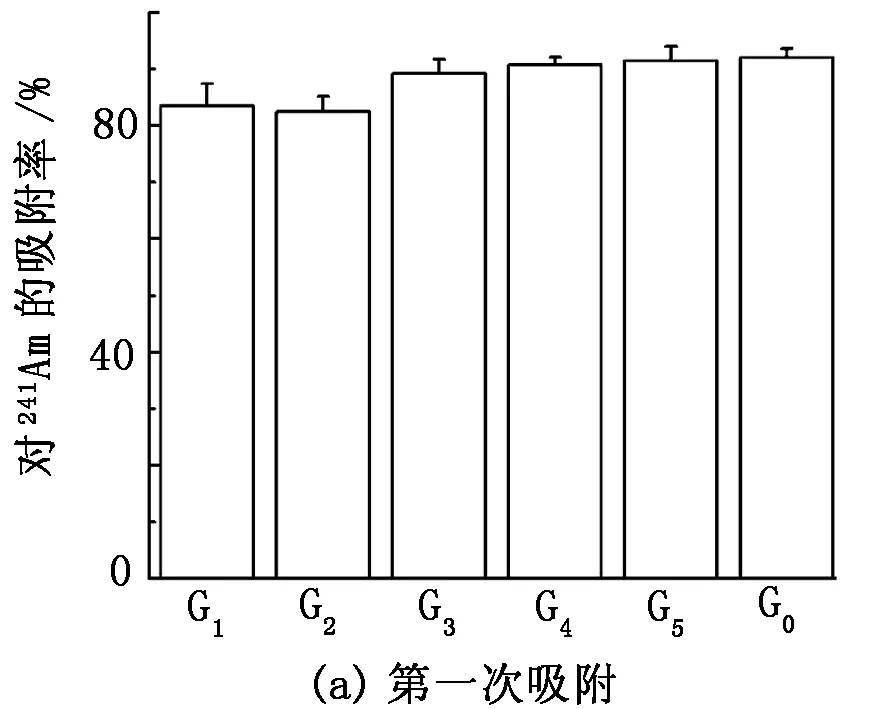
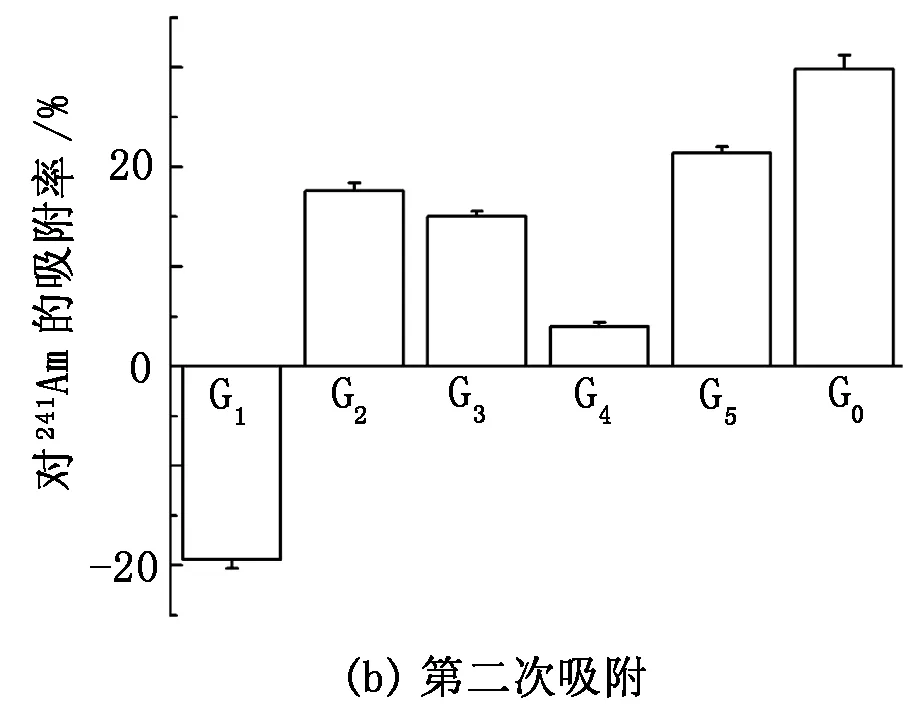
图7 基团修饰对Am(Ⅲ)在少根紫萍干粉上吸附的影响
由图7可知:含镅溶液经酯基、羧基、氨基、磷酸基、羟基屏蔽处理后的少根紫萍干粉吸附(磁力搅拌100 r/min)30 min后,镅的去除率分别达到83.52%、82.42%、89.20%、90.69%、91.40%,而未经基团屏蔽的少根紫萍干粉对镅的去除率达到92.04%;经4 000 r/min离心20 min,固液分离,再分别加入10 mL放射性活度浓度为1.29×105Bq/L的镅溶液,吸附30 min 后,镅的去除率分别为-19.41%、17.60%、15.05%、3.98%、21.39%,而未经基团屏蔽的少根紫萍干粉对镅的去除率为29.83%。由此表明,少根紫萍干粉表面的活性基团均对镅的吸附有一定贡献。
2.3 吸附U(Ⅵ)前后少根紫萍干粉表征结果与分析
2.3.1 基团屏蔽少根紫萍干粉吸附U(Ⅵ)前后FTIR分析
图8(a)为0.25 g少根紫萍干粉与200 mL、 pH=5、初始质量浓度为200 mg/L的 U(Ⅵ)溶液作用前后的FTIR谱图。从图8(a)少根紫萍干粉吸附U(Ⅵ)前的FTIR谱图可见:3 391.1 cm-1左右存在一个强而宽的谱带,该处为羟基—OH和氨基—NH2的伸缩振动吸收峰;2 926.6 cm-1和2 855.7 cm-1附近分别为脂类的亚甲基-CH2-非对称和对称伸缩振动吸收峰;1 646.5 cm-1、1 543.9 cm-1分别归属于酰胺Ⅰ带C—N和酰胺Ⅱ带—NH2的特征吸收峰;1 405.4 cm-1归属于羧基-COOH的δυC=O和υC-O的特征吸收峰;1 405~1 100 cm-1区间出现了一系列弱峰,与-OH、-NH2、-CH2-变形振动和C—O、C—N伸缩振动有关,其中1 238.4 cm-1和1 103.1 cm-1分别为核酸的磷酸二酯键基团的反对称和对称伸缩振动吸收峰;1 076.3 cm-1和1 053.9 cm-1附近的吸收峰主要为纤维素糖链和半纤维素中C—C、C—O和C—O—C键的吸收峰,或为多糖羟基、有机磷酸基团的吸收峰;900~500 cm-1区间为碳水化合物的糖环伸缩振动吸收峰[24-25]。由此可以推断,少根紫萍干粉体内含有较多蛋白质、酰胺化合物和纤维素,主要有氨基、羟基、酯基、羧基和磷酸基等活性基团。从图8(a)少根紫萍干粉吸附U(Ⅵ)后的FTIR谱图可见:羟基和氨基的伸缩振动吸收峰蓝移了12 cm-1,多糖羟基吸收峰蓝移22 cm-1,两处羟基吸收峰强度减弱,峰形明显增宽;酰胺Ⅰ带和酰胺Ⅱ带特征吸收峰分别蓝移9 cm-1和红移2 cm-1;脂类的-CH2-非对称伸缩振动吸收峰蓝移1 cm-1,对称伸缩振动吸收峰消失;羧基的δυC=O和υC-O的特征吸收峰蓝移27 cm-1;归属于磷酸二酯键基团的反对称伸缩振动吸收峰红移15 cm-1,对称伸缩振动吸收峰消失;表明羟基、氨基、酯基、羧基、磷酸基参与了少根紫萍干粉对U(Ⅵ)的吸附。根据文献[26-27]报道可知:U在600~400 cm-1和1 100~1 000 cm-1区间有两个特征吸收谱带,其中第一个谱带是由U(Ⅳ)的存在而形成的,第二个谱带与UO22+的存在有关,UO22+的反对称伸缩振动吸收峰在924~889 cm-1区间。本研究少根紫萍干粉吸附U(Ⅵ)后在895.6 cm-1处出现了新的吸收峰,表明少根紫萍干粉吸附U(Ⅵ)后存在UO22+的特征吸收峰;在600~400 cm-1区间峰形发生了明显变化。
图8(b)是酯基屏蔽少根紫萍干粉与铀作用前后的FTIR谱图。由图8(b)可知,屏蔽酯基主要影响的是表面脂类的-CH2-和形成酯类的羟基。屏蔽酯基后羟基伸缩振动吸收峰从3 391.1 cm-1蓝移至3 411.1 cm-1,脂类的-CH2-对称伸缩振动吸收峰2 855.7 cm-1和酰胺Ⅱ带特征吸收峰1543.9 cm-1消失,酰胺Ⅰ带C—N特征吸收峰从1 646.5 cm-1红移到1 625.1 cm-1,多糖—OH吸收峰红移22 cm-1。与U(Ⅵ)作用后,—OH和—NH2的伸缩振动吸收峰蓝移12 cm-1,多糖—OH吸收峰红移4 cm-1,主要来自细胞壁膜的-CH2-的伸缩振动吸收峰从2 926.6 cm-1蓝移到2 927.2 cm-1,酰胺带吸收峰位移较小。1 405~1 100 cm-1区间出现的一系列与—OH、—NH2、-CH2-变形振动和C—O、C—N伸缩振动有关的吸收峰以及核酸的磷酸二酯键基团的反对称和对称伸缩振动吸收峰峰形变化较大,1 383.9 cm-1出现了新的吸收峰,表明酯基屏蔽的少根紫萍干粉在吸附U(Ⅵ)时C或N提供了配位原子,主要与羟基、氨基、羧基和磷酸基发生了作用。
图8(c)是羧基屏蔽少根紫萍干粉与铀作用前后的FTIR谱图。由图8(c)可知,屏蔽羧基主要影响的是表面酰胺Ⅰ带、Ⅱ带、Ⅲ带中的—COOH及其他相关的羧基基团。屏蔽羧基后,-CH2-的对称伸缩振动吸收峰消失,酰胺Ⅰ带C-N特征吸收峰从1 646.5 cm-1红移到1 629.5 cm-1,酰胺Ⅱ带特征吸收峰从1 543.9 cm-1红移到1 542.9 cm-1,酰胺Ⅲ带特征吸收峰从1 238.4 cm-1蓝移到1 240.6 cm-1,—COOH的δυC=O和υC-O的特征吸收峰从1 405.4 cm-1红移到1 384.4 cm-1。与U(Ⅵ)作用后,—OH和—NH2的伸缩振动吸收峰蓝移23 cm-1,多糖—OH吸收峰蓝移5 cm-1,-CH2-的伸缩振动吸收峰从2 926.6 cm-1蓝移到2 925.9 cm-1,C—O伸缩振动吸收峰1 202.7 cm-1和有机磷酸基团特征吸收峰1 076.5 cm-1消失,在1 103.5 cm-1和618.5 cm-1出现了新的吸收峰,可能是U—O键振动所致。表明羧基屏蔽的少根紫萍干粉在吸附U(Ⅵ)时主要与羟基、氨基、酯基和磷酸基发生了作用。
图8(d)是氨基屏蔽少根紫萍干粉与铀作用前后的FTIR谱图。由图8(d)可知,屏蔽氨基主要影响的是表面酰胺带和氨基相关的基团。屏蔽氨基后,—NH2的伸缩振动吸收峰蓝移1 cm-1,-CH2-的对称伸缩振动吸收峰消失,酰胺Ⅰ带C-N特征吸收峰从1 646.5 cm-1红移到1 624.9 cm-1,酰胺Ⅱ带特征吸收峰从1 543.9 cm-1红移到1 541.5 cm-1,酰胺Ⅲ带特征峰从1 238.4 cm-1蓝移到1 239.9 cm-1,—COOH的δυC=O和υC-O的特征吸收峰从1 405.4 cm-1红移到1 402.2 cm-1,1 405~1 100 cm-1区间出现的一系列与—NH2变形振动有关的吸收峰都有所减弱。与U(Ⅵ)作用后,—OH的伸缩振动吸收峰蓝移19 cm-1,多糖—OH吸收峰红移4 cm-1,两处峰形明显变宽,吸收峰强度减弱;-CH2-吸收峰从2 924.8 cm-1蓝移到2 925.1 cm-1,峰形变尖锐;C—O伸缩振动吸收峰1 202.7 cm-1消失,1 232.8 cm-1附近的有机磷酸基团伸缩振动吸收峰出现明显变形,1 100~800 cm-1区间的UO22+特征吸收峰波形有较大改变。表明氨基屏蔽的少根紫萍干粉在吸附U(Ⅵ)时主要与羟基、酯基、磷酸基团发生了作用。
图8(e)是磷酸基屏蔽少根紫萍干粉与铀作用前后的FTIR谱图。由图8(e)可知,屏蔽磷酸基主要影响的是表面酰胺带和磷酸二酯键基团。屏蔽磷酸基后,归属于核酸的磷酸二酯键基团的反对称伸缩振动吸收峰1 238.4 cm-1和对称伸缩振动吸收峰1 103.1 cm-1消失,代表有机磷酸基团的1 076.3 cm-1附近的吸收峰也已消失。与U(Ⅵ)作用后,羟基和氨基的伸缩振动吸收峰蓝移12 cm-1,多糖—OH吸收峰红移2 cm-1,两处羟基吸收峰强度减弱,峰形明显变宽;-CH2-的伸缩振动吸收峰从2 924.7 cm-1蓝移到2 925.5 cm-1,峰形变尖锐;归属于核酸的磷酸二酯键基团的对称伸缩振动吸收峰出现在1 103.5 cm-1,600 cm-1附近的铀特征吸收峰波形有较大改变,表明磷酸基屏蔽的少根紫萍干粉在吸附U(Ⅵ)时主要与羟基、氨基、酯基发生了作用。
图8(f)是羟基屏蔽少根紫萍干粉与铀作用前后的FTIR谱图。由图8(f)可知,屏蔽羟基主要影响的是表面酰胺带及-OH基团。屏蔽羟基后,—OH的伸缩振动吸收峰蓝移至3 411.1 cm-1,酰胺Ⅱ带特征吸收峰1 543.9 cm-1消失,酰胺Ⅰ带C-N特征吸收峰从1 646.5 cm-1红移到1 624.9 cm-1,归属于多糖羟基的吸收峰从1 053.9 cm-1移至1 036.0 cm-1。与U(Ⅵ)作用后,酰胺Ⅰ带C-N特征吸收峰从1 646.5 cm-1红移到1 624.9 cm-1,酰胺Ⅲ带特征吸收峰从1 236.6 cm-1蓝移到1 241.2 cm-1,1 103.5 cm-1处的新峰归属于核酸的磷酸二酯键基团的对称伸缩振动吸收峰,表明羟基屏蔽的少根紫萍干粉在吸附铀时主要与酯基、磷酸基发生了作用。
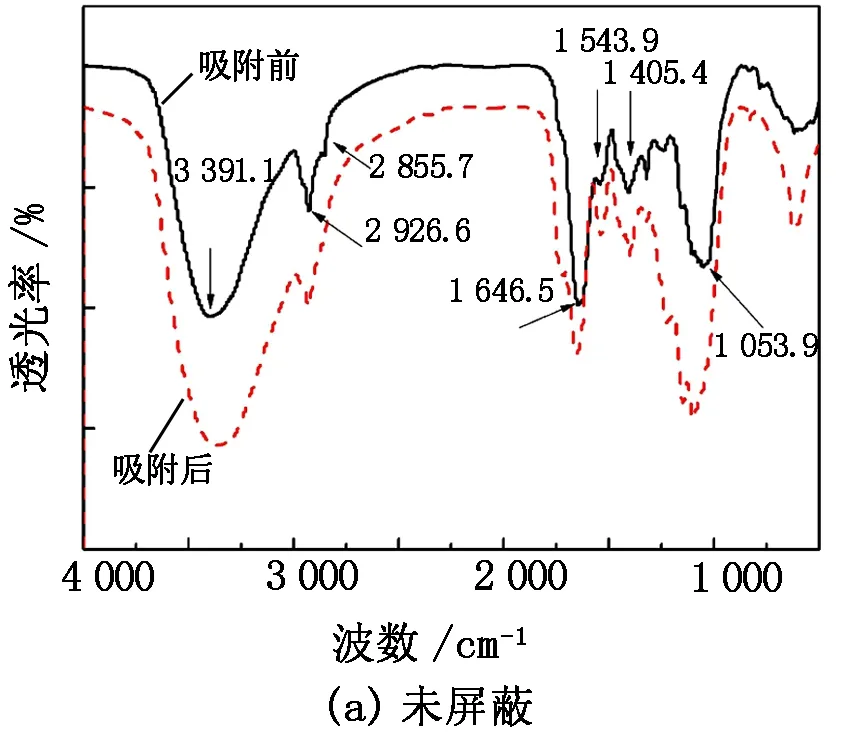


图8 基团屏蔽少根紫萍干粉与铀作用前后的FTIR谱图
2.3.2 少根紫萍干粉吸附U(Ⅵ)前后XRF分析
少根紫萍干粉与铀作用前后的XRF结果见表1。由表1可以看出,少根紫萍干粉的主要无机元素组成有Ca、P、Cl、S、K、Mn、Fe等。3 g少根紫萍干粉与200 mL、 pH=5 的200 mg/L U(Ⅵ)溶液作用2 h后,元素的比例有一些变化,在吸附后的样品中检出了2.671%的U,说明少根紫萍干粉对U(Ⅵ)的吸附反应是可行的。同时,吸附后干粉中的Ca、K、Mn、Fe、P的质量分数均有所下降,尤其是K,推测在吸附过程中存在离子交换作用。
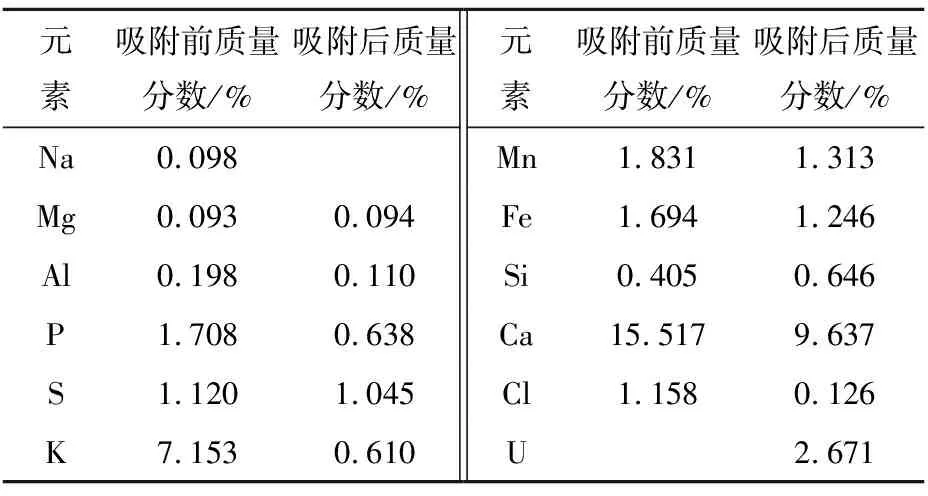
表1 少根紫萍干粉与铀作用前后的XRF结果
2.3.3 少根紫萍干粉吸附U(Ⅵ)前后XRD分析
少根紫萍干粉吸附U(Ⅵ)前后的XRD分析结果见图9。

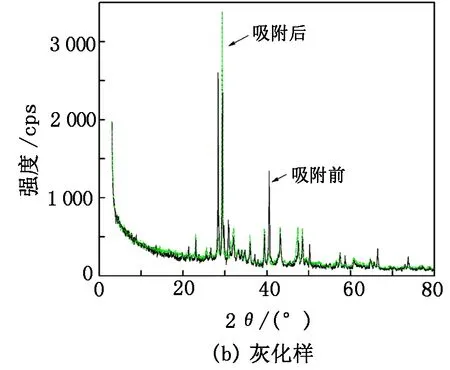
图9 少根紫萍干粉与200 mg/L U(Ⅵ)作用前后的XRD图
从图9(a)可以看出:在吸附U(Ⅵ)之后,少根紫萍干粉的晶形基本未变,其在2θ为14.84°处有一明显主峰,经与标准卡片对比,确认为纤维素的特征峰;吸附后在2θ为14.27°处出现了明显的纤维素特征峰,峰高明显增强,表明少根紫萍干粉在与铀溶液作用过程中,纤维素参与了其中的一些反应;少根紫萍干粉在2θ为24.37°、29.98°处也出现了明显的特征峰,是典型的SiO2特征峰;少根紫萍干粉在2θ为24.33°、30.01°处出现了几个较大的峰,相比吸附前峰高有明显的增加。少根紫萍干粉在吸附铀后结晶度增加,表明少根紫萍干粉可能与U(Ⅵ)结合形成了具有晶体结构的金属化合物。少根紫萍干粉的纤维素和SiO2活性位点暴露较明显,这种结构使得少根紫萍干粉有可能成为理想的吸附剂。为了进一步了解样品中是否因结合铀而出现新的结晶峰,对少根紫萍干粉进行灰化处理(550 ℃,6 h)以减少样品中有机物的比例,灰化处理结果见图9(b)。从图9(b)可以看出,纤维素的特征峰消失,SiO2的特征峰更加明显,未观察到新的结晶峰出现,表明少根紫萍干粉吸附铀后铀仍然以UO22+的形式存在,没有以铀的单质晶体的形式存在。
3 结语
本研究系统地考查了少根紫萍干粉在基团屏蔽前后对锕系主要放射性核素238U、239Pu、241Am的吸附行为,同时采用FTIR、XRF和XRD对吸附铀的机理进行了初步探索,结果表明:
a.少根紫萍干粉对238U的吸附能力较强,常温下0.25 g少根紫萍干粉在30 min内对5 mg/L U(Ⅵ)(pH=5)溶液的吸附率在80%以上,分别在pH=5和pH=1时对239Pu和241Am的吸附效果最佳。对于初始放射性活度浓度为5.24×107~9.39×107Bq/L的241Am溶液,随着pH从1增加至9,少根紫萍干粉对241Am的吸附容量从3 160 Bq/g降至2 090 Bq/g;经过3批次少根紫萍干粉吸附,溶液中241Am放射性活度浓度可从1.29 ×105Bq/L梯次递降至2.00 Bq/L;经过6批次少根紫萍干粉吸附,溶液中239Pu放射性活度浓度可从6.78 MBq/L 梯次递降至3.20×103Bq/L。
b.基团屏蔽、累积吸附实验和谱学表征等结果表明,修饰过表面羧基、氨基、酯基、磷酸基和羟基等基团的少根紫萍干粉对238U、239Pu、241Am的吸附率和吸附容量有一定程度的减弱,少根紫萍干粉表面的活性基团不同程度地参与了锕系核素的吸附,对铀的吸附分离主要通过表面基团络合配位及离子交换等方式实现。

