甜龙竹不同栽培模式对土壤酶活性的影响及其相关因素分析
张文君 刘蔚漪 朱礼月 涂丹丹 朱书红 赵秀婷 辉朝茂
(西南林业大学 竹藤科学研究院/国家丛生竹工程技术研究中心 昆明 650224)
甜龙竹(Dendrocalamus brandisii),即勃氏甜龙竹、勃氏麻竹[1],又称甜竹,是禾本科(Gramineae) 竹亚科 (Bambusoideae) 牡竹属(Dendrocalamus) 的一种大型笋、材两用丛生竹种[2]。其秆高一般为15~ 20 m,粗度为10~15 cm,在中国云南广泛栽培,其笋具有 “鲜、甜、嫩、脆” 4 大特征[3],甘甜可口,营养丰富,宜鲜食[4],具有良好的经济、社会、文化、生态效益[5]。
甜笋可食、竹材可用,使甜龙竹的经济效益在大型丛生竹中尤为突出。云南作为中国重要的甜龙竹产地,甜竹林经营却较为单一,多是纯竹林或竹阔混交林,在一定程度上使甜龙竹丧失了物种竞争。从现有研究情况来看,纯竹林容易出现生物多样性低、竹林稳定性差、土壤结构不良、容易受病虫危害、林分生产力下降等问题[6]。Tesfahunegn[7]和Ilany 等[8]认为,单一的栽培模式更容易消耗土壤的养分,不同的栽培模式能更好地减少土壤养分的丧失,进而提高土壤的综合肥力和生物活性。
土壤酶是土壤微生物产生的具有高度催化活性的物质,是控制土壤养分分解和循环等生化过程的主要介质[9],是参与土壤生态系统中各种生化反应的重要成分[10]。由于土壤酶对森林经营实践和土壤环境质量的变化具有高度敏感性,所以常被用于评估土壤环境变化[11],在生态系统能量流动中起关键作用,影响植物的发育和演替[9,12]。赵睿宇等[13]在毛竹林土壤酶活性的研究中指出,土壤酶活性与土壤养分含量具有很大相关性。蔺芳等[14]在紫花苜蓿与黑麦草不同种植模式土壤酶活性的研究中指出,与沙化裸地相比,紫花苜蓿与多年生黑麦草混播模式下5 种土壤酶活性最高。罗影等[15]研究认为,胡麻不同种植模式对土壤过氧化氢酶、脲酶、蔗糖酶和碱性磷酸酶的活性均有显著影响。国内外关于甜龙竹不同栽培模式对土壤酶活性影响的研究相对较少,本文从探究土壤酶活性对甜龙竹不同栽培模式的响应着手,研究不同栽培模式对甜龙竹竹笋产量的影响,对于指导生产实践具有重要意义。
1 试验地概况
试验基地位于云南省沧源佤族自治县勐甘村,地理位置为东经 99° 4′ 54.3″、北纬23°9′26.3″。试验地西高东低,海拔1 380~1 430 m,西南处最高,面积约6.67 hm2,土壤性质分布相对均匀。全年气候温暖、光照充足,受西南季风和东南季风共同作用,夏季无酷暑、冬季无严寒,属亚热带低纬山地季风气候类型;年均气温18 ℃,最低气温-1.3 ℃,最高气温34.6 ℃,年均无霜日数317 d,年均日照时数2 115 h,年均降水量1 425~1 595 mm,月日照时数有7 个月低于200 h。土壤质地较粘,土层深厚,土壤pH 值为4.9~5.3。
2 材料与方法
2.1 试验设计
设置5 种甜龙竹栽培模式的处理:处理1,甜龙竹×核桃(Dendrocalamus brandisii×Juglans regia,简写为ZH,下同);处理2,甜龙竹×杉木(D.brandisii×Abies holophylla,ZS);处理3,甜龙竹×古茶树(D.brandisii×Camellia sinensisvar.assamica,ZC);处 理4,甜龙竹×果树 (D.brandisii×Malus pumila,ZG);处理5,甜龙竹×西南桦(D.brandisii×Betula alnoides,CK),作为对照处理。
在每种处理的样地中用“五点采样法” 取土壤剖面,分层采集0~20、20~40、40~60 cm 土层新鲜样品,每层每个点设置5 组重复。将采集的鲜土样取一小部分进行烘干,用于测定土壤物理成分。剩余的鲜土样分为2 部分:一部分保存于4 ℃冰箱用于测定土壤脲酶(S-UE)、土壤蔗糖酶(S-INV)、土壤脂肪酶(S-LPS)、土壤酸性磷酸酶(S-ACP)、土壤蛋白酶(S-ACPT)、土壤过氧化氢酶(S-CAT);另一部分自然风干,研磨、过筛后用于测定土壤pH 值、有机质、有机碳、水解氮、有效磷、速效钾、全氮、全磷、全钾。
2.2 测定项目与方法
土壤酶活性测定依据关松荫[16]的《土壤酶及其研究法》;土壤化学性质的测定指标和方法见表1。各指标测定均重复3 次,取平均值。

表1 试验测定的土壤化学性质指标与测定方法Tab.1 Soil chemical property indexes determined in the test and determination methods
2.3 数据统计与分析
试验数据采用Excel-2003 进行整理汇总,并进行预处理;使用SPSS25 统计软件对甜龙竹土壤理化指标、土壤酶活性做单因素方差分析和土壤酶活性与土壤理化性质的相关性分析(Pearson),使用R 语言进行制图。结果用平均值±标准差表示。
3 结果与分析
3.1 甜龙竹不同栽培模式下的土壤酶活性
3.1.1 土壤脲酶活性
S-UE 作为土壤中转化物质与能量的重要氧化还原酶之一,对促进土壤中尿素水解为氨有重要作用[17],可在一定程度上反映土壤微生物在氧化过程中的强弱变化[18]。由图1 可知,5 种甜龙竹种植模式在0~20、20~40、40~60 cm 土层深度下S-UE 活性,分别表现为:ZS>ZG>ZH>ZC>CK、ZS>ZG>ZC>ZH>CK、ZG>ZC>ZH>CK>ZS。对于不同栽培模式间的土壤S-UE 活性:0~20 cm 土层,CK 与ZC 差异不显著(P>0.05),与ZH、ZS、ZG 差异显著(P<0.05);20~40 cm 土层,CK 与ZH、ZS、ZG、ZC 差异显著 (P<0.05),ZH、ZS、ZG、ZC 间均呈显著差异(P<0.05);40~60 cm 土层,CK 与ZH、ZC、ZG 差异显著(P<0.05),与ZS 差异不显著(P>0.05)。与对照(CK) 模式下的土壤S-UE 活性相比,ZS、ZG、ZH、ZC 分别提高了0~14.67%、12.75%~15.54%、0.14%~11.44%、0~3.11%。表明栽培模式甜龙竹×核桃、甜龙竹×杉木、甜龙竹×古茶树、甜龙竹×果树均可以有效地提高土壤脲酶的活性,其中甜龙竹×杉木栽培模式下的土壤脲酶活性最高。

图1 甜龙竹不同栽培模式对土壤脲酶活性的影响Fig.1 Effects of different cultivation modes of D. brandisii on urease in soil
3.1.2 土壤蔗糖酶活性
S-INV 能促进土壤中果糖和葡萄糖的水解,对碳循环有重要作用,能更好地反映土壤肥力和微生物的活性[19]。由图2 可知,5 种甜龙竹种植模式在0~20、20~40、40~60 cm 土层深度下SINV 活性,分别表现为:ZG>CK>ZH>ZC>ZS、CK>ZH>ZC>ZG>ZS、CK>ZH>ZC>ZG>ZS。对于不同栽培模式间的土壤S-INV 活性:0~20、40~60 cm土层,CK 均与ZH、ZS、ZG、ZC 差异显著(P<0.05),ZH、ZS、ZG、ZC 间均呈显著差异(P<0.05);20~40 cm 土层,CK 与ZS、ZC、ZG 差异显著(P<0.05),与ZH 差异不显著(P>0.05),ZS、ZC、ZG 之间均无显著差异(P>0.05)。与对照(CK) 模式下的土壤S-INV 活性相比,ZS、ZH、ZC 分别降低了41.02%~23.2%、8.91%~1.96%、37.97%~ 9.11%,ZG 比CK 提高了-38.25%~0.21%。表明栽培模式甜龙竹×核桃、甜龙竹×杉木、甜龙竹×古茶树、甜龙竹×果树可以显著降低土壤蔗糖酶的活性,其中甜龙竹×杉木栽培模式下的土壤脲酶活性最低。

图2 甜龙竹不同栽培模式对土壤蔗糖酶活性的影响Fig.2 Effects of different cultivation modes of D. brandisii on invertase activity in soil
3.1.3 土壤脂肪酶活性
S-LPS 可以有效催化分解油脂类物质生成糖类。由图3 可知,5 种甜龙竹种植模式在0~20、20~40、40~60 cm 土层深度下S-LPS 活性,分别表现为:ZS>ZH>ZG>CK>ZC、ZS>ZH>CK>ZC>ZG、ZS>ZH>ZC>ZG>CK。对于不同栽培模式间的土壤S-LPS 活性:0~20、20~40、40~60 cm 土层,CK 均与ZH、ZS、ZG、ZC 差异显著 (P<0.05),ZH、ZS、ZG、ZC 间均呈显著差异(P<0.05)。与对照(CK) 模式下的土壤S-LPS 活性相比,ZS、ZG、ZH、ZC 分别增加了31.34%~54.92%、-24.77%~ 6.08%、12.47%~ 28%、-9.27%~18.92%。表明栽培模式甜龙竹×杉木、甜龙竹×核桃可以显著提高土壤脂肪酶的活性,其中甜龙竹×杉木栽培模式下的土壤脂肪酶活性最高。

图3 甜龙竹不同栽培模式对土壤脂肪酶酶活性的影响Fig.3 Effects of different cultivation modes of D. brandisii on lipase activity in soil
3.1.4 土壤酸性磷酸酶活性
S-ACP 可以分解土壤中的有机磷底物并被植物吸收,是土壤中最活跃水解酶之一[20]。图4 可知,5 种甜龙竹种植模式在0~20、20~40、40~60 cm 土层深度下S-ACP 活性,分别表现为:ZC>ZS>ZH>CK>ZG、ZC>ZS>ZH>ZG>CK、ZC>ZG>ZS>CK>ZH。不同栽培模式间的土壤S-ACP 活性:0~20 cm 土层,CK 与ZH、ZS、ZG、ZC 差异显著(P<0.05),ZH 与ZG 差异不显著(P>0.05);20~40、40~60 cm 土层,CK 均与ZH、ZS、ZG、ZC 差异显著(P<0.05),ZH、ZS、ZG、ZC 间均呈显著差异(P<0.05)。与对照(CK) 模式下的土壤S-ACP 活性相比,ZS、ZG、ZH、ZC 分别增加了 9.62%~ 30.26%、-12.28%~ 46.82%、-8.36%~24.68%、17.40%~103.12%。表明栽培模式甜龙竹×杉木、甜龙竹×古茶树可以显著提高土壤酸性磷酸酶的活性,其中甜龙竹×古茶树栽培模式下的土壤酸性磷酸酶活性最高。

图4 甜龙竹不同栽培模式对土壤酸性磷酸酶酶活性的影响Fig.4 Effects of different cultivation modes of D. brandisii on acid phosphatase activity in soil
3.1.5 土壤蛋白酶活性
S-ACPT 作为评价土壤肥力和微生物活力的重要指标之一,可以分解土壤中的蛋白质,将土壤中的有机化合物转化为水解物[21]。图5 可知,5种甜龙竹种植模式在0~20 cm 土层深度下S-ACP活性表现为ZH>CK>ZG>ZS>ZC,在20~40、40~60 cm 土层深度下均表现为ZH>ZS>ZG>CK>ZC。不同栽培模式间的土壤S-ACPT 活性:0~ 20、20~40 cm 土层,CK 均与ZH、ZS、ZG、ZC 差异显著(P<0.05),ZH、ZS、ZG、ZC 间均呈显著差异(P<0.05);40~60 cm 土层,CK 均与ZH、ZS、ZG、ZC 差异显著(P<0.05),ZS 与ZG 差异不显著(P>0.05)。与对照(CK) 模式下的土壤S-ACPT 活性相比,ZS、ZG、ZH 分别增加了-0.65%~14.41%、-0.43%~15.54%、0.96%~15.87%、ZC 比CK 降低了22.36%~65.26%。表明甜龙竹×核桃栽培模式显著提高了土壤蛋白酶的活性,甜龙竹×古茶树栽培模式显著降低了土壤蛋白酶的活性。

图5 甜龙竹不同栽培模式对土壤蛋白酶酶活性的影响Fig.5 Effects of different cultivation modes of D. brandisii on protease activity in soil
3.1.6 土壤过氧化氢酶活性
S-CAT 与土壤微生物活性程度和土壤呼吸强度有着紧密的联系,能一定程度说明土壤微生物的活力[22]。由图5 可知,5 种甜龙竹种植模式在0~20、20~40、40~60 cm 土层深度下S-CAT 活性,分别表现为:ZG>CK>ZC>ZH>ZS、ZG>ZC>ZH>CK>ZS、ZG>ZC>ZS>CK>ZH。对于不同栽培模式间的土壤S-CAT 活性:0~20、40~60 cm 土层,CK 均与ZH、ZS、ZG、ZC 差异显著 (P<0.05),ZH、ZS、ZG、ZC 间均呈显著差异(P<0.05);20~40 cm 土层,CK 与ZS、ZC、ZG 间均呈显著差异(P<0.05),与ZH 差异不显著(P<0.05)。与对照(CK) 模式下的土壤S-CAT 活性相比,ZS、ZG、ZC 分别增加了-2.63%~1.47%、0.26%~12.49%、-1.17%~9.18%,ZH 减少了0~2.04%。表明甜龙竹×果树栽培模式显著提高了土壤过氧化氢酶的活性,甜龙竹×核桃栽培模式显著降低了土壤过氧化氢酶的活性。
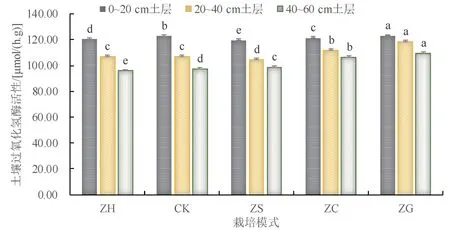
图6 甜龙竹不同栽培模式对土壤过氧化氢酶酶活性的影响Fig.6 Effects of different cultivation modes of D. brandisii on catalase activity in soil
3.2 甜龙竹不同栽培模式下土壤酶活性与土壤理化性质的相关性
甜龙竹不同栽培模式下的土壤酶活性与土壤化学性质的相关性如图7 所示。S-LPS、S-ACP 与有机碳、速效钾、水解氮、有机质、全氮均呈现极显著正相关关系(P<0.01),S-LPS 与pH 值、全钾、有效磷、全磷呈负相关,全钾与S-ACP 呈现显著负相关(P<0.05);S-UE、S-CAT 与有机碳、速效钾、全磷、水解氮、有机质、全氮均呈现极显著正相关关系(P<0.01),S-UE 与有效磷呈现显著正相关(P<0.05),S-CAT 与全磷呈现极显著正相关关系(P<0.01);S-INV 与有机碳、速效钾均呈现极显著正相关关系(P<0.01),与全钾呈现极显著负相关关系(P<0.01),有机碳与S-ACPT 呈极显著正相关关系(P<0.01)。

图7 土壤酶活性与土壤理化性质的相关关系Fig.7 Correlation between soil enzyme activity and soil physicochemical properties
4 讨论和结论
土壤酶活性是催化土壤生化反应的蛋白酶,也可以表达土壤中营养物质转化以及生物活性的变化,同时还可以作为衡量土壤养分和肥力的指标,是良好土壤环境的重要生物活性指标之一[23]。本研究发现,甜龙竹不同栽培模式、不同土层对土壤酶活性的影响显著。土壤脲酶对促进土壤中尿素水解为氨有重要作用[17,24],过氧化氢酶与土壤微生物活性程度和土壤呼吸强度有着紧密的联系,它可以体现土壤的抗性[22,25-26],甜龙竹×果树栽培模式下土壤脲酶和过氧化氢酶活性最高,说明在该模式下可以将较多的土壤养分转化到甜龙竹体内。土壤蔗糖酶可以促进土壤中果糖和葡萄糖的水解[19],提高土壤中的一部分可溶性物质的产生[26]。在甜龙竹×西南桦(CK) 栽培模式下土壤蔗糖酶最高,说明该模式可以改善土壤中的养分循环。土壤脂肪酶有效地催化分解油脂类物质生成糖类,在甜龙竹×杉木栽培模式下土壤脂肪酶最高,说明该模式可以有效地提高土壤的生物活性。土壤酸性磷酸酶作为做活跃的酶,可以反映有效磷的吸收程度[20,27],在甜龙竹×古茶树栽培模式下土壤酸性磷酸酶最高,说明该模式可以聚集更多的磷生物。土壤蛋白酶可以分解土壤中的蛋白质,将土壤中的有机化合物转化为水解物,在甜龙竹×核桃栽培模式下土壤蛋白酶最高,说明该模式可以为植物生长提供更多的氮源[21]。不同栽培模式对甜龙竹土壤酶活性的影响排序为:ZS>ZH>ZG>CK>ZC,由此可见,甜龙竹×杉木、甜龙竹×核桃、甜龙竹×果树栽培模式都可以在一定程度上提高土壤的酶活性,促进土壤生物活力。
5 种栽培模式的土壤酶活性都存在0~20 cm>20~40 cm>40~60 cm。这表明,土壤酶活性随着土层深度的增加逐渐呈下降趋势,这与黄懿梅等[23,28]的研究结果一致,说明表层土的微生物生物量聚集的最多,能释放出较多的酶。
土壤酶活性与土壤化学性质存在较多的显著和极显著相关关系,可能是由于不同的栽培模式产生的凋落物和根系的共生关系,在一定程度上改变了土壤的养分,使土壤中的微生物活性改变,释放出的酶产生变化,这与巫文香[29]研究认为的改变凋落物的数量和质量,可进一步影响土壤的酶活性以及碳代谢功能的变化结果一致。由此可知,造成甜龙竹在不同栽培模式下竹林土壤酶活性与土壤化学性质相关、差异的原因可能是,由于种植树种的不同,不同高度、根系、对生长环境的需要在一定程度上影响了土壤pH 值,从而影响了土壤酶活性,继而影响土壤的化学性质。
本研究结果表明,在营造甜龙竹林时,选择与杉木共同栽植可以在一定程度上提高土壤中的酶活性,其中对土壤脂肪酶活性的提高最为明显。


