毛竹内生拮抗细菌对食用菌病害的生防机理研究
袁宗胜



摘要 研究了毛竹內生拮抗细菌JL-B05和JL-B16对3种食用菌病原菌的生防机理。结果表明,不同浓度内生拮抗细菌过滤液和灭菌液对病原菌菌丝生长均具有显著的抑制效果,其中浓度为20%的内生拮抗细菌JL-B05过滤液对病原菌菌丝生长的抑制效果最好,对疣孢病菌的抑制率达86.37%,对油疤病菌的抑制率为78.81%,对蛛网病菌的抑制率为76.76%,抑制效果均优于内生拮抗细菌JL-B16过滤液。浓度为20%的内生拮抗细菌JL-B16灭菌液对油疤病菌菌丝生长的抑制率为72.11%,对疣孢病菌抑制率为62.51%,对蛛网病菌的抑制率为61.88%,抑制效果均优于内生拮抗细菌JL-B05灭菌液。在内生拮抗细菌发酵液和灭菌液对病原菌孢子萌发抑制效果测定中,浓度为40%内生拮抗细菌JL-B05、JL-B16过滤液和灭菌液对3个病原菌的抑制效果均较为显著。内生细菌JL-B05、JL-B16挥发性物质对病原菌菌丝生长均表现出一定的抑制作用。
关键词 毛竹;内生拮抗细菌;食用菌病害;生防机理
中图分类号 S 476 文献标识码 A 文章编号 0517-6611(2022)08-0126-03
doi:10.3969/j.issn.0517-6611.2022.08.034
开放科学(资源服务)标识码(OSID):
The Biological Control Mechanism of Endophytic Antagonistic Bacteria in Phyllostachys edulis on Edible Fungi Diseases
YUAN Zong-sheng
(Institute of Oceanography, Minjiang University, Fuzhou, Fujian 350108)
Abstract The biological control mechanism of endophytic antagonistic bacteria JL-B05 and JL-B16 against three edible fungus pathogens was studied. The results showed that different concentrations of endophytic antagonistic bacterial filtration solution and sterilized solution had significant inhibitory effect on the growth of pathogenic mycelia, among which the 20% endophytic antagonistic bacteria JL-B05 filtration solution had the best inhibitory effect on the growth of pathogenic mycelia, the inhibition rate of Mycogone perniciosa was 86.37%, the inhibition rate of Scytalidium lignicola was 78.81%, the inhibition rate of Cladobotryum semicirculare was 76.76%, and the overall inhibition effect was better than that of endophyte JL-B16 filtration solution. The inhibition rate of endophytic antagonistic bacteria JL-B16 sterilized solution with concentration of 20% on mycelial growth of Scytalidium lignicola was 72.11%,62.51% on Mycogone perniciosa and 61.88% on Cladobotryum semicirculare, and the overall effect was better than that of endophytic antagonistic bacteria JL-B05 sterilized solution. In the determination of the inhibitory effect of endophytic antagonistic bacterial filtration solution and sterilized solution on the spore germination of pathogenic bacteria, the concentration of 40% endophytic antagonistic bacteria JL-B05, JL-B16 filter solution and sterilized solution on the three pathogens was more significant. Endophytic bacteria JL-B05, JL-B16 volatile substances also showed a certain inhibition on the growth of pathogenic mycelia.
Key words Phyllostachys edulis;Endophytic antagonistic bacteria;Edible fungi disease;Biological control mechanism
植物内生细菌指其生活史的一定阶段或全部阶段均生活在健康植物的各种组织和器官内部,并与植物建立了和谐联合关系的细菌 [1]。植物内生菌能够引起广泛关注主要是由于它能够产生多种多样的具有农药活性的次生代谢产物 [2],在自然界中具有重要的生态学作用。内生细菌通过自身产生代谢产物或借助信号转导对宿主植物生长发育产生重要影响,主要在促进宿主植物生长、增强宿主植物抗性及提高植物修复能力等方面 [3-7],如Microbacterium具有促进植物生长的作用 [8],Bacillus具有良好的生防潜力 [9],Sphingomonas具有植物自我修复功能 [10]等。内生菌对植物病害的防病机理主要是通过几个方面:一产生抗生素类物质,在低浓度下可以对微生物产生影响 [11];二产生水解酶,可降解某些致病因子 [12];三产生生长调节剂 [13],内生菌也可以产生植物生物激素类物质促进植物生长;四内生菌与病原菌竞争营养物质,使病原菌得不到必要的营养供给而死亡以及增强宿主植物的抵抗力以及诱导植物产生系统抗性等途径抑制病原菌的生长 [14]。
我国食用菌产业在近30年发展迅速,但在食用菌生产栽培过程中,常受到害虫和病菌的危害,据不完全统计,由于病虫的危害导致减产10%~30%,严重的情况下甚至会颗粒无收 [15]。防治病虫害最常见的方法是化学药剂,但长时间使用单一的化学药剂会使得病虫害的抗性增强,防治效果下降,而且药品的残留量会对身体健康造成威胁,也会导致严重的环境污染,生物防治则具有许多优点,因此近几年受到了世界各地的普遍重视 [16]。国内外研究者在内生菌对于防治植物病害方面进行了大量研究,也取得了非常显著的效果。但内生菌在食用菌病害防治方面研究较少,因此,笔者选取对主要食用菌病原菌(疣孢病菌、蛛网病菌、油疤病菌)具有较好拮抗效果的内生细菌菌株JL-B05、JL-B16,研究其对食用菌病害的生防机理,将对食用菌病害的生物防治及促进食用菌产业的良性发展具有重要意义。
1 材料与方法
1.1 试验菌株
1.1.1 内生拮抗细菌。内生细菌菌株JL-B05、JL-B16,由笔者所在实验室从毛竹竹鞭中分离并筛选出对食用菌主要病原菌具有较好拮抗效果的内生细菌。
1.1.2 食用菌病原菌。疣孢病菌,疣孢霉(Mycogone perniciosa);蛛网病菌,葡枝霉(Cladobotryum semicirculare);油疤病菌,木棲柱孢霉(Scytalidium lignicola)。
1.2 培养基及主要试剂
内生细菌培养采用NA培养基:牛肉膏3 g,蛋白胨5 g,NaCl 5 g,琼脂18 g,水1 000 mL,pH 7.0~7.2(液体培养基则不加琼脂)。
LB液体培养基,主要成分是酵母粉、氯化钠、胰蛋白胨;PDA培养基:马铃薯200 g、琼脂粉20 g、葡萄糖20 g。
所用试剂均为国产分析纯。
1.3 内生拮抗细菌发酵过滤液和发酵灭菌液的制备
1.3.1 内生拮抗细菌发酵过滤液的制备。
取供试内生拮抗细菌JL-B05、JL-B16,分别用无菌接种环挑取单菌落,接种于装液量为 100 mL 的LB液体培养基三角瓶中,在28 ℃、180 r/min的条件下培养3 d,通过离心(4 ℃,10 000 r/ min,15 min)取得上清液,在无菌条件下,经 0.22 μm 微孔滤膜过滤后所得滤液,即为内生拮抗细菌发酵过滤液。
1.3.2 内生拮抗细菌发酵灭菌液的制备。
取供试内生拮抗细菌JL-B05、JL-B16,分别用无菌接种环挑取单菌落,接种于装液量为 100 mL 的LB液体培养基的三角瓶中,在28 ℃、180 r/min的条件下培养3 d,放入高压灭菌锅,121 ℃条件下灭菌30 min,即为内生拮抗细菌发酵灭菌液。
1.4 内生拮抗细菌的生防机理
1.4.1 内生拮抗细菌发酵过滤液对病原菌菌丝生长的影响。
采用菌落生长法测定内生拮抗细菌过滤液的抑菌活性,将上述内生拮抗细菌过滤液与PDA培养基混合制成混合平板(浓度分别为5%、10%、15%、20%),以不加过滤液的PDA平板为对照。分别在平板中央接入病原菌菌原片,每个处理3次重复,置于28 ℃恒温培养,然后观察病原菌的菌丝生长状况,待对照CK满板时采用十字交叉法测量菌丝直径。
采用下列公式计算抑制率:
相对抑制率=(对照菌落直径-处理菌落直径)/对照菌落直径×100%
1.4.2 内生拮抗细菌发酵灭菌液对病原菌菌丝生长的影响。
采用菌落生长法测定内生拮抗细菌灭菌液的抑菌活性,将上述内生拮抗细菌灭菌液与PDA培养基混合制成混合平板(浓度分别为5%、10%、15%、20%),以不加灭菌液的PDA平板为对照。分别在平板中央接入病原菌菌原片,每个处理3次重复,置于28 ℃恒温培养,然后观察病原菌的菌丝生长状况,待对照CK满板时采用十字交叉法测量菌丝直径。
采用下列公式计算抑制率:
相对抑制率=(对照菌落直径-处理菌落直径)/对照菌落直径×100%
1.4.3 内生拮抗细菌发酵过滤液对病原菌孢子萌发的影响。
取上述内生拮抗细菌JL-B05、JL-B16过滤液,将过滤液按照20%、40%这2个比例与PDA培养基混合,分别制成混合培养基平板。在生长成熟的3个病原菌的培养皿中加入无菌水,收集病原菌孢子,制成孢子悬浮液。然后用移液枪将孢子悬浮液加入上述混合培养基平板上,用涂布棒均匀涂抹。每个处理3次重复,置于28 ℃恒温培养,然后观察病原菌的孢子萌发状况。
采用下列公式计算抑制率:
相对抑制率=(对照菌落直径-处理菌落直径)/对照菌落直径×100%
1.4.4 内生拮抗细菌发酵灭菌液对病原菌孢子萌发的影响。
取上述内生拮抗细菌JL-B05、JL-B16灭菌液,将灭菌液按照20%、40%这2个比例与PDA培养基混合,分别制成混合培養基平板。在生长成熟的3个病原菌的培养皿中加入无菌水,收集病原菌孢子,制成孢子悬浮液。然后用移液枪将孢子悬浮液加入上述混合培养基平板上,用涂布棒均匀涂抹。每个处理3次重复,置于28 ℃恒温培养,然后观察病原菌的孢子萌发状况。
采用下列公式计算抑制率:
相对抑制率=(对照菌落直径-处理菌落直径)/对照菌落直径×100%
1.4.5 内生拮抗细菌挥发性物质对病原菌菌丝生长的影响。
将3个病原菌菌株(疣孢病菌、蛛网病菌、油疤病菌)和内生拮抗细菌菌株JL-B05、JL-B16分别转接到不同的PDA平板上,并分别在适宜的温度条件下培养2 d后在无菌条件下,去掉平板盖,将接有病原菌的培养皿相对扣合,并用封口膜沿边缘封口,防止挥发性物质漏出。以不接内生拮抗细菌的作为对照,置于28 ℃恒温培养,每个处理3个重复。观察病原菌的菌丝生长情况并计算抑菌率。
采用下列公式计算抑制率:
相对抑制率=(对照菌落直径-处理菌落直径)/对照菌落直径×100%
1.5 数据统计与分析
数据统计绘图用Excel,数据统计分析采用 DPS(V7.05)的相应分析功能进行。
2 结果与分析
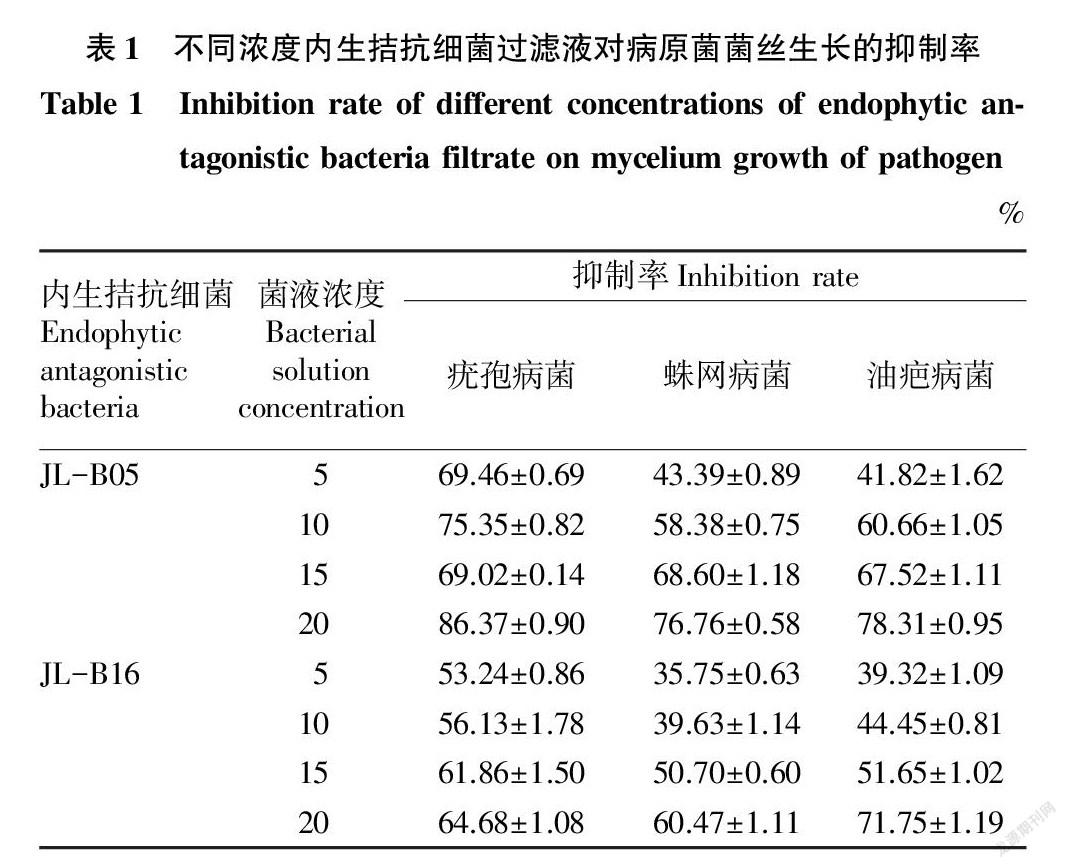
2.1 内生拮抗细菌发酵过滤液对病原菌菌丝生长的抑制效果
通过对病原菌菌丝生长情况进行观察,统计不同种不同比例内生菌过滤液对病原菌的抑制率,结果见表1。从表1可以看出,内生拮抗细菌JL-B05对疣孢病菌的抑制效果最好,且效果最佳菌液浓度为20%。菌液浓度为20%内生拮抗细菌JL-B16对油疤病菌原菌的抑制效果最好。
2.2 内生拮抗细菌发酵灭菌液对病原菌菌丝生长的抑制效果
通过对病原菌菌丝生长情况进行观察,统计不同种不同比例内生菌灭菌液对病原菌的抑制率,结果见表2。从表2可以看出,浓度为20%的内生拮抗细菌JL-B05灭菌液对病原菌的抑制效果最佳,其中浓度为20%内生拮抗细菌JL-B05和JL-B16灭菌液均对油疤病菌表现出较好的抑制效果,其次是疣孢病菌、蛛网病菌。
2.3 内生拮抗细菌发酵过滤液对病原菌孢子萌发的抑制效果
通过对病原菌孢子萌发生长情况进行观察,统计不同种内生菌过滤液对病原菌的抑制率,结果见表3。从表3可以看出,内生拮抗细菌JL-B05过滤液对病原菌的抑制效果较好,浓度为40%的内生拮抗细菌JL-B05和JL-B16对于3个病原菌都很理想,都能较好地抑制孢子的萌发。
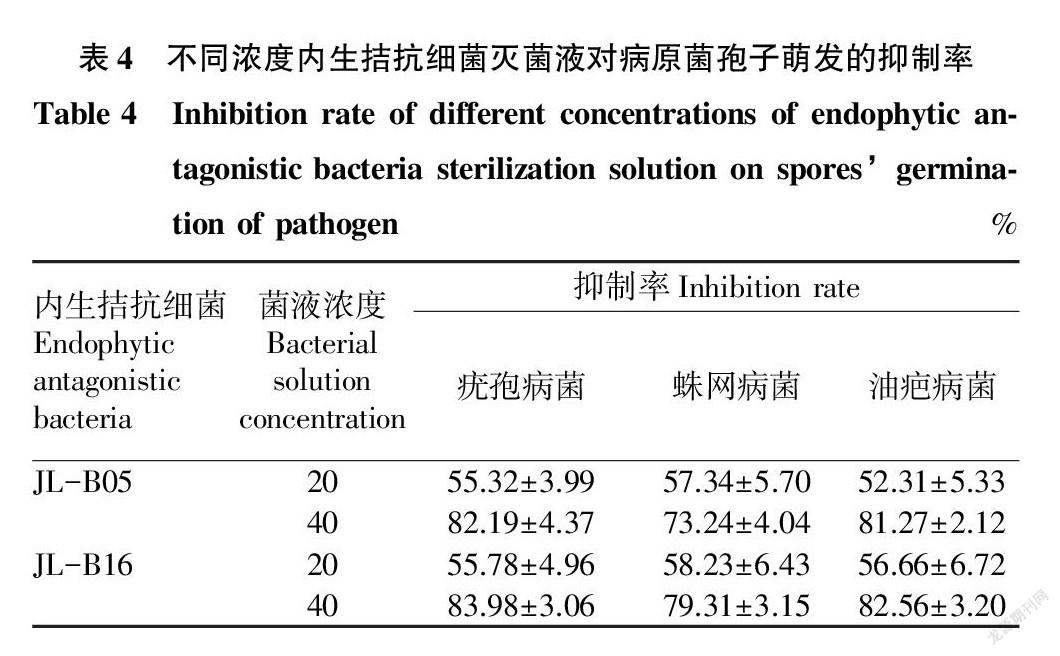
2.4 内生拮抗细菌发酵灭菌液对病原菌孢子萌发的抑制效果
通过对病原菌孢子萌发生长情况进行观察,统计不同种内生菌灭菌液对病原菌孢子萌发的抑制效果,结果见表4。从表4可以看出,浓度为40%内生拮抗细菌JL-B05和JL-B16发酵灭菌液对病原菌的抑制效果较好。浓度为40%的内生拮抗细菌JL-B16发酵灭菌液对病原菌的抑制效果较好,对疣孢病菌和油疤病菌的抑制效果最佳。
2.5 内生拮抗细菌挥发性物质对病原菌菌丝生长的抑制效果
通过观察病原菌与内生拮抗细菌对密封培养皿中病原菌的菌丝生长状况,结果表明,内生拮抗细菌挥发性物质对病原菌菌丝生长具有一定的抑制作用。从表5可以看出,内生拮抗细菌JL-B05和JL-B16的挥发性物质对于油疤病菌、蛛网病菌的抑制效果较好,对于疣孢病菌的抑制效果相对较弱。
3 结论与讨论
从内生拮抗细菌对3种食用菌病原菌的生防效果可以看出,不同浓度内生拮抗细菌过滤液和灭菌液对病原菌菌丝生长均具有一定的抑制效果。其中浓度为20%的内生拮抗细菌JL-B05过滤液对病原菌的抑制效果最好,对疣孢病菌的抑制率达86.37%,对油疤病菌的抑制率为78.31%,对蛛网病菌的抑制率为76.76%。浓度为20%的内生拮抗细菌JL-B16灭菌液对病原菌菌丝生长的抑制效果最好,对油疤病菌的抑制率达72.11%,对疣孢病菌的抑制效果为62.51%,对蛛网病菌的抑制率为61.88%。
不同浓度内生拮抗细菌过滤液和灭菌液对病原菌孢子萌发的测定中,浓度为40%内生拮抗细菌JL-B05、JL-B16对3个病原菌的抑制效果都非常明显。内生拮抗细菌挥发性物质对病原菌菌丝生长也表现出一定的抑制作用,对于疣孢病菌的整体抑制效果低于50%,JL-B16对于蛛网病菌和油疤病菌的抑制效果相对较好。从上述分析可以看出内生拮抗细菌JL-B05、JL-B16对3个病原菌菌丝生长和孢子萌发均表现出一定的抑制效果。
内生菌对植物病害的生物防治已研究多年并取得了很好的应用效果,何红等 [17]也证明分离自辣椒的内生芽孢杆菌对辣椒炭疽病菌有拮抗活性。用植物内生的枯草芽孢杆菌处理辣椒苗,然后再接种病原菌,能够将发病率降低81.49%~93.34%。内生菌的拮抗效果除实验室的抑菌效果测定外,还需要进行大田生产过程中的实际应用,以进一步验证内生菌的拮抗效果。研究表明植物内生细菌是一个很好的外源基因载体,利用分子生物技术构建工程内生细菌的研究工作在国内外已相继开展,快速发展,并取得许多成功的报道,如抗虫工程菌、防病工程菌、固氮工程菌等,这将是今后内生细菌的研究热点。
参考文献
[1] 胡桂萍,郑雪芳,尤民生,等.植物内生菌的研究进展[J].福建农业学报,2010,25(2):226-234.
[2] 施跃峰.试论生物农药产业及其在我国的发展策略[J].安徽农学通报,2004,10(4):40-41.
[3] 徐亚军.植物内生菌资源多样性研究进展[J].广东农业科学,2011,38(24):149-152.
[4] 国辉,毛志泉,刘训理.植物与微生物互作的研究进展[J].中国农学通报,2011,27(9):28-33.
[5] 盧镇岳,杨新芳,冯永君.植物内生细菌的分离、分类、定殖与应用[J].生命科学,2006,18(1):90-94.
[6] RYAN R P,GERMAINE K,FRANKS A,et al.Bacterial endophytes:Recent developments and applications[J].FEMS Microbiol Lett,2008,278(1):1-9.
[7] MELNICK R L,ZIDACK N K,BAILEY B A,et al.Bacterial endophytes:Bacillus spp.from annual crops as potential biological control agents of black pod rot of cacao[J].Biol Cont,2008,46(1):46-56.
[8] SHENG X F,XIA J J,JIANG C Y,et al.Characterization of heavy metalresistant endophytic bacteria from rape(Brassica napus)roots and their potential in promoting the growth and lead accumulation of rape[J].Environ Pollut,2008,156(3):1164-1170.
[9] BERG G,HALLMANN J.Control of plant pathogenic fungi with bacterial endophytes[M]//SCHULZ B J E,BOYLE C J C,SIEBER T N,et al.Microbial root endophytes.Berlin,Germany:Springer Verlag,2006:53-69.
[10] ULRICH K,ULRICH A,EWALD D.Diversity of endophytic bacterial communities in poplar grown under field conditions[J].FEMS Microbiol Ecol,2008,63(2):169-180.
[11] STURZ A V,CHRISTIE B R,MATHESON B G,et al.Endophytic bacterial communities in the periderm of potato tubers and their potential to improve resistance to soil-borne plant pathogens[J].Plant Pathol,1999,48(3):360-369.
[12] VELAZHAHAN R,SAMIYAPPAN R,VIDHYASEKARAN P.Relationship between antagonistic activities of Pseudomonas fluorescens isolates against Rhizoctonia solani and their production of lytic enzymes[J].Zeitschrift fur pflanzenkrankheiten und pflanzenschutz,1999,106(3):244-250.
[13] STURZ A V,CHRISTIE B R,NOWAK J.Bacterial endophytes:Potential role in developing sustainable systems of crop production[J].Crit Rev in Plant Sci,2000,19(1):1-30.
[14] 窦瑞木.3株植物内生细菌对番茄灰霉病的防治效果[J].河南农业科学,2010,39(4):77-78,97.
[15] 张超.华重楼拮抗内生细菌的筛选、鉴定及其拮抗物质的初步研究[D].成都:四川师范大学,2008.
[16] 王玉霞,李晶,张淑梅,等.芽孢杆菌对黄瓜根腐病的防治效果[J].生物技术,2004,14(3):57.
[17] 何红,邱思鑫,胡方平,等.植物内生细菌生物学作用研究进展[J].微生物学杂志,2004,24(3):40-45.

