水电离的“过程量”与“结果量”深度辨析
湖北 陈功健
水是最常见的溶剂,而对电解质溶液中水电离出的氢离子浓度的理解和认知,却是高中化学教与学的难点。尤其是部分模拟试题中对于水电离出的氢离子浓度的“指代不明”往往引起争议。本文试从水电离的“过程量”和“结果量”两个角度,分析在不同情况下,水电离出的氢离子浓度的“具体内涵”,以减少今后对此类问题的争议。
一、问题的提出
【案例一】在一次课堂教学过程中,笔者提问学生:25℃时,pH=5的NH4Cl溶液中,由水电离出的氢离子浓度为多少,大部分学生快速回答c水电离(H+)=1×10-5mol·L-1。此时有一个学生提出异议,表示根据水的离子积公式Kw=c(H+)·c(OH-),可计算出25℃时,pH=5的NH4Cl溶液中氢氧根离子的浓度为c(OH-)=1×10-9mol·L-1,且NH4Cl不会电离出氢氧根离子。而一个水分子电离过程中产生一个氢离子的同时必定产生一个氢氧根离子,即c水电离(H+)=c水电离(OH-),因此,由水电离产生的氢离子应为c水电离(H+)=1×10-9mol·L-1。笔者未立即评价该生的思考逻辑,而是交给全班学生来共同评价。有学生认为该生的逻辑没问题,表示支持;有学生认为该生的逻辑不正确,因为25℃时pH=5的NH4Cl溶液中水的电离平衡应该被促进的,故由水电离出的氢离子浓度c(H+)水电离>1×10-9mol·L-1,但找不到对方思考逻辑的错误。
【案例二】在某高中化学教师交流群中,总有教师提问,在25℃时,CH3COONH4溶液呈中性,水的电离过程是被促进,还是无影响。有的教师认为是促进,有的教师认为无影响,争议不休。

二、问题的分析
上述三个案例关于水的电离平衡是争议问题的经典代表,体现出高中化学教与学的过程中,教师与学生对水电离平衡中,电离出的氢离子浓度的问题的认知还不够清晰。究其原因,笔者认为是未能厘清水电离的“过程量”和“结果量”的缘故。“过程量”指水电离过程中产生的氢离子浓度;“结果量”指溶液中最终剩余的由水电离产生的氢离子浓度。

1.观点一:在酸或碱溶液中,水电离的“过程量”与“结果量”相同
以25℃时,pH=2的盐酸溶液为例。根据离子积公式Kw=c(H+)·c(OH-),即可算出pH=2的盐酸溶液中水电离出的氢氧根离子浓度为c水电离(OH-)=1×10-12mol·L-1。从水电离的“过程量”角度考虑,c水电离(H+)=c水电离(OH-)=1×10-12mol·L-1<1×10-7mol·L-1,水的电离过程被抑制;从水电离的“结果量”角度考虑,水电离出的氢离子浓度计算方法在2019版高中化学人教版选择性必修1《化学反应原理》对应的《教师教学用书》第82页中明确指出:“明确在一般情况下,酸或碱中水电离出的c(H+)或c(OH-)与酸电离出的c(H+)或碱电离出的c(OH-)相比比较小,可以忽略。”由此可见,在酸溶液中,离子积公式Kw=c酸(H+)·c水(OH-) 中并未体现出溶液中由水电离出的氢离子的浓度。此时,往往认为c水电离(H+)=c水电离(OH-)=1×10-12mol·L-1。
2.观点二:在含弱酸阴离子或弱碱阳离子的盐溶液中,水电离的“过程量”与“结果量”不相同

综合上述分析,由水电离出的氢氧根离子浓度“过程量”和“结果量”应满足如下大小关系:c过程量(OH-)≥c结果量(OH-);同理,c过程量(H+)≥c结果量(H+)。
由此可见,水电离出的氢离子浓度的“过程量”和“结果量”并不完全一致。而很多模拟卷试题中并未区分二者,这是产生很多争议性的问题的根本原因。例如案例一中,“25℃时,pH=5的NH4Cl溶液中,由水电离出的氢离子浓度为多少”,这样的文字表述令人很困惑,无法区分题干问的是水电离出氢离子浓度的“过程量”还是“结果量”。这样“不够严谨”的试题在高中化学各种资料书和模拟考试中常常出现。
【案例1】某地大型联考化学试卷中有这样一道题:25℃时,某浓度的盐酸、氯化铵溶液中由水电离出的c(H+)分别为1.0×10-amol·L-1、1.0×10-bmol·L-1,这两种溶液的pH之和为________(用a和b相应关系式表示)。
【剖析】本题给的参考答案为“14-a+b”。很显然,本题中水电离出的c(H+)“过程量”和“结果量”是相同的。命题人巧妙地回避了水电离出的c(OH-)“过程量”和“结果量”是不一致的情况,避免了争议。
【案例2】某地大型联考化学试卷中有这样一道题引起了争议:25℃时,某物质的溶液中,由水电离出的c(H+)=1×10-amol·L-1,下列说法不正确的是
( )
A.a<7时,水的电离受到抑制
B.a>7时,水的电离受到抑制
C.a<7时,溶液的pH不一定为a
D.a>7时,溶液的pH可能为a或14-a
【剖析】本题给的参考答案为“A”。这道题引起了极大的争议。根据上述“观点一”在酸或碱溶液中,水电离的“过程量”与“结果量”相同。而酸或碱抑制水的电离过程,即水电离出的氢离子浓度c(H+)过程量=c(H+)结果量<1×10-7mol·L-1。本题中若该溶液若是酸或碱溶液,则a>7。但a>7时,该溶液是否一定是酸或碱溶液,这引起老师们的讨论。为讨论方便,不妨令a=9。若该溶液为pH=9的CH3COONa溶液,因为CH3COO-结合H+促进水的电离平衡,导致CH3COONa溶液中剩余的由水电离产生的氢离子浓度为c(H+)结果量=1×10-9mol·L-1。若题干中“由水电离出的c(H+)=1×10-amol·L-1”指的是结果量,a>7时,该溶液可能是酸或碱溶液,还可能是CH3COONa这样的盐溶液。故a>7时,该溶液中的水的电离可能被抑制或被促进。如此思考,则B选项也是不正确的。
产生上述争议的根本原因是题干中“由水电离出的c(H+)=1×10-amol·L-1”并未指明是水电离过程产生的总的氢离子浓度c过程量(H+),还是指由水电离的剩余的氢离子浓度c结果量(H+)。笔者建议出题者应明确指明“水电离出的氢离子浓度”具体指“过程量”还是“结果量”,以减少不必要的争议。例如2007年浙江省高中化学竞赛试题(A组)第16题对这个问题进行了科学严谨地表述,避免考生产生理解混乱。
【例1】25℃时,某溶液中由水电离出来的并游离存在溶液中的c(H+)=1×10-amol·L-1,以下说法正确的是
( )
A.a>7时,此时溶液中水的电离一定是受到了抑制
B.a<7时,此时溶液中水的电离一定是受到了促进
C.a>7时,此溶液的pH为a或14-a
D.a<7时,此溶液的pH为a或14-a
【参考答案】BC
本题在描述水电离出的氢离子浓度时,特别补充了“游离存在溶液中”几个字,明确指出本题中指的是水电离出的氢离子浓度的“结果量”c结果量(H+)。这样处理非常直截了当的告诉考生,此处水电离出的氢离子浓度按“结果量”考虑,不必纠结。
【例2】(2008·上海卷·11)常温下,某溶液中由水电离的c(H+)=1×10-13mol·L-1,该溶液可能是
( )
①二氧化硫 ②氯化铵水溶液 ③硝酸钠水溶液 ④氢氧化钠水溶液
A.①④ B.①② C.②③ D.③④
【参考答案】A
本题“①二氧化硫”引起了争议,有人认为二氧化硫通入水与水的电离出的OH-反应,促进了水的电离平衡右移。从水的电离“过程量”考虑,水电离出的氢离子浓度应该为c过程量(H+)大于1×10-7mol·L-1,从而得出本题答案仅有“④氢氧化钠水溶液”符合。若从水的电离“结果量”考虑,本题“①二氧化硫④氢氧化钠水溶液”才符合题意。即2008年上海卷第11题默认考查由水电离出的氢离子浓度为本文中的“结果量”。
3.观点三:讨论水的电离过程被促进或被抑制时,应考虑水电离的“过程量”
在25℃时,CH3COONH4溶液呈中性,其对水的电离有什么影响?
从水电离的“结果量”角度考虑,25℃时,呈中性的CH3COONH4溶液c(H+)=1×10-7mol·L-1,看起来对水的电离平衡没产生任何影响,实际不然,讨论水的电离过程是被促进或被抑制时,应考虑水电离的“过程量”而非“结果量”。即往蒸馏水中加入CH3COONH4固体形成CH3COONH4溶液的过程,水电离出的氢离子浓度c水电离(H+)>1×10-7mol·L-1,即水的电离平衡被促进。相应地,在25℃时,从水的电离的“过程量”考虑,加入金属钠促进了水的电离,而不能从水的电离的“结果量”考虑生成了NaOH从而认为抑制了水的电离。
实际上,讨论水的电离是被促进或被抑制,都是指水的电离的“过程”被促进或被抑制,而非水的电离的“结果”。与此同时,应注意离子积公式Kw=c(H+)·c(OH-)中涉及水电离出的氢离子浓度c(H+)或氢氧根离子浓度c(OH-) 都是“结果量”而非“过程量”。对于某些情况下,水的电离的“结果量”等于“过程量”时,才可用离子积公式求算“过程量”。
4.观点四:命题应只考查水的电离的“过程量”与“结果量”一致的类型
(1)酸或碱溶液中水的电离的“过程量”与“结果量”一致,可用离子积公式Kw=c(H+)×c(OH-)算出水电离出的氢离子或氢氧根离子浓度,进而判断水的电离过程被抑制。
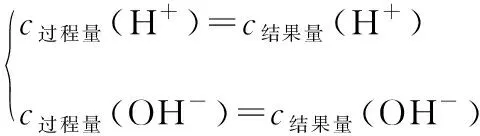
(2)“强酸弱碱盐”型溶液

(3)“强碱弱酸盐”型溶液
例如,25℃时,pH=9的CH3COONa溶液,水电离出的氢氧根离子浓度c过程量(OH-)=c结果量(OH-)=1×10-5mol·L-1。而水电离出的氢离子浓度c过程量(H+)=1×10-5mol·L-1,因CH3COO-结合H+,导致剩余的氢离子,即水电离出的氢离子浓度c结果量(H+)=1×10-9mol·L-1。可见,25℃时,pH=9的CH3COONa溶液中水电离出的氢离子浓度的“过程量”和“结果量”不一致。考查CH3COONa溶液中水电离出的氢离子浓度,若无其他文字表明题干指的是“过程量”还是“结果量”,这会给考生造成认知“困惑”,题目本身也会引起不必要的争议。因此,考查CH3COONa这样的“强碱弱酸盐”型溶液,若无特别说明,应只考查水电离出的氢氧根离子浓度。
(4)“CH3COONH4”型溶液
由于“弱酸弱碱盐”型溶液情况较为复杂,故本文只单独列出呈中性的CH3COONH4溶液。

5.观点五:溶液中水电离出的氢离子浓度不应成为学习的重点和难点
笔者查阅2010—2021年全国卷化学试题,发现高考几乎不考查水电离出的氢离子浓度这类问题。《普通高中化学课程标准(2017年版2020年修订)》对于“水的电离”的考查要求在“主题3:水溶液中的离子反应与平衡”,其中也仅有“认识弱电解质在水溶液中存在电离平衡,了解电离平衡常数的含义。认识水的电离,了解水的离子积常数”的学习要求。2019版高中化学人教版选择性必修1《化学反应原理》的第三章《水溶液中的离子反应与平衡》的第二节《水的电离和溶液的pH》中未提及水电离出的氢离子或氢氧根离子浓度。2019版鲁科版选择性必修1《化学反应原理》的第三章《物质在水溶液中的行为》的第一节《水与水溶液》中提及了利用离子积常数计算溶液中c(H+)或c(OH-),并未提及由水电离出的氢离子或氢氧根离子浓度。高中国际班AP(Advanced Placement)化学教材《CHEMISTRY THE CENTRAL SCIENCE(第12版)》也仅仅提及了通过离子积常数计算溶液中c(H+)或c(OH-),并未强调溶液中的氢离子或氢氧根离子来自水的电离。从各种版本的教材编写逻辑上看,不过分强调水电离出的氢离子浓度这类问题,也不会影响学生对水溶液中离子平衡的基本规律的认知。溶液中水电离出的氢离子浓度或氢氧根离子浓度的计算并非本节内容的学习重点,更不应该成为学生学习水溶液中离子平衡的难点。

三、总结


