肌红蛋白血红素辅基氧化修饰对肌球蛋白功能特性及凝胶特性的影响
朱宏星,高田毅,黄 杨,王 鑫,葛庆丰,王道营,*,孙 冲,*
(1.江苏省农业科学院农产品加工研究所,江苏 南京 210014;2.扬州大学食品科学与工程学院,江苏 扬州 225127)
保水性是评价肉品品质的重要指标之一。肌球蛋白为盐溶性蛋白,是肌肉中重要的蛋白成分也是形成凝胶的主要成分,对肉品的保水性起决定性作用[1]。肌球蛋白的分子形态为一个杆状尾部和两个球状头部,为不对称结构,形如“Y”状,尾部主要由α-螺旋构成。在凝胶形成过程中肌球蛋白会发生变性,结构展开,蛋白聚合交联形成有序的凝胶网络结构。但是,凝胶形成过程极易受蛋白结构变化影响,因此肌球蛋白结构状态与凝胶的保水性密切相关[2]。近年来研究发现蛋白氧化也与肉品保水性相关[3]:适度氧化有利于蛋白凝胶形成稳定的三维凝胶网络,改善凝胶的功能特性,从而改善肉品质地,提高肉品保水性;蛋白的过度氧化则会形成不利的凝胶结构,降低肉品的品质。
肌红蛋白(myoglobin,Mb)是肉品的主要呈色物质,由血红素辅基和珠蛋白组成。血红素辅基与珠蛋白之间具有较强的亲合力,能够稳定Mb结构[4]。在肉品储藏与加工过程中,pH值、温度、内源酶等因素的变化都会对血红素辅基与珠蛋白的结合力产生影响,从而造成Mb构象改变,血红素辅基暴露甚至从Mb中脱落[5-9],脱落的血红素辅基会对肉品品质造成影响。血红素辅基是肉品中重要的促氧因子,能显著促进氧化的发生[10]。目前,关于血红素辅基功能特性的研究大都集中在血红素辅基对脂质的氧化作用,关于血红素辅基促脂质氧化的具体机理,通过如下过程发生:一方面,亚铁血红素自动氧化成高铁血红素,生成过氧羟自由基(HOO·)在其诱导脂质氧化过程中发挥重要作用[11-12];另一方面,血红素辅基释放后通过疏水作用力吸附在肌肉细胞的磷脂膜上,或者血红素辅基环上带正电荷的丙酸酯能通过静电作用吸附在带负电的磷脂头部从而参与氧化反应[13]。前期研究发现血红素辅基处理可以使肌球蛋白氧化,蛋白羰基含量上升,巯基交联形成二硫键,导致肌球蛋白结构发生改变[14]。目前针对血红素辅基对蛋白氧化的影响,进而与肉品品质关联性的研究尚未有深入报道。因此本实验探究血红素辅基氧化处理导致肌球蛋白结构的改变对肌球蛋白凝胶特性及保水性的影响,旨在为控制肉品氧化、改善肉品保水性提供一定的参考依据。
1 材料与方法
1.1 材料与试剂
三黄鸡购自江苏立华牧业股份公司;将鸡暗处静置过夜后杀鸡快速取出胸肉(胸大肌)用于提取肌球蛋白。
血红素辅基 美国Sigma公司;十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、尿素、β-巯基乙醇(均为分析纯) 国药集团化学试剂有限公司。
1.2 仪器与设备
FE20/FG2 pH计、AL电子天平 瑞士梅特勒-托利多集团;T-25型数显匀浆机 德国IKA公司;多功能酶标仪 美国BioTek仪器有限公司;Mini-PROTEAN Tetra Cell垂直电泳系统 美国Bio-Rad公司;JS-680C全自动凝胶成像分析仪 上海培清科技有限公司;UniCenMR台式冷冻离心机 德国Herolab公司;SCIENTZ-IID超声波细胞破碎仪 宁波新芝生物科技股份有限公司;NICOMP Z3000纳米粒度电位仪美国PSS公司;MCR302旋转流变仪 奥地利Anton Paar公司;TMS-TOUCH物性测定仪 美国FTC公司;MesoMR23-060H-1低场核磁共振成像与分析系统 苏州纽迈分析仪器股份有限公司。
1.3 方法
1.3.1 肌球蛋白的提取
参考Hayakawa等[15]的方法并略作改动。将新鲜鸡胸肉置于冰浴中快速降温,剔除筋膜和脂肪,切碎后与提取液A(0.5 mol/L KCl、0.1 mol/L KH2PO4、50 mmol/L K2HPO4、5 mmol/L EDTA-2Na、4 mmol/L焦磷酸钠,pH 6.5)以1∶3(g/mL)混合,5 000hg冰浴条件下匀浆5 s。将匀浆液在冰浴条件下进行超声处理,超声功率200 W,工作时间1 s,间隔时间3 s,超声时长10 min。将超声后并已搅拌20 min的匀浆液离心(4 ℃、5 000hg、10 min),用三层纱布过滤得上清液。用10 倍体积的预冷超纯水对滤液进行稀释,4 ℃条件下混匀静置4 h后去除上清液得沉降物。将沉降物离心(4 ℃、8 000hg、10 min)得沉淀,沉淀与提取液B(0.3 mol/L KCl、20 mmol/L K2HPO4、20 mmol/L KH2PO4,pH 7.0)以1∶3(g/mL)混匀20 min,再离心(4 ℃、10 000hg、20 min)得上清液。上清液加10 倍体积的预冷超纯水混匀,4 ℃静置过夜后离心(4 ℃、8 000hg、10 min)除上清液,收集沉淀,即为粗肌球蛋白。粗肌球蛋白与透析液(0.6 mol/L KCl、20 mmol/L K2HPO4、20 mmol/L KH2PO4,pH 7.5)以1∶3(g/mL)溶解并于透析袋(mw=10 kDa)中透析16 h,得到的溶液10 000hg离心20 min,上清液即为肌球蛋白溶液。用双缩脲法测定肌球蛋白的蛋白浓度。
提取的肌球蛋白的纯度通过SDS-聚丙烯酰胺凝胶电泳(SDS-polyacrylamide gel electrophoresis,SDSPAGE)系统测定。
1.3.2 血红素辅基的配制
准确称取血红素辅基粉末0.163 g,用30 mmol/L NaOH溶液配制成浓度为10 mmol/L储备液,避光保存[16]。用磷酸盐缓冲液(0.6 mol/L KCl、20 mmol/L K2HPO4、20 mmol/L KH2PO4,pH 7.5)将储备液稀释成浓度为0.4、1.0、1.5、3.0 mmol/L的血红素辅基溶液,4 ℃避光保存备用。
1.3.3 血红素辅基介导肌球蛋白氧化体系的构建
向肌球蛋白沉淀中等体积混合血红素辅基溶液(浓度分别为0、0.4、1.0、1.5、3.0 mmol/L),4 ℃避光条件下孵育16 h,将氧化后的肌球蛋白混合液用20 mmol/L的磷酸盐缓冲液(20 mmol/L K2HPO4、20 mmol/L KH2PO4,pH 7.5)进行稀释,4 ℃、10 000hg离心20 min得到不同氧化程度的肌球蛋白沉淀[17]。实验所需肌球蛋白浓度通过磷酸盐缓冲液(0.6 mol/L KCl、20 mmol/L K2HPO4、20 mmol/L KH2PO4,pH 7.5)调整。
1.3.4 血红素辅基氧化修饰肌球蛋白凝胶的制备
调整不同氧化程度的肌球蛋白样品质量浓度为35 mg/mL,称取相同体积蛋白样品置于小烧杯中,用聚乙烯(polyethylene,PE)保鲜膜封口。将装有蛋白样品的烧杯置于水浴锅内,20 ℃恒温20 min后,匀速升温至85 ℃(升温速率1.5 ℃/min),保温20 min。加热完成后,取出样品在室温条件下放置至常温,然后于4 ℃贮存过夜备用。每个处理组平行3次。
1.3.5 肌球蛋白溶解度及粒径的测定
根据Liu Ru等[18]的方法略作修改,确定肌球蛋白的溶解度。将5 mg/mL氧化肌球蛋白溶液在4 ℃、离心10 min,采用考马斯亮蓝法测定离心前后肌球蛋白的质量浓度,溶解度按下式计算:

使用纳米激光粒度分析仪测定肌球蛋白的粒径。调整肌球蛋白溶液质量浓度为0.5 mg/mL,检测3次后进行信息采集,每个样品平行采集3次,取平均图谱。
1.3.6 肌球蛋白乳化活性及乳化稳定性的测定
采用浊度法测定肌球蛋白的乳化性质[19]。调整肌球蛋白质量浓度为0.2 mg/mL,取4 mL置于离心管中,并加入1 mL大豆油,10 000hg均质1 min,立即从距离心管底5 mm处取匀浆液50 μL,加入到5 mL质量分数为0.1%的SDS溶液中,振荡混匀后于500 nm处测定吸光度记为A0;静置10 min后在相同的位置再次取匀浆液50 μL,加入到5 mL SDS溶液中,振荡混匀后测定吸光度记为A10。以0.1% SDS溶液为空白对照,乳化活性和乳化稳定性计算公式如下:

式中:A0、A10为乳状液在500 nm处第0、10分钟的吸光度;φ为乳化液的油体积分数(φ=0.2);C为乳化前的蛋白质量浓度/(g/mL)。
1.3.7 肌球蛋白流变特性
参考Diedericks等[20]的方法略作修改。取一定量的肌球蛋白溶液置于动态流变仪的载物台上,设置圆形平板与载物台间距为1 000 μm,并用液体石蜡封住样品。实验参数设置如下:振动频率0.1 Hz,应变力为2%,以2 ℃/min的升温速率从20 ℃加热到80 ℃。
1.3.8 肌球蛋白凝胶强度
取肌球蛋白凝胶样品置于质构仪载物台上,设置参数:应变力0.1 N,测试速率30 mm/min,形变量50%,穿刺距离10 mm,室温条件下测定[2]。
1.3.9 凝胶持水力(water-holding capacity,WHC)
采用离心法测定凝胶WHC[21]。将制备好的蛋白凝胶置于离心管后,4 ℃、10 000hg离心15 min,记录离心前后离心管的质量以及空离心管质量。计算公式如下:
总而言之,GPS系统具有数据测量的高效性、准确性和科学性,减少了工作流程中浪费的大量人力、财力、物力。现代科学技术的发展推动了GPS技术和地理信息系统的结合,二者的应用也为人们的工作和生活带来了极大的便利。在未来的日子里,研究人员还要不断完善GPS技术,为各行业提供准确有效的数据支持。

式中:m0为离心管的质量/g;m1为离心前离心管与凝胶的总质量/g;m2为离心后离心管与凝胶的总质量/g。
1.3.10 肌球蛋白凝胶低场核磁共振测定
采用低场核磁共振成像与分析系统对肌球蛋白凝胶进行测定以确定凝胶样品的横向弛豫时间(T2)[22]。将2 g样品放入圆柱形玻璃管(直径15 mm)中。参数设置如下:测量温度32 ℃,质子共振频率22.6 MHz,使用25 mm线圈,r值为200 μs,等待时间为4 000 ms,脉冲个数为15 000,两个峰值间隔为0.25 ms,扫描次数为16,反演迭代次数为100 000,采用CPMG序列进行测量,每组3次平行。
1.3.11 肌球蛋白凝胶分子间作用力的测定
根据Yang Xiaoyu等[23]的方法并作修改,通过不同溶剂破坏肌球蛋白凝胶形成过程中的分子作用力。NaCl溶液(0.6 mol/L)破坏离子键,低浓度尿素(1.5 mol/L)可破坏氢键,高浓度尿素(8 mol/L)可同时破坏氢键和疏水相互作用,而β-巯基乙醇(0.5 mol/L)会破坏二硫键。将样品分别溶解在以下溶剂中,以分析血红素辅基诱导的肌球蛋白凝胶形成过程中不同分子作用的贡献。选择的4种溶剂为S1:0.6 mol/L NaCl;S2:0.6 mol/L NaCl+1.5 mol/L尿素;S3:0.6 mol/L NaCl+8 mol/L尿素;S4:0.6 mol/L NaCl+8 mol/L尿素+0.5 mol/Lβ-巯基乙醇。将样品(0.5 g)溶解在5 mL的不同溶剂中,匀浆后离心(8 000hg、4 ℃、15 min)。采用考马斯亮蓝法测定上清液中的蛋白质量浓度。离子键、氢键、疏水作用和二硫键的贡献分别以S1、S2-S1、S3-S2、S4-S3的溶解度表示。
1.3.12 肌球蛋白凝胶微观结构的观察
参考Zheng Jiabao等[24]的方法用扫描电子显微镜在10 kV的扫描电压下观察肌球蛋白凝胶的微观结构。将同样大小的凝胶在液氮中快速冷冻,冷冻后的样品通过真空冷冻干燥机干燥,将样品截面朝上逐个粘贴在扫描电镜样品台上,表面喷金镀膜后于放大500 倍条件下观察肌球蛋白凝胶的微观结构。
1.4 数据统计分析
所得数据均为3次重复的平均值,结果表示为 fs。数据分析采用软件IBM SPSS Statistics 25.0,运用单因素(方差分析法)ANOVA-Tukey对数据进行单因素检验分析,P<0.05,差异显著,采用Origin 8.5软件作图。
2 结果与分析
2.1 血红素辅基对肌球蛋白溶解度及粒径的影响
在肉品加工中处于高度溶解状态的蛋白能表现出良好的保水性[25]。由图1A可知,0.2~0.5 mmol/L血红素辅基处理下,肌球蛋白溶解度基本无变化;血红素辅基浓度继续升高,肌球蛋白溶解度呈现下降趋势,当浓度提高至1.5 mmol/L,溶解度降低了28.13%。粒径大小可用来表明肌球蛋白的聚集程度。由图1B可知,肌球蛋白在添加血红素辅基后,肌球蛋白的粒径增大,血红素浓度增加至1.0~1.5 mmol/L后,肌球蛋白的粒径显著增大(P<0.05)。肌球蛋白溶解度与粒径结果表明适度的氧化导致肌球蛋白交联聚集,形成可溶性聚集体,肌球蛋白仍表现出良好的溶解状态,但其平均粒径有所增大。在高浓度氧化攻击下,蛋白发生过度氧化,蛋白分子交联聚集,大量不溶性的聚集体的形成降低了蛋白的溶解性并且导致了肌球蛋白平均粒径显著增大(P<0.05)[26]。

图1 血红素辅基浓度对肌球蛋白溶解度(A)和粒径(B)的影响Fig.1 Effect of hemin prosthetic group concentration on solubility (A) and particle size (B) of myosin
2.2 血红素辅基对肌球蛋白乳化活性及乳化稳定性的影响
乳化性可以通过乳化活性和乳化稳定性表达,乳化活性反映了蛋白在水油界面的吸附能力,乳化稳定性反映蛋白保持乳化体系中水油界面稳定状况的重要指标[27]。如图2所示,0.2~1.0 mmol/L血红素辅基处理的肌球蛋白溶液乳化活性差异不显著(P>0.05);当血红素辅基浓度在0.2~0.5 mmol/L之间时,肌球蛋白乳化稳定性有所提高;当血红素辅基浓度达1.5 mmol/L时,乳化活性与乳化稳定性显著降低(P<0.05)。肌球蛋白乳化特性结果表明低浓度血红素辅基对肌球蛋白氧化程度不高,肌球蛋白部分解折叠,疏水基团暴露有利于其在油滴表面形成稳定的蛋白膜[28],同时疏水氨基酸与亲水、亲油氨基酸暴露并相互影响,导致肌球蛋白乳化活性变化不显著(P>0.05)[29];高浓度血红素辅基处理下肌球蛋白过度氧化,变性程度加剧,分子交联形成大量不溶性的蛋白聚集体,蛋白分子稳定性降低,难以形成稳定的界膜,同时蛋白与脂肪间的交联能力降低,乳状液分层加快,表现出乳化活性和乳化稳定性的降低[30]。


图2 血红素辅基浓度对肌球蛋白乳化活性(A)和乳化稳定性(B)的影响Fig.2 Effect of hemin prosthetic group concentration on emulsifying activity (A) and emulsion stability of myosin (B)
2.3 血红素辅基对肌球蛋白凝胶流变学特性的影响
储能模量(G’)又称弹性模量,用来反映凝胶过程中的弹性部分,可以反映凝胶的质构及微观结构等性质。损耗模量(G’’)代表凝胶的黏度,一般与G’的变化趋势一致[31]。如图3所示,不同浓度血红素辅基处理后肌球蛋白G’和G’’的变化趋势相似,且G’值始终高于G’’值,表明肌球蛋白的弹性及凝胶状特性在黏弹性中占主导地位。未添加血红素辅基的肌球蛋白,其G’值在53 ℃和60 ℃有2个转变峰:53 ℃为肌球蛋白凝胶的形成期,此阶段主要是肌球蛋白分子头部的变性与聚合,随后蛋白尾部解折叠,温度升高使得低温凝胶网络被破坏,流动性增强,G’值降低,随着温度继续升高,肌球蛋白最终形成不可逆的凝胶网络结构[16]。添加适量的血红素辅基后(0.2~0.5 mmol/L),肌球蛋白第1个转变峰不明显,这可能是因为血红素辅基氧化导致肌球蛋白结构部分展开,从而削弱了肌球蛋白的头部聚集,使得肌球蛋白在加热初期的聚集模式由头部聚集为主转变为以尾部交联为主[32]。随后肌球蛋白G’值逐渐增大,原因主要是血红素辅基氧化进一步促进了肌球蛋白分子解折叠,巯基氧化形成二硫键,蛋白分子发生交联,最终形成了良好的网络凝胶结构;当血红素辅基浓度增加至1.5 mmol/L时,60 ℃峰几乎消失,曲线变得平缓,这主要是由于高添加量的血红素辅基造成肌球蛋白过度氧化变性,蛋白过度解折叠,疏水基团严重暴露,同时蛋白大量聚集,蛋白稳定性降低,不利于肌球蛋白加热后进一步交联形成有序的三维网状凝胶结构。
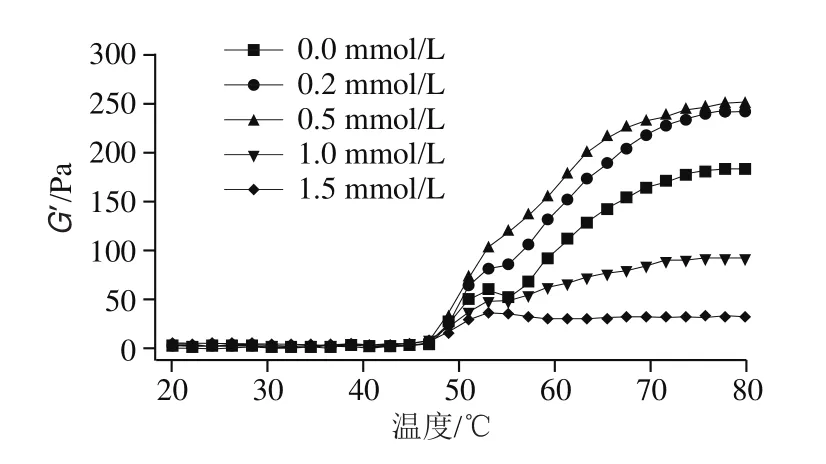

图3 血红素辅基浓度对肌球蛋白流变学特性的影响Fig.3 Effect of hemin prosthetic group concentration on rheological properties of myosin
2.4 血红素辅基对肌球蛋白凝胶强度的影响
通过热诱导作用形成肌球蛋白凝胶,其蛋白的凝胶特性与保水性有关[33]。由图4可知,随着氧化程度加深,肌球蛋白凝胶强度发生显著改变。低浓度血红素辅基(0.2~0.5 mmol/L)处理的蛋白凝胶,其凝胶强度较未处理组显著提高(P<0.05);而高浓度血红素辅基(1.5 mmol/L)氧化处理后,其凝胶强度显著下降(P<0.05)。肌球蛋白凝胶强度结果表明:低浓度血红素辅基对肌球蛋白凝胶的形成更为有利,这主要是由于适度氧化可以提高蛋白的溶解性,使蛋白结构伸展,分子交联形成可溶性聚合物,蛋白的凝胶特性得到改善,蛋白的凝胶网络结构强度得到提高。但过度氧化会使蛋白溶解度大大降低,由于蛋白的过度解旋,导致疏水基团的大量暴露,分子聚集形成不溶性聚合物,溶胀不充分,不利于凝胶体系的形成[33],这也与肌球蛋白流变学结果相符合。

图4 血红素辅基浓度对肌球蛋白凝胶强度的影响Fig.4 Effect of hemin prosthetic group concentration on gel strength of myosin gels
2.5 血红素辅基对肌球蛋白凝胶持水性的影响
如图5所示,添加0.2~0.5 mmol/L血红素辅基后,肌球蛋白凝胶的持水性提高了14.42%;当血红素添加量提高至1.0~1.5 mmol/L后,肌球蛋白凝胶WHC显著降低(P<0.05)。持水性的结果表明适度氧化能够增强肌球蛋白疏水相互作用,导致蛋白分子交联聚集形成可溶性聚集体,这一变化有助于加热过程中肌球蛋白尾部的有序聚集,形成规则的网络结构,提高肌球蛋白凝胶束缚水分的能力[34];高浓度血红素辅基的过度氧化则降低了肌球蛋白的溶解度,破坏了肌球蛋白的稳定结构,肌球蛋白发生变性并过度聚集形成大量不溶性的聚集体,不利于稳定的三维凝胶网络的形成,对水分的截留能力弱,水分流失严重,保水能力差。
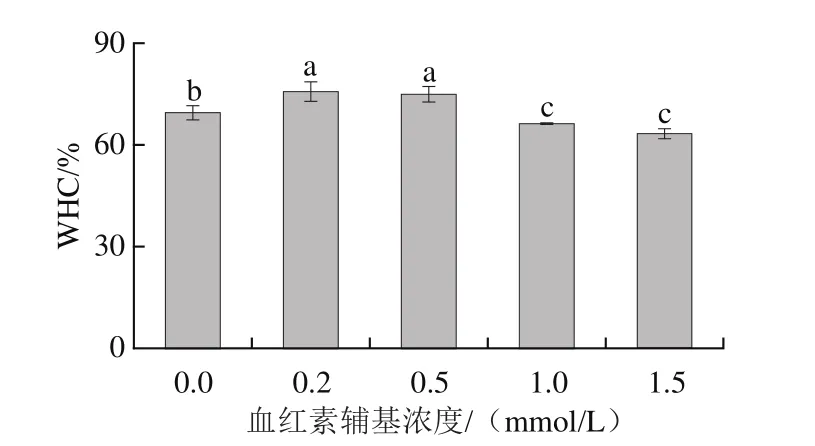
图5 血红素辅基浓度对肌球蛋白凝胶持水性的影响Fig.5 Effect of hemin prosthetic group concentration on water-holding capacity of myosin gels
2.6 血红素辅基对肌球蛋白凝胶水分分布的影响
如图6所示,肌球蛋白凝胶中4种状态水分的横向弛豫时间T2分别在0~5、8~30、147~534、1 417~3 765 ms之间,分别表示强结合水(T2b)、弱结合水(T21)、不易流动水(T22)和自由水(T23)[35]。其中T22信号最强,T23其次,表明肌球蛋白凝胶中的水分主要以不易流动水与自由水的形式存在。有关研究表明弛豫时间T2与凝胶中水分子的游离程度呈正相关,即弛豫时间越小,蛋白与水分子结合越紧密,水分自由度越低;反之弛豫时间越长,则水分与蛋白结合力越弱,水分越容易流失[36]。添加了血红素辅基的肌球蛋白,其T2弛豫时间和峰比例均发生了明显变化:0.2~0.5 mmol/L血红素辅基处理肌球蛋白凝胶后,T22和T23减小,不易流动水峰面积比例P22显著增高(P<0.05)、自由水峰面积比例P23显著降低(P<0.05);1.0~1.5 mmol/L血红素辅基处理后肌球蛋白凝胶T2提高,不易流动水峰面积比例P22显著降低(P<0.05),自由水峰面积比例P23显著增高(P<0.05)。这些结果说明了血红素辅基适度氧化导致肌球蛋白更多极性基团的暴露,水的亲和力增强,有助于肌球蛋白形成密集有序的三维凝胶网络结构,锁住更多的水分,降低凝胶中水分的流动性[37],血红素辅基高度氧化导致肌球蛋白结构过度展开,大量的疏水基团暴露出来,蛋白分子发生聚集,同时高度氧化导致肌球蛋白发生变性,稳定性降低,不利于有序稳定的凝胶网络结构的形成,自由水流动性增强,表现出凝胶持水率的降低。

图6 不同浓度血红素辅基对肌球蛋白凝胶水分分布的影响Fig.6 Effect of hemin prosthetic group concentration on moisture distribution of myosin gels
2.7 血红素辅基对肌球蛋白凝胶分子间相互作用的影响
凝胶的三维网状结构是蛋白与蛋白、蛋白与水分子之间二硫键、氢键和疏水相互作用达到平衡的结果[38]。凝胶中添加不同的变性剂,能够破坏维持凝胶稳定的分子间作用力,提高蛋白的溶解度。在热诱导肌球蛋白形成凝胶的过程中,热可以破坏维持蛋白高级结构的作用力,蛋白在变性再聚集过程中又形成了新的分子间作用力稳定凝胶结构[39]。由图7所示,维持肌球蛋白凝胶网络结构的主要作用力为疏水相互作用和二硫键,添加了0.2 mmol/L血红素辅基后,疏水相互作用和二硫键含量显著增加(P<0.05),当血红素辅基浓度提高至1.0 mmol/L后,蛋白凝胶中的疏水相互作用和二硫键含量开始降低。肌球蛋白凝胶分子间作用力的变化表明低浓度的血红素辅基氧化导致蛋白疏水基团与巯基部分暴露,疏水相互作用增强,游离巯基结合形成二硫键,此时蛋白开始聚集,肌球蛋白结构在加热前展开的程度更大,这有利于稳定的凝胶网络的形成。而过度氧化使蛋白变性过度,结构大量展开,蛋白分子间发生过度交联聚集,肌球蛋白在加热前已变形成大量的聚集体,这不利于热诱导过程中蛋白分子的交联,因此形成粗糙、无序、不稳定的三维网络结构。
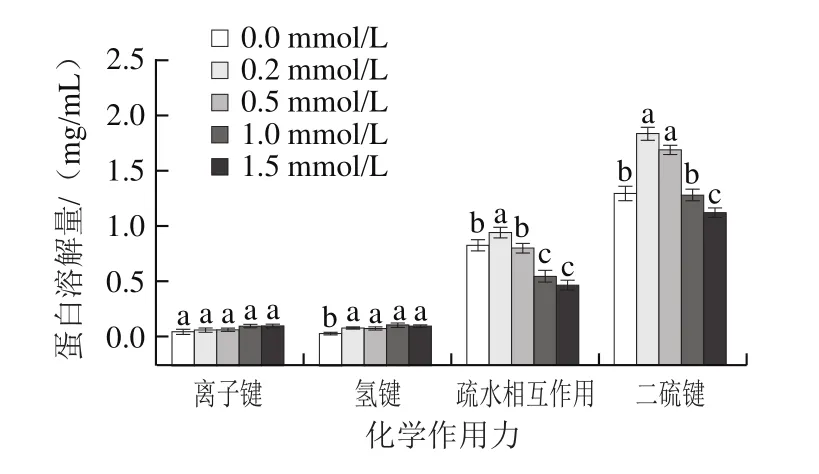
图7 血红素辅基浓度对肌球蛋白凝胶化学作用力的影响Fig.7 Effect of hemin prosthetic group concentration on chemical forces of myosin gels
2.8 血红素辅基对肌球蛋白凝胶微观结构的影响
对肌球蛋白凝胶的三维网络结构进行扫描电镜研究有助于深入了解氧化对蛋白凝胶形成过程的影响[40]。肌球蛋白凝胶的状态与蛋白持水性呈现相关性。未处理的肌球蛋白凝胶存在明显的凝胶网络结构(图8A);当添加血红素辅基浓度为0.2~0.5 mmol/L时(图8B、C),肌球蛋白凝胶的三维网状结构更为明显,表面更平整,孔隙细腻且形状规则均匀,结构致密,有较好的成胶能力。致密均匀的三维网络结构有助于水分的截留,这与凝胶的保水性结果一致;当添加血红素辅基浓度为1.0~1.5 mmol/L时(图8D、E),蛋白凝胶的网络结构逐渐不清晰,结构粗糙松散,孔隙变大,分布不均,肌球蛋白凝胶结构发生断裂。这一结果表明高浓度的血红素辅基使肌球蛋白过度氧化,导致蛋白变性,结构过度展开,蛋白分子间疏水性聚集导致蛋白过度交联,阻碍了肌球蛋白热诱导聚集交联以及二硫键的形成,从而使蛋白胶束分布不均匀,不能形成良好的凝胶网络结构,截留水分子的能力变弱,表现出保水性降低的现象。
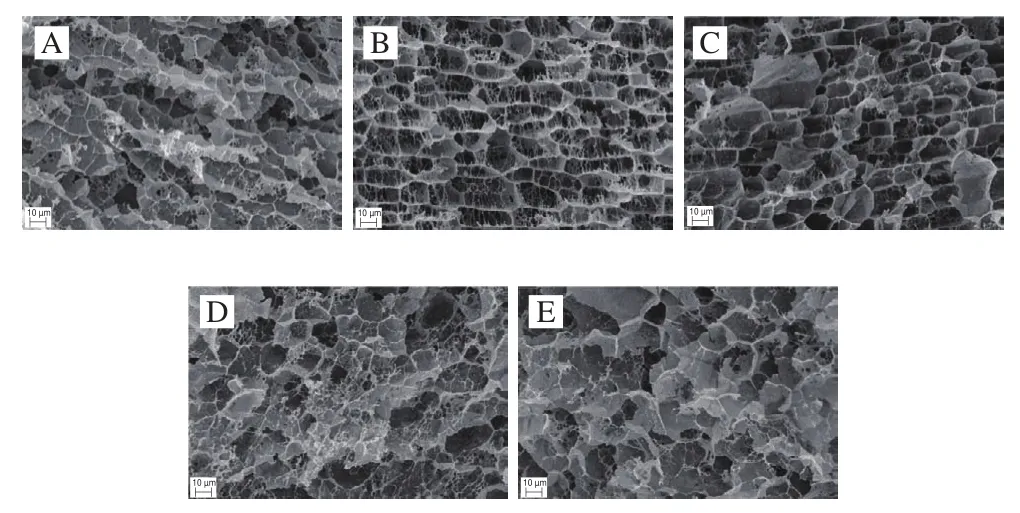
图8 血红素辅基浓度对肌球蛋白凝胶微观结构的影响Fig.8 Effect of hemin prosthetic group concentration on the microstructure of myosin gels
3 结 论
本实验研究发现,随着血红素辅基浓度的增加,肌球蛋白溶解度呈现下降的趋势,粒径增加,这是由于血红素辅基氧化肌球蛋白造成蛋白结构展开,蛋白分子发生聚集。低浓度血红素辅基(0.2~0.5 mmol/L)处理后有助于提高肌球蛋白乳化稳定性,改善肌球蛋白凝胶强度,同时提高凝胶中不易流动水的比例,提升凝胶束缚水的能力;高浓度血红素辅基(1.0~1.5 mmol/L)处理后,肌球蛋白结构大量展开并过度聚集,肌球蛋白变性加剧,降低了蛋白的乳化特性,因此肌球蛋白凝胶呈现粗糙的三维网状结构,凝胶保水性下降,凝胶品质降低。在此基础上,对血红素辅基处理后肌球蛋白热诱导凝胶形成过程中分子间作用力变化的研究表明,稳定肌球蛋白热诱导凝胶的主要作用力为疏水相互作用和二硫键,适度氧化有利于肌球蛋白凝胶形成过程中疏水相互作用及二硫键的形成,凝胶网络的稳定提高性;过度氧化的肌球蛋白在加热前已大量聚集,不利于热诱导过程中疏水相互作用以及二硫键的形成、分子的聚集以及稳定有序的凝胶三维网络结构的形成。

