北京市景观用水DOC荧光特性及其与铜、铅的络合特性研究
许新瑶,蒲 晓①,高 静,董 雪,张玉虎,胡延佳,孟少康,王 健
(1.首都师范大学资源环境与旅游学院,北京 100048;2.青岛啤酒股份有限公司安全环保管理总部,山东 青岛 266071)
由于水资源日益匮乏,再生水已逐步替代天然水,成为城市景观水体的主要补给水源之一[1]。北京是一个典型的特大城市,年降水量低,地表蒸发量高,其水资源现状令人关注[2]。近年来,北京市50%以上的再生水供应给城市景观河湖水体,极大地缓解了北京市缺水的现状[1]。尽管再生水可以缓解缺水问题,但城市河流流速较慢,连通性、自净能力和对污染物的降解能力较差[3],对城市景观水体长期补充再生水,可能会导致河流水质进一步降低,并产生负面的生态和环境影响。
再生水虽然经过深度处理并达到一定的水质标准,但其中依然存在一定浓度水平的溶解性有机碳(DOC)[4]。同时,再生水补给景观水体后,原再生水中存在的氮磷等营养元素进入水体,促使微生物代谢活跃和藻类生长,通过生物内源释放增加水体DOC浓度[5]。此外,DOC提供的生物可同化有机碳(AOC)在深度处理过程中会引起膜污染,并刺激再生水供应系统中的细菌再生,导致再生水水质恶化[6]。
生态风险评估表明,重金属可能成为再生水补给城市河流中的生态风险污染物[7]。重金属不仅会对人体健康产生危害,还能富集于生物体内不被降解,并通过食物链积累、放大,加剧生态风险[8]。其中铜在高浓度下具有很高的毒性,它可导致人体铜中毒,对肾脏、肠道等器官产生损害,严重时能致人死亡[9],相对于其他元素,铜对植物根系生长产生的抑制作用也较强[10],铜形成的金属硫化物对水体还具有致黑效应[11]。铅是三大重金属污染物之一[12],一旦进入人体会使神经系统和大脑受到损伤,还会导致婴幼儿贫血甚至脏器发育不全[13]。此外,由于DOC含有丰富的有机官能团(如酰胺、羧基、苯酚、羟基),且官能团具有较高的活性位点,因此可以与重金属相互作用形成有机金属配合物,影响水体的水质,并降低游离金属离子对水生生物的毒性和生物利用度[14]。一般来说,在元素周期表上的不同价层电子构型金属(包括s、p、d区)与DOC的结合能力也存在差异,相比于s区金属元素,p区和d区金属元素的配位能力更高,其中铅和铜分别属于p区和d区[15]。由于DOC在调节金属离子的毒性和迁移方面的重要性,深入研究重金属与DOC的相互作用将为评价和预测其在水体中的环境行为提供有价值的信息。
目前,关于城市景观水体,尤其是再生水补给型景观水体的水质变化、营养状态[16]、有机物的分布特征[17]等已开展研究,但关于景观水体DOC与重金属相互作用的研究尚鲜有报道。为了解北京市再生水补给型景观用水中DOC的状况,以及DOC与重金属相互作用后可能对水质产生的潜在环境影响,笔者对北京市景观用水的DOC特性及其与重金属的络合特征进行研究,以期为北京市使用再生水补给景观水体的水质维护和潜在污染治理提供指导。
1 研究区与研究方法
1.1 研究区概况
选取北京市内4个典型的以再生水作为景观水体补给水源的公园(南海子公园、圆明园、陶然亭公园和龙潭公园)为研究对象。南海子公园二期的湖区面积达1 km2,湖区水源来自小红门污水厂供给的再生水,其用水量达3×105m3·d-1。圆明园水系的再生水来自于清河污水处理厂,其用水量达2×104~3×104m3·d-1。龙潭湖和陶然亭湖补水水源均主要为高碑店污水处理厂再生水,其水域面积分别为3.7×105和1.67×105m2。
1.2 样品采集与预处理
于2020年9—10月分别在4个公园内的湖区进行采样(图1)。每个公园设置10个采样断面,其中圆明园内采样湖区选择的是福海、鉴碧亭和凤麟洲,福海设置8个采样断面,鉴碧亭和凤麟洲各设置1个采样断面。在每个采样断面水面以下约0.5 m处进行采集,采样前将采样瓶用水样预冲洗3次,每个断面采集3份平行水样后混合,现场使用便携式溶解氧测试仪(罗马尼亚,哈纳HI9146)测定温度,便携式pH计(意大利,哈纳HI98191)测定pH值,便携式电导仪(美国,哈希sensION5)测定总溶解固体(TDS)及电导率。样品带回实验室用0.45 μm孔径的玻璃纤维滤膜过滤后,在4 ℃下避光冷藏保存。
1.3 超滤分级
用超滤法对水样DOC进行分子量分级。实验开始前先分别用NaOH、HCl溶液不加压搅拌清洗超滤膜,然后加入去离子水加压并搅拌清洗超滤膜。为防止滤膜对水样干扰,在正式超滤前先超滤约100 mL超纯水。在室温(25 ℃)下将过滤后的水样加入200 mL超滤杯(Amicon Stirred Cell,美国),使用氮气进行加压,收集相应的膜下滤出液和膜上浓缩液,过膜顺序为10 kDa→5 kDa→1 kDa,最后获得4个分子量段的DOC:<1 kDa、1~5 kDa、>5~10 kDa、>10 kDa~0.45 μm。

图1 4个公园景观水体采样点分布
1.4 荧光猝灭滴定实验
在荧光滴定之前,将未分级水样稀释到跟分级后的水样浓度一致,且所有样品ρ(DOC)<10 mg·L-1,尽量减少内部过滤效应[3]。向装有30 mL DOC样的锥形瓶中分别滴加0、60、120、180、240、300 μL的0.01 mol·L-1的Cu2+、Pb2+溶液,使Cu2+、Pb2+浓度分别为0、20、40、60、80及100 μmol·L-1,忽略浓度稀释效应。样品置于黑暗处振荡平衡24 h。滴定实验做1个平行实验。
1.5 平行因子分析和络合建模
采用MATLAB软件及efc软件[18]对三维荧光光谱矩阵进行平行因子分析(PARAFAC)。PARAFAC是通过非负性约束条件下的2~7个组分模型计算,并采用残差分析、核心一致性分析、分半检验等方法确定荧光组分的数量。最大荧光强度(Fmax)用于估计各个荧光组分的相对水平。
采用修正型Stren-Volmer模型[19]来确定重金属与PARAFAC衍生荧光组分之间的络合参数,包括K(条件稳定常数)和f(参与金属离子配位的荧光基团的比例),其公式为
F0/(F0-F)=1/fKCM+1/f。
(1)
式(1)中,F0为滴定开始时(未添加金属)的荧光强度;CM为金属浓度,mol·L-1;F为CM下的荧光强度,以单位a.u.标注。
在该模型中,如果F0/(F0-F)与1/CM线性相关,K和f的值分别通过直线的斜率(1/fK)和截距(1/f)计算得出[20]。对条件稳定常数K取对数,得到络合稳定常数lgK。
1.6 分析仪器条件及参数
DOC浓度使用总有机碳分析仪(Elab-TOC)测定,每个样品重复3次以上,取均值。相对标准偏差(RSD)小于3%。在荧光光谱分析仪(Hitachi F-7000)上进行三维荧光光谱扫描,仪器配以1 cm石英比色皿,采用150 W氙弧灯作为激发光源,光电倍增管电压(PMT电压)为400 V,信噪比>110,响应时间设为自动,扫描速度为60 000 nm·min-1,激发波长(Ex)范围为220~450 nm,间隔5 nm,发射波长(Em)范围为200~690 nm,间隔1 nm,扫描光谱进行仪器自动校正。Cu2+和Pb2+浓度使用PXSJ-216F离子计和相应的离子电极测定。DOC与重金属离子的络合态浓度(CDOC-M)为总溶解态重金属浓度(CMT)减去游离态金属离子浓度(CM2+)。
1.7 数据处理
采用ArcGIS 10.2软件绘制采样断面位置;采用Microsoft Excel 2016和Origin 2019 b软件对实验数据进行数据整理、制图分析和模型拟合;通过MATLAB R 2016a和efc v1.2软件对处理后的荧光数据集进行PARAFAC分析。
2 结果与讨论
2.1 DOC的荧光组分特征
4个公园景观水体DOC的荧光组分及其相应的激发、发射波长如图2所示。通过PARAFAC分析,从4个公园景观水体DOC中鉴定了3种荧光组分,包括2种类腐殖质物质(C1和C2)和1种类蛋白物质(C3)。
对3种荧光组分的类型和波长范围与先前研究结果(表1)进行比较。组分C1〔Ex/Em=250(356) nm /454 nm〕包含2个激发峰和1个发射峰,其中荧光峰Ex/Em=250 nm/454 nm指示紫外光区类腐殖质A峰,荧光峰Ex/Em=356 nm/454 nm指示可见光区类腐殖质C峰[21]。A峰主要由相对分子质量较大、不易氧化降解的有机物组成;C峰主要由相对分子质量较小、高荧光效率的有机物质组成,易被氧化降解,但两者都可能与DOM中羰基和羟基有关,一般指示外源输入[21]。
组分C2〔Ex/Em=235(295) nm/375 nm〕同样属于类腐殖酸类荧光峰,其中荧光峰Ex/Em=235 nm/375 nm指示紫外光区类腐殖质A峰,荧光峰Ex/Em=295 nm/375 nm指示传统类腐殖质M峰[21]。M峰主要反映了来自海洋的类腐殖质物质[22],最初是在生产性海洋环境中观察到的,但现在在受农业影响的淡水中[23]和饮用水处理厂的有机物中[24]也有发现。
组分C3〔Ex/Em=230(285) nm/340 nm〕被认为与类蛋白色氨酸类物质有关,对应传统的T峰,这种类型的荧光团通常与生物活性有关,并被认为是通过生物降解过程产生的[25]。

Ex—激发波长,Em—发射波长。

表1 荧光组分的位置及其与先前研究的比较
从图2可发现,C1、C2的最大荧光强度均小于C3,表明景观水体DOC中2种类腐殖质的相对含量均低于类色氨酸。圆明园、陶然亭公园和龙潭公园是北京市典型的现代化公园,周边人类活动较多,因此除污水处理厂排水所引入的有机物,水体DOC荧光组分可能受到人类活动的影响较大,而南海子公园二期则是近两年才开发,水体DOC荧光组分可能受到施工建设活动的影响较多。此外,水体DOC浓度还可能与景区动物排泄污染、动物下水扰动水体、降水、枯枝落叶污染水体等有关[31]。
2.2 DOC的分子量分布特征
2.2.1分子量分布
4个公园景观用水DOC的分子量分布特征如表2所示。除南海子公园外,其他3个公园水体DOC均以<1 kDa分子量的占比最高,在圆明园、陶然亭公园、龙潭公园水体中占比分别为38.11%、39.11%、54.36%;其次为>5~10 kDa DOC,在3个公园中占比分别为31.05%、23.37%、28.71%;陶然亭公园和龙潭公园中占比最低的均为>10 kDa DOC,分别为17.64%和2.56%,而圆明园占比最低的则是1~5 kDa DOC,为9.91%。陶然亭公园和龙潭公园内景观用水不同分子量DOC的分布规律相同,可能是因为湖区水体来自同一个补水水源。而在南海子公园,DOC占比最高的是>10 kDa,为29.21%,其次分别是<1 kDa、>5~10 kDa和1~5 kDa DOC,占比分别为26.77%、26.10%和17.92%,不同分子量DOC的占比差异不大。

表2 各公园水体DOC的分子量分布情况
2.2.2不同分子量DOC的荧光组分特征
经过分级后,不同分子量DOC中共有的荧光组分及其相应的激发、发射波长发生了变化(图3)。通过PARAFAC分析,从不同分子量DOC中识别出了2种荧光组分,包括一种类腐殖质物质(C1)和一种类蛋白物质(C2)。对2种荧光组分的类型和波长范围与先前研究结果进行比较(表3)。

C1—类腐殖质物质,C2—类蛋白物质,Ex—激发波长,Em—发射波长。
由图3和表3可知,分级后的DOC中存在组分C1〔Ex/Em=245(270) nm/436 nm〕和组分C2〔Ex/Em=225(285) nm/347 nm〕,分别指示陆源类腐殖质和类蛋白质色氨酸,对应的是分级前的组分C1和C3,4个公园景观用水的组分C2在分级后未被识别出。一般来说蛋白质类组分的占比会随着分子量的降低而增加,而类腐殖质组分的占比则相应减少[32],原组分C2即类腐殖质物质,因此在小分子量组分中其含量可能极低甚至没有,同时PARAFAC分析主要是对多个DOC样品三维荧光光谱(EEMs)中的共同荧光组分进行识别,因此原组分C2在分级后未被识别出。
相对于分级前的组分C1,分级后C1的荧光波长发生了蓝移(最大峰向短波长方向移动),一般来说,对于腐殖质占主导的荧光强度降低并伴随着峰位发生蓝移,可能主要反映的是芳香性官能团减少的过程[33]。因此,组分C1在2个荧光峰处发生蓝移,说明其对应的物质成分逐渐减少,并且分子结构趋于简单化[30]。
2.3 DOC与Cu、Pb的络合特征
2.3.1络合态含量
为进一步探究北京市景观用水中不同分子量DOC与重金属Cu、Pb的络合特征,对DOC与Cu2+、Pb2+进行荧光猝灭滴定实验,并在滴定实验结束后测定相关参数。不同分子量DOC与不同浓度的Cu2+、Pb2+络合后的络合态重金属浓度如表4所示。由于<1 kDa溶液在络合实验结束后Cu2+、Pb2+浓度均低于离子电极的检出限,因此表4只列出了≥1 kDa溶液与重金属Cu、Pb的络合态含量。
络合实验后,在≥1 kDa DOC中,未分级DOC与Cu2+、Pb2+络合形成的DOC-Cu和DOC-Pb浓度分别为16.52~95.99和19.17~99.15 μmol·L-1,>10 kDa DOC中分别为18.29~91.14和19.09~92.45 μmol·L-1,>5 ~10 kDa DOC中分别为18.10~75.20和17.90~88.78 μmol·L-1,1~5 kDa DOC中分别为12.42~83.83和16.91~91.73 μmol·L-1,表明≥1 kDa DOC中任意分子量段的DOC与重金属络合实验后产生的DOC-Pb浓度均大于DOC-Cu。同时观察Cu2+、Pb2+与≥1 kDa DOC中不同分子量DOC络合形成的络合态重金属浓度(表4)可发现,在未分级和>10 kDa DOC溶液中检出的DOC-Cu浓度高于>5 ~10 kDa和1~ 5 kDa DOC;未分级DOC溶液中检出的DOC-Pb浓度略高,而在>5~10 kDa DOC溶液中DOC-Pb浓度略低。

表3 荧光组分的位置及其与先前研究的比较

表4 不同分子量DOC的络合态重金属浓度
滴定实验结束后,对于<1 kDa DOC溶液,由于Cu2+、Pb2+的浓度均低于离子电极的检出限,表明<1 kDa DOC中产生的络合态铜和络合态铅最多,这可能是因为相较于高分子量有机质,低分子量有机质中有更多的金属结合点位[38],同时Cu2+和Pb2+还对含胺位点具有高亲和力,这些位点通常位于分子量较低(<1 kDa)的芳香度分子上[39]。
对于≥1 kDa DOC中的4个不同分子量段,DOC络合实验后产生的DOC-Pb浓度均大于DOC-Cu,这一结果与以往研究[40]一致,这是因为对于二价金属离子配合物,无论所涉及的络合剂性质如何,铅离子配合物的稳定性均强于铜离子[40]。
Cu2+与≥1 kDa DOC中的4个不同分子量段DOC络合形成的络合态重金属浓度表现为在未分级和>10 kDa DOC中较高,这可能是因为在≥1 kDa DOC中,高分子量组分含有更多的类腐殖质物质,而Cu2+更倾向于与类腐殖质组分络合[36]。而Pb2+与不同分子量段DOC络合则未表现出明显的倾向性。
2.3.2荧光猝灭曲线
景观用水不同分子量DOC的2个荧光组分C1、C2在滴定了不同浓度的Cu2+和Pb2+溶液后,均表现出荧光猝灭作用(表5~6)。

表5 滴加Cu2+和Pb2+后荧光组分C1的最大荧光强度(Fmax)变化
当滴定的重金属浓度从20 μmol·L-1增加到100 μmol·L-1时,Cu2+对组分C1的猝灭程度为12.80%~47.14%,对组分C2的猝灭程度为1.08%~37.83%,Pb2+对组分C1的猝灭程度为-2.09%~38.14%,对组分C2的猝灭程度为-3.00%~24.28%。2种重金属离子对任意分子量段的DOC中2个荧光组分产生的猝灭作用均表现为Cu2+>Pb2+。其中,Cu2+对大部分DOC中荧光组分C1的猝灭程度强于组分C2,而Pb2+对2个荧光组分的猝灭程度随着分子量的变化而发生不规律性改变。如在与>5~10 kDa DOC络合时,Pb2+对组分C2的猝灭作用强于C1;在与其他分子量DOC络合时,Pb2+对组分C1的猝灭作用强于C2。值得注意的是,荧光强度并不是随着金属浓度的增加而一直降低的,有部分荧光猝灭曲线当重金属浓度增大时其荧光强度反而升高,但所有荧光猝灭曲线在整体上均呈降低趋势。

表6 滴加Cu2+和Pb2+后荧光组分C2的最大荧光强度(Fmax)变化
Cu2+、Pb2+与组分C1、C2反应均表现出荧光猝灭作用,表明2种重金属与2个荧光组分均发生了络合反应,这是因为Cu和Pb都是很强的DOC荧光猝灭剂[41]。其中Cu2+对任意分子量段的DOC中2个荧光组分产生的猝灭作用均强于Pb2+,最大荧光强度也较低,这可能是由于Cu作为DOC荧光猝灭剂,其荧光猝灭效果更强[41]。此外,Cu2+对荧光组分C1的猝灭作用强于组分C2,表明Cu2+更倾向于与组分C1络合,组分C1属于类腐殖质组分,这与WU等[32]的研究结果类似,即Cu2+倾向于与类腐殖质组分而不是蛋白质组分络合。Cu2+与腐殖酸的结合大多数发生在酚基点位上[39],但其与羧基配体形成的键强度最大[42],同时Cu2+与DOC中的O、N官能团络合,形成1~2个五元螯合环的结构[43]。
Pb2+对2个荧光组分的猝灭程度随着分子量的变化而发生不规律性改变,在与>5~10 kDa DOC络合时,Pb2+倾向于结合类蛋白质组分,在与其他分子量DOC络合时,Pb2+则更倾向于结合类腐殖质组分。Pb2+与DOC的结合强度和Cu2+类似,其络合在酚、醇、醚等点位上均有发生,其中与含胺点位的结合最强,与羧酸形成的键则略弱[42]。同时Pb2+的大离子半径使其可能与DOC形成具有不同中心原子配位数(2~15)的配合物[39]。
2.3.3络合参数
北京市景观用水不同分子量DOC的2个荧光组分与Cu2+和Pb2+络合后的络合稳定常数lgK和f值如表7所示。Cu2+与组分C1、C2的络合稳定常数范围分别为4.47 ~5.49、3.82~4.96,参与络合的荧光基团的比例范围分别为32.27%~67.45%、36.84%~76.15%,Pb2+与组分C1、C2的络合稳定常数范围分别为3.53~4.63、4.02~4.86,参与络合的荧光基团的比例范围分别为23.49%~97.30%、17.09%~46.46%。在DOC分子量和组分都相同的情况下,DOC与重金属的络合稳定常数变化大多表现为Cu2+>Pb2+。而对于不同分子量DOC,除Cu2+与组分C1络合的情况,Cu2+与组分C2、Pb2+与组分C1、Pb2+与组分C2络合时络合稳定常数均在<1 kDa DOC中最大,分别为4.96、4.63和4.86,但参与络合的荧光基团比例却最小,分别为36.84%、23.49%和17.09%。
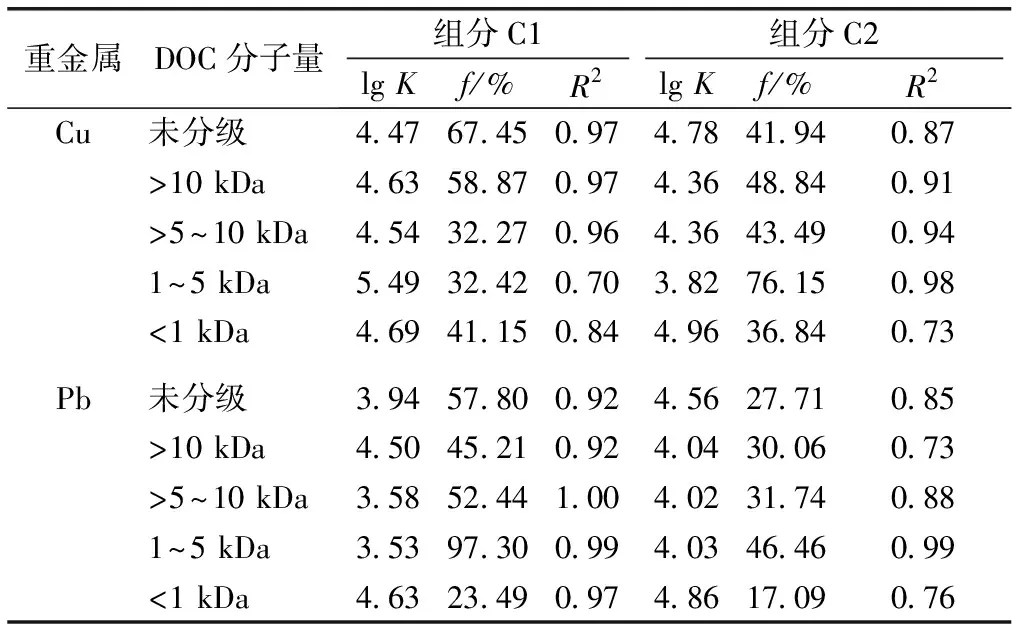
表7 不同分子量DOC与重金属络合的lg K、f、R2值
K为条件稳定常数,f为参与金属离子配位的荧光基团的比例。
Cu2+的络合稳定常数大于Pb2+,表明Cu2+与景观用水DOC的络合能力强于Pb2+。一般来说,Cu2+与Pb2+的络合能力接近,但当有机物中羧酸盐含量较高时,Pb2+与DOC的络合能力会弱于Cu2+,这是因为Pb2+可以与DOC上的胺、羧酸盐和酚类基团相结合,但结合顺序表现为胺>酚>羧酸盐,而Cu2+与羧酸盐的结合能力则较强[42],因此猜测景观用水DOC中可能含有较高的羧酸盐。若不同分子量DOC与重金属络合的络合稳定常数接近,则表明结合位点的主要成分可能相似[32],而该研究中不同分子量DOC与Cu2+、Pb2+络合时的络合稳定常数存在差异,这表明景观用水不同分子量DOC的主要组成基团和成分不同。同时2种重金属均在与<1 kDa DOC络合时的络合稳定常数最大,这可能是因为低分子量DOC的结合位点较多[44],且在<1 kDa DOC中存在更多与Cu2+、Pb2+有高亲和力的含胺位点[39],因此<1 kDa DOC络合Cu2+、Pb2+的能力较强。
3 结论
(1)北京市景观用水DOC中识别出3种荧光组分,组分C1、C2为传统类腐殖质物质,组分C3为类蛋白色氨酸类物质,其中2种类腐殖质的相对含量均低于类色氨酸。分级后的不同分子量DOC中识别出2种荧光组分,组分C1、C2分别指示陆源类腐殖质和类蛋白质色氨酸。
(2)对不同分子量DOC分别与Cu2+、Pb2+进行荧光猝灭滴定实验,实验结束后,<1 kDa DOC中产生的DOC-Cu和DOC-Pb浓度均大于其他分子量,且2种重金属均在与<1 kDa DOC络合时的络合稳定常数最大,表明低分子量DOC与重金属的络合能力较强。
(3)络合形成的DOC-Pb浓度均大于DOC-Cu,表明Pb2+能与景观用水DOC络合产生更多配合物,但Cu2+对2个荧光组分的猝灭程度均强于Pb2+,且Cu2+与DOC的络合稳定常数在多数情况下大于>Pb2+,这表明Cu2+与DOC中2个荧光组分的络合能力强于Pb2+。
(4)Cu2+、Pb2+与组分C1、C2反应均呈现出一定程度的猝灭效应,其中Cu2+对组分C1的猝灭作用强于组分C2,表明Cu2+更倾向于与类腐殖质物质络合,而Pb2+与2个荧光组分络合时的倾向性随分子量的变化而发生变化。
上述研究结果表明,将再生水回用于景观水体时,也需要注意生态环境影响,特别是水体中的DOC以及潜在的重金属。其中北京市景观用水DOC中的荧光物质以外源输入的类腐殖质为主,因此可以通过缓冲带建设、有效降低径流、加强监管等措施降低有机物的外源输入。

