1株羊肠道病毒的分离与鉴定
刘汉胜
(甘肃省会宁县农产品质量安全检验检测管理站,会宁 730799)
羊肠道病毒病(caprine enterovirus disease,CEVD)是由羊肠道病毒(Caprine enterovirus,CEV)引起羊的以危害呼吸系统和消化系统症状为主要特征的一种急性传染病[1-2],为近年来新发现的动物传染病,我国最早于2014年在致死率达50%以上发生严重腹泻的羊群中首次检测到CEV,并完成了毒株的分离和基因测序[3-4]。根据鲁桂侠等[5-7]分别对河北省、河南省、山东省的流行病学调查显示,近几年来CEV在我国羊群中的流行比较严重,直接导致了羊生产性能和养殖经济效益的下降,也给我国羊病尤其是羊腹泻性疫病的防控工作增加了难度,也在一定程度上阻碍了我国养羊业的可持续和高质量发展。但当前对于CEV致病机制、生物学特性等方面的研究尚处于起步阶段,且缺乏有效的疫苗和诊断试剂,导致CEV的综合防控工作较难开展。当前分离鉴定CEV现地流行毒株,并研究流行毒株的理化特性、遗传特征、致病性,对CEV致病机制和发病机理等基础性研究、CEV疫苗和诊断试剂研发等应用性研究均具有十分重要的现实意义。
2021年春,甘肃省某羊场暴发一种以严重腹泻、精神萎靡、逐渐消瘦为主要临床症状的疫病,应用多种抗生素治疗均无效果,经基层兽医临床诊断为疑似CEV感染。为确诊此次疫病的致病原,为该羊场疫病防控提供技术支持,同时掌握CEV流行毒株的生物学特性和致病性,本研究进行了CEV的分离鉴定、序列分析、生物学特性、致病性等研究,旨在获得CEV现地流行毒株,掌握CEV流行毒株的理化特性、遗传特征和致病性,为CEV致病机制、新型疫苗、诊断试剂等研究奠定基础,为我国CEV的综合防控提供参考依据和技术支持。
1 材料和方法
1.1 临床病料样品的采集与处理 采集发病羊群的新鲜粪便样品,低温、快速运抵实验室。
1.2 细胞、载体、分子生物学试剂 Vero细胞系购自上海哈灵生物科技有限公司;DH5α感受态细胞、pMD18-T载体、一步法RT-PCR扩增试剂盒均购自TaKaRa公司;病毒基因组RNA提取试剂盒、胶回收试剂盒、质粒提取试剂盒均购自天根生化科技(北京)有限公司。
1.3 病毒分离培养 将采集的新鲜粪便样品溶解于3倍体积灭菌磷酸盐缓冲液中,捣碎、碾磨,经12 000×g离心10 min,取上清液经0.22 μm滤膜过滤后,接种单层Vero细胞,置于37℃、5%CO2培养箱中培养,早、中、晚分别观察细胞病变情况,待75%以上细胞出现明显病变后,收获病毒,盲传6代。
1.4 分离毒株病毒含量(median tissue culture infective dose, TCID50)测定 将分离毒株依次做10倍倍比稀释(10-1~10-10),各稀释度分别接种96孔细胞培养板中的单层Vero细胞,每个稀释度接种8个孔,根据各稀释度的细胞病变孔数和未病变孔数,按照Reed-Muench法计算TCID50。
1.5 分离毒株生物学特性检测
1.5.1 酸碱敏感性检测 将分离毒株依次加入到pH值为3.0、5.0、7.0、9.0、10.0的培养液中,37℃作用2 h后,接种Vero细胞,测定TCID50。
1.5.2 氯仿敏感性检测 将分离毒株加入到终浓度为20%的氯仿中,4℃作用12 h,将有机相弃去后,接种Vero细胞,测定TCID50。
1.5.3 乙醚敏感性检测 将分离毒株加入到终浓度为20%的乙醚中,4℃作用12 h,反复吹打至乙醚挥发干净后,接种Vero细胞,测定TCID50。
1.5.4 温度敏感性检测 将分离株病毒依次在37℃、56℃、65℃、80℃作用1 h后,接种Vero细胞,测定TCID50。
1.6 分离毒株5'-UTR基因序列分析
1.6.1 引物设计与合成 根据GenBank中登录的CEV 5'-UTR基因序列(登录号:MN598038.1)设计1对引物(F:5'-CGTGGCGCTAGTGC-3',R:5'-TCCGCCTCCAACTTAC-3'),其预期扩增片段大小约为575 bp,引物由北京三博远志生物技术有限责任公司合成。
1.6.2 病毒基因组RNA提取 利用病毒基因组RNA提取试剂盒提取分离毒株的基因组RNA。
1.6.3 RT-PCR扩增 利用合成的引物对提取的分离毒株基因组RNA进行RT-PCR扩增。一步法RT-PCR扩增体系为:2×Buffer 12.5 μL,酶0.5 μL,上、下游引物各0.5 μL,RNA 2.5 μL,ddH2O 9 μL。一步法RT-PCR扩增程序为:50℃ 30 min;95℃预变性5 min;94℃变性45 s,54℃退火45 s,72℃延伸45 s,30个循环;72℃延伸10 min。
1.6.4 PCR扩增产物的克隆与序列分析 胶回收并纯化RT-PCR扩增产物后连接至pMD18-T载体,连接产物转化DH5α感受态细胞,利用质粒提取试剂盒提取重组质粒,送北京三博远志生物技术有限责任公司测序,利用DNAStar生物学软件对测得序列与GenBank中登录的CEV 5'-UTR基因序列进行同源性比较分析,并构建遗传进化树。
1.7 分离毒株致病性检测
1.7.1 试验分组 将日龄、体重均相似的20只健康羔羊随机分为2组(攻毒组和对照组),攻毒组的10只羔羊接种分离毒株,对照组10只羔羊接种灭菌生理盐水,接种方式均为肌肉注射,接种剂量均为0.1 mL/只,隔离饲养,观察14 d。
1.7.2 临床症状观察 每日观察试验羔羊的临床表现,及时记录食欲、精神状态、腹泻以及死亡等情况。
1.7.3 排毒情况检测 参照1.6中的PCR扩增方法对试验羔羊的每日粪便样品进行CEV病原检测,掌握排毒情况。
2 结果
2.1 病毒分离培养结果 将临床粪便样品接种单层Vero细胞后,在前2代未出现明显的细胞病变,至第三代开始出现明显细胞病变,随着传代次数的增加,细胞出现病变的规律性逐步增强,至盲传6代后细胞表现出圆缩、拉网、折光性增强等典型的细胞病变(图1),无菌收获第6代病毒,将其命名为GS株,-80℃保存。

图1 临床粪便样品引起的细胞病变(250×)Fig.1 Cytopathy caused by clinical fecal samples (250×)
2.2 分离毒株病毒含量(TCID50)测定结果 分离毒株经10-1~10-10倍比稀释后分别接种96孔细胞培养板中的单层Vero细胞,各稀释度导致Vero细胞发生细胞病变孔数和未病变孔数如表1所示,按照Reed-Muench法计算分离毒株的TCID50为10-6.88/ 0.1 mL。

表1 分离毒株病毒含量(TCID50)测定结果Table 1 Determination results of virus content (TCID50) of isolated strains
2.3 分离毒株生物学特性检测结果 分离毒株生物学特性检测结果如表2所示,分离毒株对酸性(pH值为3.0、5.0)不敏感,对碱性(pH值为9.0、10.0)较敏感,即分离毒株耐酸不耐碱;分离毒株经过氯仿和乙醚处理后病毒含量未见明显降低,分离毒株有机溶剂不敏感;分离毒株对温度较敏感,在56℃即完全失活。

表2 分离毒株生物学特性检测结果Table 2 Biological characteristics test results of isolated strains
2.4 分离毒株5'-UTR基因序列分析结果 分离毒株的RT-PCR扩增结果如图2所示,RT-PCR扩增产物片段约为575 bp,与试验预期相符。将分离毒株5'-UTR基因序列与GenBank中登录的CEV 5'-UTR基因序列进行同源性比较分析,并构建遗传进化树,结果如图3、图4所示,分离毒株与6株G种羊肠道病毒核苷酸同源性较高,同源性为90.8%~100%,其中与羊肠道病毒CEV-JL14株(GenBank登录号:KU297674.1)5'-UTR基因核苷酸同源性为100%,与E种和F种羊肠道病毒核苷酸同源性较低,在进化树中分离毒株与羊肠道病毒CEV-JL14株(GenBank登录号:KU297674.1)、CEV-JLLS34株(GenBank登录号:MN598033.1)、CEVJL-LS165株(GenBank登录号:MN598035.1)、C E V-J L-L S 1 7 4株(G e n B a n k登录号:MN598036.1)、CEV-SD-S68株(GenBank登录号:MN598040.1)、CEV-NMG-F37株(GenBank登录号:MN598041.1)的同源关系较近,进化树处于同一分支,都属于G种肠道病毒,与E种肠道病毒、F种肠道病毒属于不同的分支,进而从分子水平证实分离毒株为G种羊肠道病毒。

图2 RT-PCR检测结果Fig.2 RT-PCR results

图3 分离毒株5'UTR核苷酸同源性比较分析结果Fig.3 Comparative analysis results of nucleotide homology of 5'UTR isolated strains
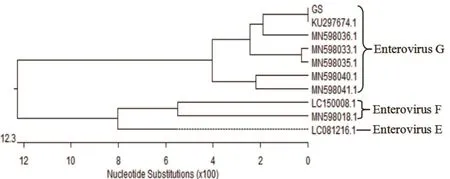
图4 分离毒株5'-UTR基因进化树分析结果Fig.4 Evolutionary tree analysis results of 5 '- UTR gene of isolated strains
2.5 分离毒株致病性检测结果 每日观察试验羔羊的临床表现,结果如表3所示,攻毒组的10只羔羊在攻毒后第3 d陆续开始表现出食欲下降、精神萎靡、腹泻等临床症状,临床症状在攻毒后第8 d陆续开始减轻,试验期间共计有8只羔羊表现出临床症状,发病率达80%,攻毒组羔羊未出现死亡。利用PCR扩增方法对试验羔羊的每日粪便样品进行CEV病原检测,结果如表4所示,利用PCR方法对试验羔羊的每日粪便进行检测,在攻毒后第2 d攻毒组羔羊粪便中即可检测到CEV病原,在攻毒后第6 d CEV阳性检出率已达到100%,至攻毒后第14 d CEV阳性检出率仍然达到100%,表明攻毒后羔羊一直向体外排毒。

表3 攻毒羔羊临床症状观察结果Table 3 Observation results of clinical symptoms of virus challenged lambs

表4 攻毒羔羊排毒情况检测结果Table 4 Test results of detoxification of virus challenged lambs
3 讨论
CEV为近几年新出现的羊易感病毒病,关于其致病机制、细胞适应性、理化特性、遗传特征的研究报道相对较少,Zhu等[8]研究表明牛肠道病毒能在Vero细胞中增殖,故本研究借鉴牛肠道病毒的分离培养方法,利用Vero细胞系进行CEV的分离培养,结果表明临床新鲜粪便样品接种Vero细胞后,经盲传6代后出现细胞圆缩、拉网、折光性增强等典型细胞病变,按照Reed-Muench法测定分离毒株的TCID50达10-6.88/0.1 mL,具有较高的抗原滴度。进一步通过生物学特性检测表明病毒具有耐酸不耐碱、对有机溶剂不敏感、不耐热等理化特性。在众多肠道病毒中动物主要易感E种、F种和G种肠道病毒,而5'-UTR基因是各种肠道病毒分型的首选基因[9-12],本研究通过测定分离毒株的5'-UTR基因序列发现,分离毒株与我国2014年分离毒株CEV-JL14的同源性最高,处于进化树的同一分支,从分子水平证明分离到的CEV毒株为G种羊肠道病毒。总之,本试验成功分离到了一株G种羊肠道病毒,并掌握了该毒株的细胞适应性、理化特性和遗传特征,首次确定了甘肃省腹泻羊群存在G种羊肠道病毒感染,为丰富我国CEV流行病学资料提供了参考资料,为研制CEV新型疫苗与诊断试剂奠定了坚实的物质基础。
在本研究中,分离毒株攻击的羔羊在攻毒后第2 d可在粪便中检测到CEV,至攻毒后第14 d CEV检出率仍为100%,攻毒后羔羊一直在向体外排毒,但在临床表现方面,攻毒的10只羔羊只有8只表现出食欲下降、精神萎靡、腹泻、逐渐消瘦等症状,发病率达80%,未出现羔羊死亡。表明分离毒株可在羔羊体内繁殖复制,但其并未能引起羔羊死亡,这与临床中CEV可引发的50%病死率存在较大差异,分析其产生的原因主要有以下两方面:一方面,CEV不同毒株的毒力存在较大差异,由其引起的病死率也将存在较大差异;另一方面,CEV在临床中常常与其他致病原存在混合感染,王应龙等[13]研究表明青海省海东市腹泻藏羊中CEV与牛病毒性腹泻病毒(Bovine viral diarrhea virus, BVDV)、羊边界病病毒(Border disease virus, BDV)的混合感染率分别为4.12%、3.13%,张群等[14]研究表明吉林省和内蒙古地区羊群中CEV与小反刍兽疫病毒(peste des petits ruminants virus, PPRV)的混合感染率为6.60%,由此推测临床中CEV与其他致病原的混合感染增加了CEV的致病性。本研究结果表明分离毒株对羔羊具有一定的致病性,为CEV致病机制研究、CEV综合防控措施的制定提供了参考依据。

