miR-21对食管癌细胞增殖、凋亡及 PI3K/Akt 信号通路的影响
江秀玲 胡有根 彭建明 罗雪 苏兰娣 汤元杰

【摘要】目的:探讨 miR-21对食管癌细胞增殖及凋亡影响与分子机制。方法:将食管癌细胞分成 miR-21- NC 组、miR-21组、LY294002组、LY294002+miR-21组、对照组5组,检测 miR-21表达情况及食管癌细胞系中 PI3K、Akt 与 p-Akt 表达情况。结果:食管癌细胞系的 miR-21相对表达量明显高于正常食管上皮细胞系(P<0.05); miR-21组在 miR-21相对表达量高于对照组、miR-21-NC 组(P<0.05);在 Eca-109细胞增殖率上,结果显示而 miR-21组的细胞增值率要远比对照组、miR-21-NC 组的指标更高,对比差异有统计学意义(P<0.05); LY294002组在 Eca-109细胞增值率上比对照组低,差异有统计学意义(P<0.05); LY294002+miR-21组在 Eca-109细胞增值率上比 LY294002组明显更高,差异有统计学意义(P<0.05);miR-21组细胞中 PI3K、p-Akt 相对表达量均高于对照组, LY294002组 PI3K、p-Akt 相对表达量均低于对照组(P<0.05)。结论: miR-21可通过调节 PI3K/Akt 信号通路,促进食管癌细胞的增殖及凋亡,为食管癌靶向治疗提供一定理论依据。
【关键词】miR-21;食管癌;细胞增殖;凋亡; PI3K/Akt 信号通路
【中图分类号】R735.1【文献标识码】A 【文章编号】2096-5249(2022)05-0015-03
食管癌现阶段有着越来越高的发病率,该病隶属食管肿瘤病变[1]。近年来随着医学技术的不断发展,食管癌发病率虽然有所降低,经手术及放化疗治疗提升疗效,但是患者的预后仍旧比较差[2]。在分子生物技术发展背景下,医学工作者积极寻求针对有效抑制食管癌细胞增殖及凋亡的治疗靶点,目前根据相关研究得知,显示微小RNA(microRNA)可引起食管癌的发生发展。 miR-21作为在食管癌病变组织、血清、唾液中高表达的物质,可促进食管癌细胞的增殖及凋亡,并且在后续的相关研究中也显示,miR-21对 PI3K/Akt 信号通路也有一定的影响[3],但是具体作用机制上尚且存在一些争议,故本次研究就此进行了具体的探讨,报告如下。
1 资料与方法
1.1一般资料
试验材料为人正常食管上皮细胞系、食管癌细胞系。试剂与材料:培养基、培养板;抑制剂;反转录酶;鼠抗人磷脂酰肌醇3-激酶(PI3K)、蛋白激酶B(Akt)、磷酸化蛋白激酶B(p-Akt)多克隆抗体;低温高度离心机、荧光定量 PCR仪器;流式细胞仪; miR-21、miR-21- NC及引物序列。
1.2方法
1.2.1细胞培养
取正常食管上皮细胞系、食管癌细胞系,室温下缓慢解冻,将解冻后的细胞系加胰蛋白酶,加入物质后制备为细胞悬浮液,制成的悬浮液进一步将其接种至培养基中,培养基的组成成分为10%胎牛血清+100mg/mL 链霉素+100 U/mL 青霉素,接种的培养基则是置入到培养箱中进行培养,培养箱的环境控制为温度37℃,5%CO2、湿度适宜。为了确保培养效果,培养基需要定时的更换,更换频率为2 d一次,期间需要注意对培养瓶内的基本情况检查,当发现瓶底的细胞数量繁殖至覆盖瓶底85%的时候即可向其中加入胰蛋白酶做进一步处理,具体是实施细胞培養及冻存处理。
1.2.2 miR-21表达水平检测
取正常食管上皮细胞系、食管癌细胞系,提取细胞总 RNA,经反转录酶转录获得 cDNA,获得上下游备用的引物,对于上游引物涵盖如下的序列:5-AGCTGTACAAGTAAGTTATCAAATCCTGCCTGACTG-3。下游引物则是涵盖以下序列:5-GGGAGAG GGGCTTAGTCCTCCCTCCATACTGCTG3。经最大二阶导数法得出细胞中欧 miR-21相对表达量。反应总体系为50μL,其中模板cDNA 为1μL,上下游引物含量均各自为2μL,混合液量为12μL,其中加无菌的蒸馏水到总量为50μL。反应的条件主要是95℃温度下持续5 min预变形处理,之后在67℃温度下持续延伸15 s,维持连续40循环的反应处理。
1.2.3对pre-miR-21、pre-miR-21-NC慢病毒载体的构建方法
构建上应用方式,具体是通过TRIzolreagent的方式,将人食管癌细胞中Eca-109的RNA提取出来,之后就将提取出的RNA 反转录呈为cDNA。合成与食管癌细胞Eca-109嵌合miRNA 序列,将不能相匹配的 miR-21-NC序列用作阴性的对照指标。 miR-21-NC 的引物主要是:5-GTT CTT GCTTCG GCA GAA CATATA CTA AAA TTG GAA CGA TAC AGA GAA GATTAG CAT GGC CCC TGC GCAAGG ATG ACA CGC AAA ATC GTG AAG CGT TCCACA TTT TT-3。序列均是携带有FITC的标识,这样主要是方便对转染的效率进行鉴定。根据序列以扩增miR-21,经DNA 产物纯化试剂盒做纯化处理,借助T4 DNA 连接酶对miR-21序列、GV254序列、miR-21-NC序列做酶切处理及酶接处理,根据以上的处理,建构慢病毒载体为备用。
1.2.4细胞分组及处理
获取对数细胞便于后续接种处理,接种的部位为包括24孔的培养板,待细胞融合度达到90%的时候分成以下5组: miR-21-NC组(慢病毒载体pre-miR-21- NC 和 Lipofectamine 2000转染液转染细胞)、 miR-21组(慢病毒载体pre-miR-21和 Lipofectamine 2000转染液转染细胞)、LY294002组(75μmol / L LY294002培养细胞)、LY294002+miR-21组(75μmol / L LY294002培养细胞+慢病毒载体pre-miR-21转染细胞)、对照组(DMSO 培养细胞)。上述分组上为确保数据科学性,均是选择9孔,给予各组相应的细胞载体配合干预,进行细胞转染,选择对应样品。针对对照组予以 DMSO 培养细胞,对细胞进行处理上,均是持续进行48h的培养,在48h 的培养结束后就可做清洗处理,经过清洗的培养基经流式细胞仪进行测定,测定的为颜色绿色的荧光细胞,并且还要进一步进行处理,处理内容为获得最合适转染浓度数值范围,以此作为参照。
1.2.5 MTT试验测定Eca-109细胞增殖情况
培养时间已满就可以去除培养板做接下操作,主要是将原培养基去掉,对每一孔均是向内部加入 DMEM培养液100μL,在避光条件下加 MTT溶液10μL,将溶液放到合适的培养箱中,培养箱环境的温度主要是37℃,其中涵盖浓度为5%的 CO2,持续放置4 h将细胞培养板取出,对各孔添加的培养液清除完全,清除的各孔则予以150μL 的二甲基亚砜溶液充填到清除的各孔当中,进行持续振荡处理,到其中紫色结晶完全的被溶解结束,利用酶标仪在570 nm 波长的范围之间,对各个孔吸光度情况进行精确测定。通过酶标仪以570 nm 波长范围测定各孔吸光度情况,对测定情况记录,并且以对照组细胞增殖100%对各组细胞增值率计算。
1.2.6检测食管癌细胞系中PI3K、Akt与p-Akt表达情况
在食管癌细胞系内,混合细胞裂解液,加入的量结合需求确定,经裂解液的融合使得其中总蛋白泌出,对蛋白样品做加热以及煮沸处理,同时还做进一步离心,获取蛋白样品,经电泳、转模后加入鼠抗人 PI3K、 Akt、p-Akt 多克隆抗体,充分混合置入大合适条件下存储,具体在温度4℃环境下过夜,之后则是置于 37℃温度下1小时,其中混合发光液做显影获得所需影像信息,对灰度值测定,测定的方法主要是用软件,进行表达情况的观察,主要观察 PI3K、Akt、p-Akt 蛋白水平,最终结果通过多次测定结果平均值表示。
1.3统计学分析
采用 SPSS 21.0统计学软件进行数据处理。计量资料用(±s)表示,使用 t检验。以 P<0.05表示差异有统计学意义。
2 结果
2.1正常食管上皮细胞系、食管癌细胞系中的miR-21相对表达量
miR-21表达情况上,同正常食管上皮细胞系进行对比,食管癌细胞中的miR-21数值明显更高,存在组间差异(P<0.05),见表1。
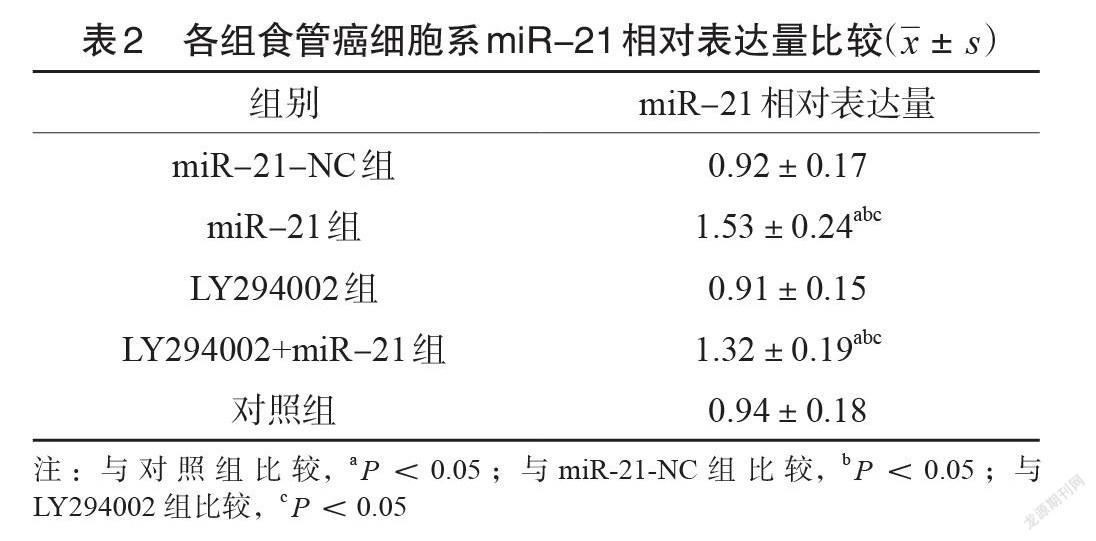
2.2各组食管癌细胞系miR-21相对表达量
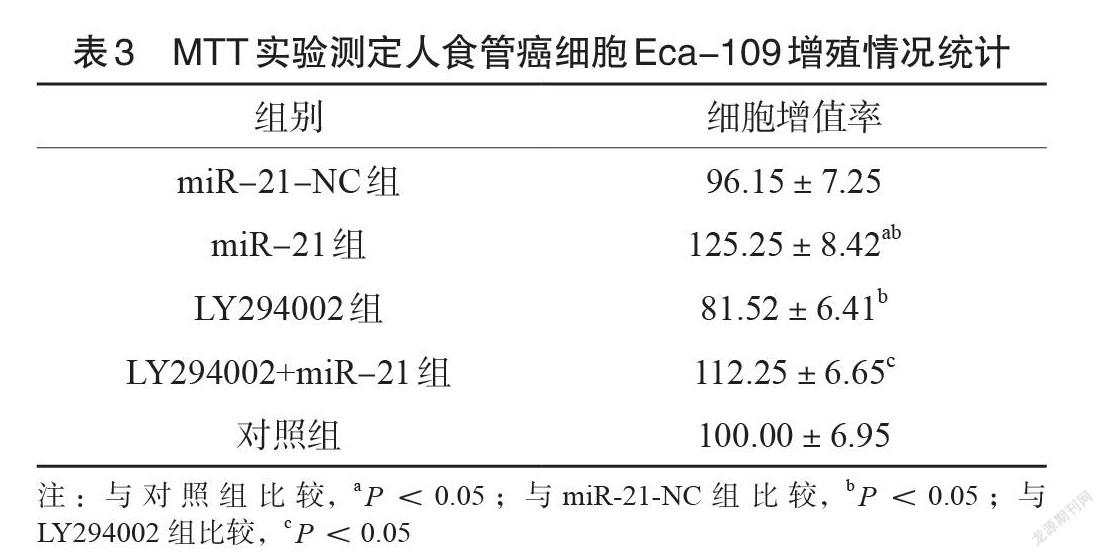
miR-21-NC组、LY294002组与对照组在miR-21相对表达量上比较,差异无统计学意义(P<0.05);miR-21组与LY294002+miR-21组在miR-21相对表达量高于对照组、miR-21-NC 组与LY294002组(P<0.05),见表2。2.3 MTT实验测定人食管癌细胞Eca-109增殖情况MTT 的试验测定指标上,表现为Eca-109细胞增值率上,对照组、 miR-21-NC 组比较差异无统计学意义(P>0.05);而miR-21组的细胞增值率要远比对照组、miR-21-NC组的指标更高,差异有统计学意义(P<0.05);LY294002组在Eca-109细胞增值率上比对照组低,差异有统计学意义(P<0.05);LY294002+miR-21组在 Eca-109细胞增值率上比 LY294002组明显更高,差异有统计学意义(P<0.05),见表3。
2.4各组食管癌细胞系PI3K、Akt、p-Akt表达情况
miR-21组细胞中PI3K、p-Akt表达水平均高于对照组, LY294002组PI3K、p-Akt表达水平要较对照组的水平更低(P<0.05),miR-21-NC 组、LY294002+miR-21组在PI3K、Akt、p-Akt表达水平上均与对照组比较差异无统计学意义(P>0.05)见表4。
3 讨论
食管癌主要分成食管鳞癌及食管腺癌,主要由亚硝酸盐及遗传等因素所致,近年來研究表明miR-21同食管癌发生发展、预后有紧密联系[4-5]。张莹等[6]的研究中,探讨miR-21对食管癌细胞增殖和凋亡影响及分子机制,在研究结果中,发现细胞中P13K、p-Akt数值上,表现为LY294002+miR-21组要比于LY294002组明显更高,这一结果主要是提示miR-21通过对P13K/Akt调节,引导信号的表达,这样就为食管癌细胞大量增殖提供基础,同时也对癌细胞凋亡进行阻止,使得食管癌长期存在。 miRNA作为一种内源性调控因子,其中的一个重要成员就是miR-21,miR-21可见机体多个部位的表达,多个组织中均可见这一因子,该因子关系到机体生长发育、细胞分裂、组织分化等等,调节人体代谢。国内外的研究中也已经正式,对于食管癌的患者, miR-21参与细胞分裂、增殖以及凋亡的全程,但是具体关于参加增殖及凋亡的机制尚不明确[7-8]。在本研究中,显示食管癌细胞系中,在miR-21表达上明显较正常食管上皮细胞更高,提示在进行食管癌的诊断上,临床中可以将miR-21作为关键诊断靶点。分析原因主要是miR-21是引起食管癌增殖及转移的关键通路,若miR-21表达量减少使得食管癌细胞也可发生凋亡,因此miR-21也是重要的治疗靶点。
食管癌属于多基因以及多因素引起的消化系统肿瘤疾病,关于疾病的病因尚且不明确,在相关的研究中,显示食管癌的患者上调的miR-21的作用在于提供细胞增殖以及转移的基础,此外也能对食管癌细胞凋亡进行有效抑制,属于关键过程[9]。而被 miR-21作用的细胞则是Eca-109,显示在食管癌细胞中 Eca-109的 miR-21表达值明显降低,这样可进一步引起人食管癌细胞Eca-109凋亡[10]。本次研究的结果中,显示经慢病毒载体的构建,在载体pre-miR-21上,能够同时被转染至食管癌细胞Eca-109,结果表明 LY294002组在 Eca-109细胞增值率上比对照组低, LY294002+miR-21组在 Eca-109细胞增值率上比 LY294002组明显更高,根据这一结果,能够发现miR-21是致癌的重要转录基础,属于食管癌持续增殖的关键,食管癌可在此基础上持续发生及发展。
本次研究结果表明, miR-21组在miR-21相对表达量非常高,此外miR-21组的细胞内PI3K、p-Akt 在相对的表达量指标上明显更低对照组表达量,表明miR-21在食管癌细胞的增殖及凋亡过程中发挥重要作用。 PI3K/Akt 信号通路也是肿瘤发生的关键,在既往的研究中,发现PI3K/Akt 信号通路在一些常见疾病如卵巢癌、小肠癌等的组织部位呈现高表达情况,并且细胞活化明显,起到的一个很重要的作用是诱导肿瘤增殖、侵袭以及凋亡[11]。在现有的研究中,结果显示miR-21可调控多种靶基因物质的表达,诸如PDCD4、PTEN、TIMP3、 PI3K、AKT等,其中PTEN 属于PTEN/PI3K/Akt 信号通路重要的组成部分,关键性作用在于明显的抑制患者肿瘤细胞信号通路PI3K/P-Akt 表达,如此对抑制肿瘤细胞增殖的价值突出,避免肿瘤转移以及倾斜情况的发生[12]。而对于miR-21若是出现过表达情况,可增强PI3K/Akt 信号通路,这样使得食管癌细胞也相应的增殖及病变出现持续进展。
综上所述,在食管癌的发生发展中,关键机制在于miR-21通过调节PI3K/Akt信号通路,如此为食管癌细胞发生及繁殖奠定基础,并且还对细胞凋亡起到抑制的作用,如此提供给疾病治疗重要靶点。
参考文献
[1] 陈晓,汤金星,何苡 . 长链非编码 RNA 肝细胞核因子 1α反义链 1 对食管癌细胞增殖,迁移和凋亡的影响 [J]. 中华实验外科杂志,2021,38(3):476-479.
[2] 于耀洋,赵佳,李向楠 . 南蛇藤提取物联合 miR-302 通过PI3K/Akt 信号通路调控食管癌细胞增殖、侵袭和迁移的研究 [J]. 中草药,2019,50(10):120-125.
[3] 罗远,蒋海忠 . miR-124 通过调控 PI3K/Akt 信号通路对人胃癌 MGC803 细胞增殖与凋亡的影响 [J]. 浙江临床医学,2020,22(10):1407-1410.
[4] 梁云微,连相尧,党春艳,等 . microRNA-21 在食管癌细胞增殖,迁移和凋亡中的作用 [J]. 基因组学与应用生物学,2020,39(2):365-371.
[5] 衣兰娟,衣兰杰,任珺,等 . miR-32-5p 低表达通过调控PI3K/AKT 信号通路抑制胃癌细胞增殖,迁移,侵袭并诱导凋亡 [J]. 中国煤炭工业医学杂志,2020,23(6):13-18.
[6] 张莹,徐兴森,马兴杰 . MiR-21 对食管癌细胞增殖、凋亡及 PI3K/Akt 信号通路的影响 [J]. 河北医药,2019,41(7):976-980.
[7] 马春兰 . 基于 PI3K/AKT 信号通路探讨雷公藤多苷对肺腺癌 A549 细胞增殖、凋亡、迁移及血管生成的影响 [J]. 安徽医药,2020,4(16):102.
[8] 莫羽,吴菲远,马天仲,等 . miR-21 调控 PI3K/Akt 信号通路诱导宫颈癌细胞凋亡的机制研究 [J]. 广西医科大学学报,2020,37(3):53-59.
[9] 严匡华,陈龙,严风梦 . 下调 miR-21 抑制 PI3K/AKT 信号通路对白血病细胞增殖凋亡的影响 [J]. 中国免疫学杂志,2018,34(3):441-445.
[10] 陈超,张伟丽,冯长松 . lncRNAPCAT19 靶向 miR-143-3p通过信号通路 PI3K/Akt 对甲状腺癌细胞增殖和凋亡的影响及机制 [J]. 中国老年学杂志,2020,40(8):1712-1717.
[11] 王衡,陈蓉,白瑞瑞,等 . MEG3-miR-455-PI3K/Akt 信号通路对大脑中动脉闭塞小鼠模型缺氧损伤神经干细胞的影响[J]. 中西医结合心脑血管病雜志,2021,19(17):2921-2928.
[12] 韦维,黄海舸,陆佳明,等 . microRNA-124 对胃癌细胞增殖与凋亡的影响及其与 PI3K/Akt 信号通路的关系 [J]. 中国普通外科杂志,2020,29(6):723-730.
(收稿日期:2021-10-23)

