葛根淀粉合成关键酶活性动态及其与块根产量和淀粉积累的相关性研究
郭丽君 羽健宾 肖冬 何龙飞 王爱勤
摘要: 為探讨葛根发育过程中淀粉合成关键酶活性与块根产量和淀粉积累的关系,以初步揭示其内在的生理机制。该研究以‘桂葛1号’粉葛和‘桂葛8号’野葛为材料,采取生理测定法对农艺性状、直链和支链淀粉的含量、淀粉合成关键酶活性等进行测定,并对葛根发育过程中淀粉合成关键酶活性、农艺性状和淀粉含量动态变化的关系进行相关性分析。结果表明:(1)块根发育过程中,两品种葛根腺苷二磷酸葡萄糖焦磷酸化酶(AGPase)、可溶性淀粉合成酶(SSS)、束缚性结合淀粉合成酶(GBSS)和淀粉分支酶(SBE)的活性呈现先增大后降低的单峰曲线变化,与直链淀粉、支链淀粉和总淀粉含量由缓慢增长到快速增长后趋于稳定的变化趋势基本一致,即在块根形成期至膨大期逐渐增长,至膨大后期达到最大,之后迅速下降,至成熟期缓慢下降,并维持在较高水平。(2)‘桂葛8号’的淀粉含量和产量显著高于‘桂葛1号’,其酶活性也均显著高于‘桂葛1号’。(3)葛块根的根长、根粗、单株重、干物质含量、产量表现为“缓慢-快速-稳定”的变化趋势,淀粉含量表现出类似变化。(4)相关性分析结果显示,4个淀粉合成关键酶活性与块根直链淀粉、支链淀粉及总淀粉含量、根长均呈显著或极显著正相关,与单株重、产量、干物质含量及根粗呈正相关,但差异不显著。综上认为,淀粉含量增加是葛根生长膨大增粗的结果,提高AGPase、SSS、GBSS和SBE的酶活性和竞争底物的能力,可提高葛根淀粉及其组分的积累,从而提高产量和品质。
关键词: 葛根, 关键酶, 酶活性, 淀粉积累, 相关性
中图分类号: Q945文献标识码: A文章编号: 1000-3142(2022)04-0639-09
Dynamics of key enzyme activity in starch synthesis and its correlation with yield and starch accumulation of root tubers in Kudzu
GUO Lijun YU Jianbin XIAO Dong HE Longfei WANG Aiqin
( 1. College of Agriculture, Guangxi University, Nanning 530004, China; 2. Guangxi Institute of Botany, Guangxi Zhuang
Autonomous Region and Chinese Academy of Sciences, Guilin 541006, Guangxi, China )
Abstract: The purpose of this study was to explore the key enzyme activity of starch synthesis and its relation with yield and starch accumulation during the development of Kudzu root, and to reveal the intrinsic physiological mechanism. With ‘Guige 1’ (Pueraria montana var. thomsonii) and ‘Guige 8’(P. montana var. lobata) as materials, we determined the agronomic traits, the content of amylose and amylopectin, and the key enzyme activity of starch synthesis, and analyzed their relationship of dynamic changes. The results were as follows: (1) During the development of root tubers, the activity changes of ADP-glucose pyrophosphorylase (AGPase), soluble starch synthase (SSS), granule-bound starch synthase (GBSS) and starch branching enzyme (SBE) in two varieties of P. lobata showed a single peak curve that first increased and then decreased, it was basically consistent with the trend that the contents of amylose, amylopectin and total starch increased from slow to rapid and then stabilizing, that was, from formation period to expansion period, they increased gradually; they reached the maximum in the later expansion stage and declined rapidly in a later; to the maturity stage, they declined gradually and maintained at a higher level. (2) The yield and starch content of ‘Guige 8’ were significantly higher than those of ‘Guige 1’, the enzyme activity of ‘Guige 8’ was also significantly higher than that of ‘Guige 1’. (3) The average length and width of root tubers, fresh weight per plant, dry matter content and yield showed a trend of “slow-fast-stable”, and starch content showed similar changes. (4) Correlation analysis showed that four key enzyme activities of starch synthesis were significant or highly significant positively correlated with the contents of amylose, amylopectin and total starch and the average length of root tubers; they were positively correlated with the fresh weight per plant, yield, dry matter content and the width of root tubers, but the difference was not significant. On the whole, the increase of starch content is the result of swelling and thickening of Kudzu root. Improving the enzyme activities of AGPase, SSS, GBSS and SBE and the ability to compete for substrates can improve the accumulation of Kudzu root starch and its components, thereby improving the yield.
Key words: Kudzu root, key enzyme, enzyme activity, starch accumulation, correlation
葛(Pueraria montana)隶属豆科蝶形花亚科,葛根为葛的地下块根,富含淀粉和异黄酮,是中国、日本、泰国等亚洲国家传统的药食两用植物,具较高的经济价值和较大的市场潜力(Keung, 2002;郝建平等,2016)。块根中直链淀粉和支链淀粉含量是衡量葛根淀粉品质的重要指标(张海艳等,2006;黄斌全,2012)。腺苷二磷酸葡萄糖焦磷酸化酶(ADP-glucose pyrophosphorylase,缩写为AGPase),它是植物淀粉生物合成过程中的第一个关键酶和限速酶(Slattery et al., 2000);可溶性淀粉合成酶(soluble starch synthase,缩写为SSS),参与支链淀粉的合成;束缚性结合淀粉合成酶(granule-bound starch synthase,缩写为GBSS),参与直链淀粉的合成(时岩玲和田纪春,2003);淀粉分支酶(starch branching enzyme,缩写为SBE),它与SSS共同作用进行支链淀粉的合成(Hirose & Terao, 2004)。
淀粉合成相关酶类和淀粉的关系有一定的研究。在氮饥饿下,浮萍AGPase活性显著升高,与ADP-Glc快速积累结果一致,ADPG和淀粉含量的增加是糖异生和TCA途径产量增加的结果(Yu et al., 2017)。玉米授粉后10~25 d,种子直链淀粉逐渐增加,与GBSS活性增强结果一致(Guo et al., 2006)。青稞籽粒灌浆期,AGPase、SSS、GBSS和SBE活性呈单峰曲线变化,与直链淀粉、支链淀粉及总淀粉含量呈缓慢增长至快速增长后趋于稳定的变化趋势一致(郑许光等,2018)。他们还发现,直链淀粉含量高的品种,GBSS活性较高;支链淀粉含量高的品种,SSS活性较高。AGPase和GBSS活性与直链淀粉积累速率显著正相关,而AGPase、SSS和SBE活性与支链淀粉积累速率显著正相关(郑许光等,2018)。木薯不同品种块根AGPase的活性与支链淀粉和总淀粉含量呈极显著正相关,可作为衡量块根淀粉积累能力的指标(闵义,2010)。高淀粉木薯品种的AGPase活性均高于低淀粉品种(冯燕,2015)。本研究的前期研究发现‘桂葛1号’在产量、淀粉、可溶性糖、葛根素和纤维素含量方面均显著低于‘桂葛8号’(张静等,2017),而且‘桂葛1号’块根支链淀粉含量、总淀粉含量和光合参数总体上也低于‘桂葛8号’,但直链淀粉含量刚好相反(郭丽君等,2018)。葛根发育过程中淀粉合成关键酶活性动态与产量和淀粉积累的关系未见报道。因此,本研究以‘桂葛1号’和‘桂葛8号’为材料,分析葛根发育过程中淀粉合成关键酶活性与产量和淀粉积累的相关性,初步揭示內在的生理机理,为提高葛根淀粉含量和改良品质提供依据。
1材料与方法
1.1 材料
供试材料为广西大学农学院薯类课题组选育,经王爱勤教授鉴定的食用型粉葛(Pueraria montana var. thomsonii)‘桂葛1号’和药食兼用型野葛(P. montana var. lobata) ‘桂葛8号’品种,2016年种植于广西大学农学院教学科研基地,每个品种设置3个小区,每个小区35株。2016年3月中旬进行扦插育苗,4月中旬将生根的扦插苗移栽到大田,6—7月为块根形成期,7—8月为块根膨大初期,8—9月为块根膨大中期,9—10月为块根膨大后期,11—12月为块根成熟期。种植行距1.2 m、株距0.65 m,试验田基肥施用复合肥900 kg·hm,实行常规田间管理。
1.2 方法
1.2.1 取样和预处理2016年6—12月,每月分别选取每小区生长相对一致、健壮的植株各2株(3个重复共6株)。采挖地下块根,测其单株鲜重,取块根中部材料切薄片,每品种块根分成两组。一组,称取3份等量的块根薄片于干净干燥的培养皿中,105 ℃下杀青30 min,65 ℃下烘干至恒重,对干物质含量进行测定后分别粉碎,将粉样先过100目筛,再用于直链淀粉和支链淀粉的含量测定;另一组,取新鲜的块根置于液氮中速冻后,在超低温(-80 ℃)冰箱中保存,用于淀粉合成关键酶活性的测定。
1.2.2 农艺性状测定用米尺测定根长,用游标卡尺测定根粗,单株鲜重和干物质含量采用天平测量法测定,产量(kg·hm)=(单株鲜重kg×667 m2×15)/(行距m × 株距m)。
1.2.3 直链、支链淀粉含量测定淀粉含量参照何照范(1985)和蒋卉等(2013)的双波长法测定。直链和支链淀粉标准样品均购自北京索莱宝公司。直链淀粉含量测定以600 nm为测定波长,496 nm为参比波长,支链淀粉含量测定以546 nm为测定波长,700 nm为参比波长。吸光值测定仪器为UV-2450型紫外分光光度计。总淀粉含量(%)=支链淀粉含量(%)+直链淀粉含量(%)。
1.2.4 淀粉合成关键酶活性测定参考程方民等(2003)的方法提取粗酶液。称取新鲜块根1 g,加入5 mL预冷的提取缓冲液(50 mmol·L Hepes-NaOH、pH 7.5、8 mmol·LMgCl2、2 mmol·L EDTA、10 g·L PVP-40、1 mmol·L DTT),冰浴下磨成匀浆,将匀浆置于10 mL的离心管内,10 000 r·min(4 ℃)下离心30 min,将上清液用于AGPase、SSS、SBE活性测定;在沉淀中加入5 mL提取缓冲液,重悬后用于GBSS活性测定。
参照沈鹏等(2006)的方法测定AGPase、SSS和GBSS活性。使用酶标仪在340 nm波长处测定吸光值,以每1 min增加0.01OD值作为酶活性单位(U);SBE活性测定参照Nakamura等(1989)及李太贵等(1997)的方法,用酶标仪在660 nm波长处测定吸光值,以每1 min降低1%碘蓝值为酶活单位(U)。
1.3 数据统计分析
使用软件Excel 2013和软件SPSS 21.0对试验所取得的数据进行处理和相关性分析。
2结果与分析
2.1 葛根在发育过程中块根的农艺性状变化
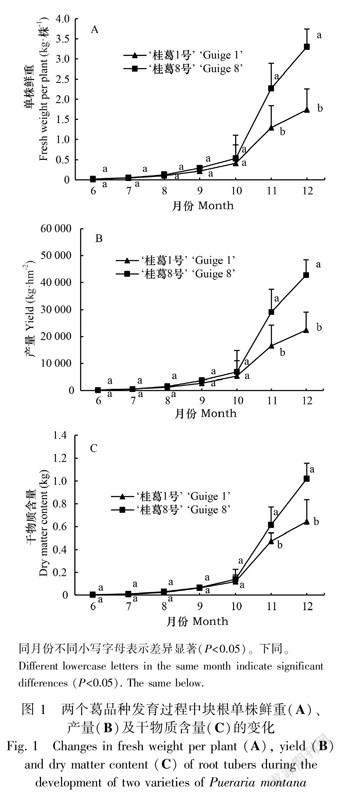
2.1.1 葛块根单株鲜重、产量和干物质含量的变化从图1可以看出,在块根的膨大发育过程中,两个葛品种的单株鲜重、产量和干物质含量的变化趋势基本一致。具体表现为块根形成期至膨大后期(6—10月)3项指标较低,增幅缓慢,膨大后期至成熟期(9—12月)3项指标快速增加,并在成熟期(11—12月)差异达到显著水平。在单株鲜重、产量和干物质含量的绝对值上,均为‘桂葛8号’>‘桂葛1号’;3项指标在12月达到最高值时,‘桂葛8号’分别是‘桂葛1号’的1.9倍、1.9倍和1.58倍。表明‘桂葛8号’具有更好的产量优势。
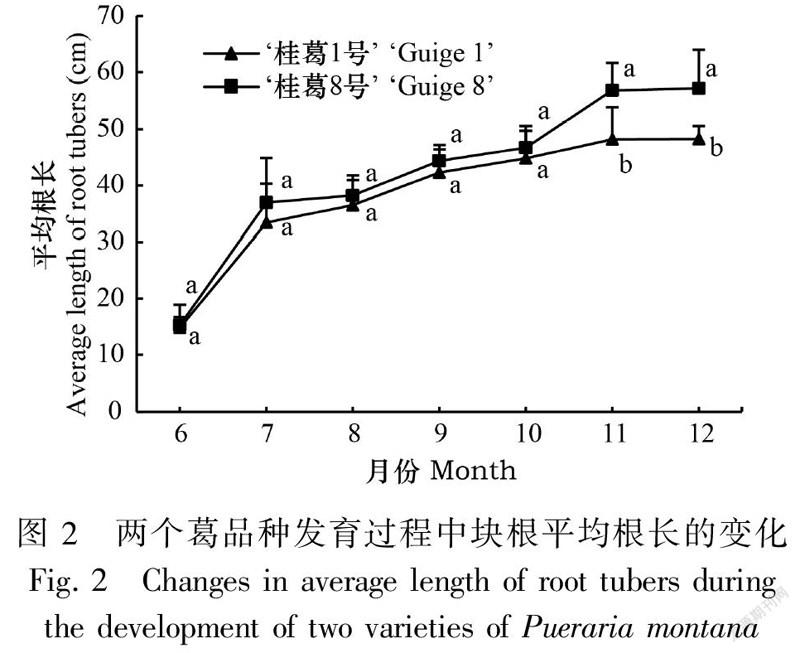
2.1.2 葛块根的根长变化在块根生长发育过程中,两个葛品种块根的平均根长发生变化,具体表现为块根形成期(6—7月)快速增加,块根膨大初期至后期(7—10月)缓慢增加,膨大后期至成熟期(10—11月)快速增加,成熟期(11—12月)趋于稳定。‘桂葛8号’绝对值显著高于‘桂葛1号’,在12月达到最大值时,‘桂葛8号’是‘桂葛1号’的1.19倍(图2)。
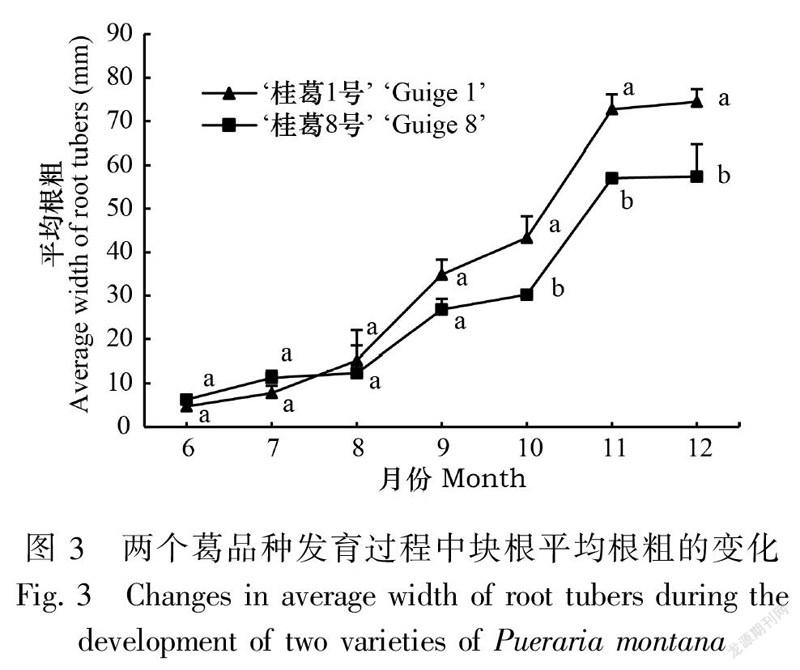
2.1.3 葛块根的根粗变化在块根发育过程中,两品种块根的平均根粗表现如下:块根形成期至膨大初期(6—8月)缓慢增加,膨大中期至成熟期(8—11月)快速增加,成熟期(11—12月)达到最大值后趋于稳定;除在形成期(6—7月)‘桂葛8号’略大于‘桂葛1号’,但差异不显著,其余各时期‘桂葛1号’均明显大于‘桂葛8号’,并在膨大后期之后差异显著(图3)。
2.2 葛根在发育过程中块根的直链淀粉、支链淀粉及总淀粉含量的变化
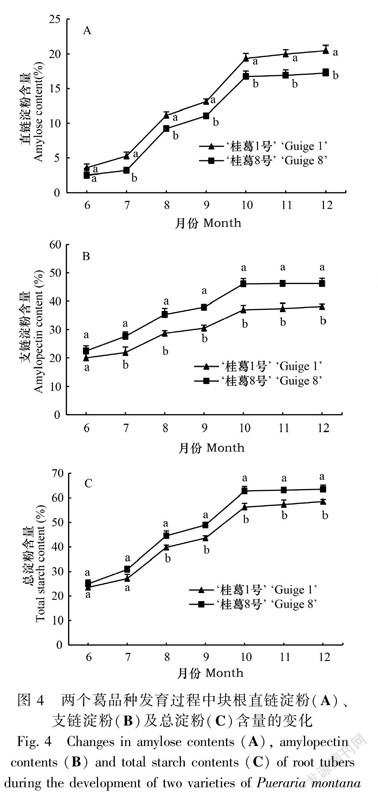
在块根发育过程中,两个品种块根的直链淀粉含量、支链淀粉含量和总淀粉含量均逐渐增加(图4)。具体表现:块根形成期(6—7月)增幅缓慢;块根膨大期(7—10月)增幅快速;块根膨大后期至成熟期(10—12月)增幅小,趋于稳定,维持在较高水平。品种之间除直链淀粉含量表现为‘桂葛1号’>‘桂葛8号’外,支链淀粉和总淀粉含量均表现为‘桂葛8号’>‘桂葛1号’;3项指标除了在块根形成期(直链淀粉和支链淀粉含量在6月,总淀粉含量在6—7月)差异不显著外,其余各时期差异达显著水平。12月达最高值时,‘桂葛1号’直链淀粉含量是‘桂葛8号’的1.19倍,而‘桂葛8号’支链淀粉含量和总淀粉含量分别是‘桂葛1号’的1.21倍和1.08倍。
2.3 葛根在发育过程中块根淀粉合成关键酶活性的变化
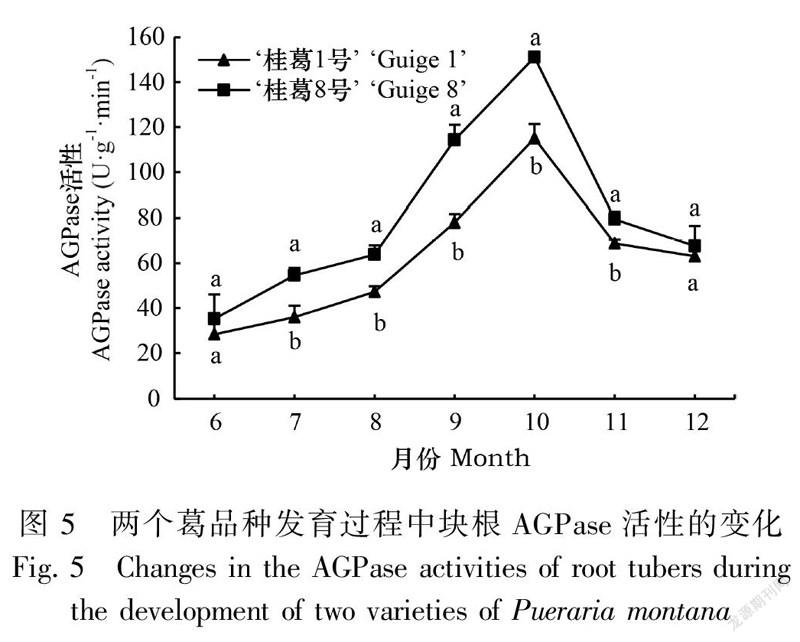
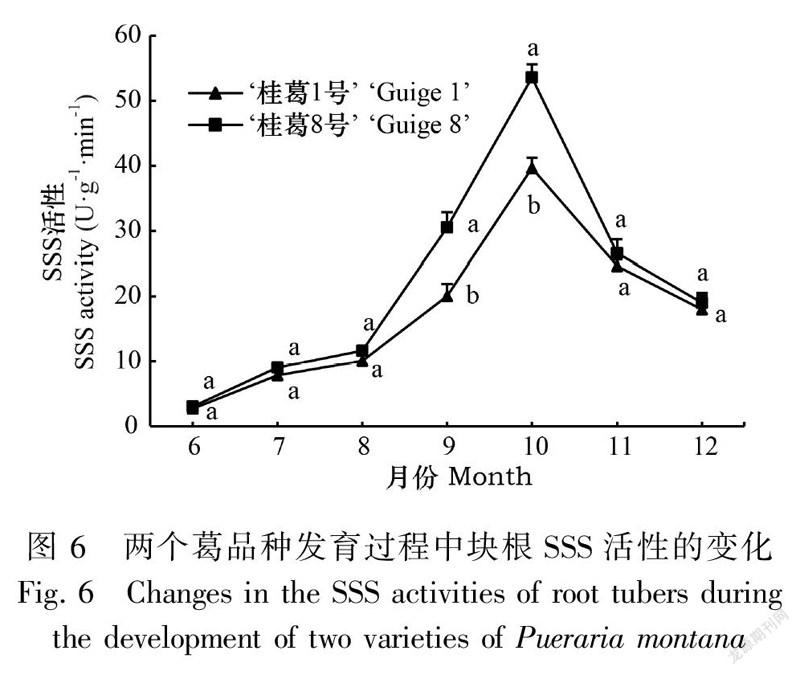
2.3.1 葛块根AGPase和SSS活性的变化由图5和图6可知,在块根发育过程中,两品种块根AGPase和SSS活性呈单峰曲线变化,均表现如下:块根形成期至膨大初期(6—8月)酶活性较低,增幅较慢;块根膨大中后期(8—10月)酶活性提高迅速,增幅最大,并在10月达到最高值,AGPase和SSS活性的最高值表现为‘桂葛8号’分别是‘桂葛1号’的1.31倍和1.35倍;膨大后期至成熟期(10—11月)迅速下降,成熟期(11—12月)降幅缓慢,两品种的AGPase和SSS活性均维持在较高水平,‘桂葛8号’绝对值高于‘桂葛1号’。两品种AGPase活性除了在块根形成期(6月)和成熟期(12月)差异不显著外,其余各时期差异显著;SSS活性在块根膨大中后期(9—10月)差异显著,其余各时期均差异不显著。
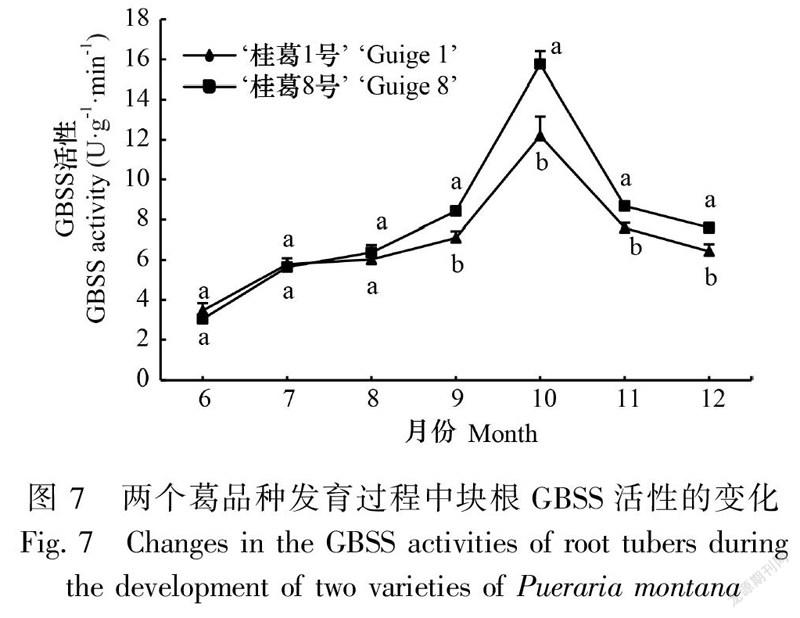
2.3.2 葛块根GBSS活性的变化在块根发育过程中,两品种块根GBSS活性变化趋势基本一致,即均呈单峰曲线变化,表现为块根形成期至膨大中期(6—9月)缓慢增高,块根膨大后期(9—10月)迅速提高,增幅最大,并在10月达到最高值之后迅速下降,到成熟期(11—12月)GBSS活性缓慢降低,并维持在较高水平。块根形成期至膨大初期(6—8月)两品种块根GBSS活性表现为‘桂葛1号’略高于‘桂葛8號’,但差异不显著,块根膨大中期至成熟期(9—12月)则刚好相反,均为‘桂葛8号’绝对值显著高于‘桂葛1号’,GBSS活性最高值时,‘桂葛8号’是‘桂葛1号’的1.29倍(图7)。
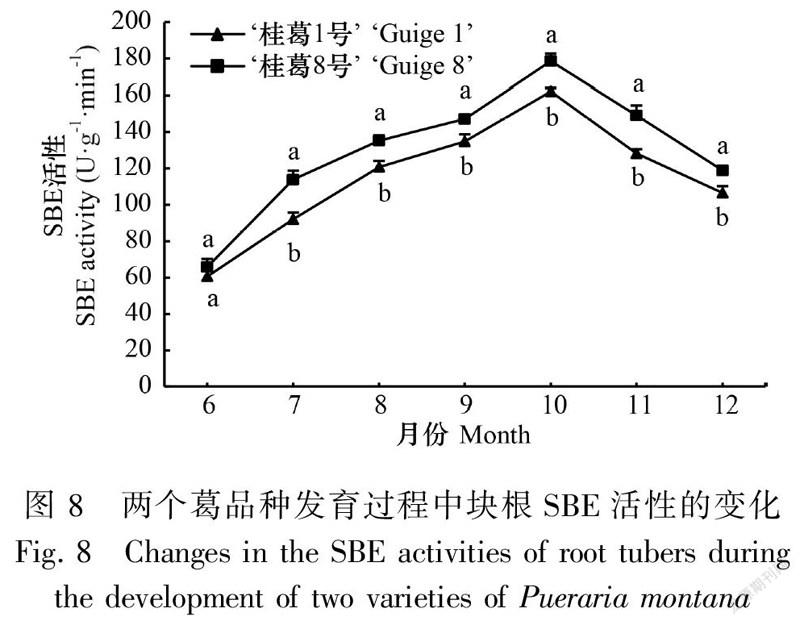
2.3.3 葛块根SBE活性的变化在块根发育过程中,两品种块根SBE活性变化趋势基本一致,即均呈单峰曲线变化,表现为块根形成期至膨大期(6—10月)持续不断增高,并在膨大后期(10月)达到最高值之后迅速下降(10—12月),成熟期(12月)仍维持在较高水平。除6月份两个品种的差异不显著外,其余各时期均差异显著,‘桂葛8号’绝对值显著高于‘桂葛1号’,SBE活性最高值时,‘桂葛8号’是‘桂葛1号’的1.1倍(图8)。
2.4 相关性分析
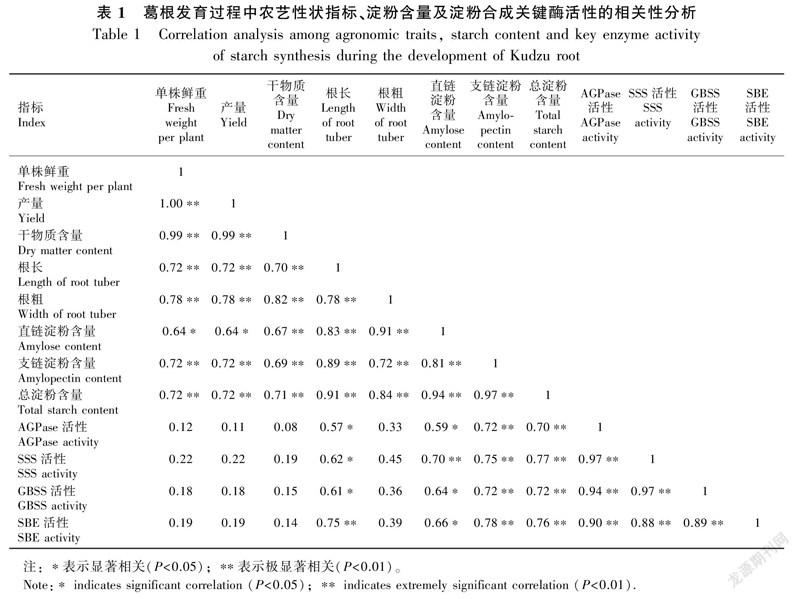
综合两个品种的指标值进行相关性分析,结果表明(表1),葛根AGPase、SSS、GBSS和SBE的活性均与块根单株鲜重、产量、干物质含量及根粗呈正相关,但差异未达显著水平,与根长、直链淀粉、支链淀粉及总淀粉含量均呈显著、极显著正相关。块根的根长、根粗与块根单株鲜重、产量、干物质含量、直链淀粉、支链淀粉及总淀粉含量均呈极显著正相关。
3讨论与结论
3.1 葛根生长发育与淀粉积累的关系
块茎块根是重要的经济器官。不同木薯品种块根根长、根粗、鲜重、干重、直链淀粉、支链淀粉及总淀粉含量均随块根发育呈先缓慢增加后快速增大至趋于稳定或缓慢下降的变化趋势(闵义,2010)。在甘薯块根发育过程中,块根干物质含量和淀粉含量呈逐渐增加至趋于稳定的曲线变化,且两者呈极显著正相关(吕长文等,2011)。在山药块茎发育过程中,山药块茎的长、宽、单株鲜重和淀粉含量变化为块茎形成期缓慢增加,膨大前期、中期快速增加,膨大后期达到最大值后,成熟期趋于稳定或缓慢下降(罗海玲等,2018)。淀粉来源于光合作用,淀粉积累的差异应与光合作用密切相关。研究表明,山药块茎的发育及其淀粉的积累与叶光合效率、淀粉合成关键酶活性密切相关,山药块茎中淀粉含量在成熟期下降,原因可能是部分淀粉转化为糖,而表现出淀粉含量下降,糖分上升(梁任繁等,2011)。葛根支链淀粉、总淀粉含量与光合特性呈显著、极显著正相关,单株重、干物质含量和直链淀粉含量与光合特性呈正相关(郭丽君等,2018)。
本研究结果与其他薯类作物的结果一致(罗海玲等,2018)。葛块根的根长、根粗、单株重、干物质含量、产量表现出“缓慢-快速-稳定”的变化趋势,淀粉含量表现出类似变化,表明淀粉是葛块根的主要组成物质,而‘桂葛8号’产量和干物质含量显著高于‘桂葛1号’,根长、根粗与单株鲜重、产量、干物质含量、直链淀粉、支链淀粉及总淀粉含量均呈极显著正相关,说明淀粉含量增加是葛根生长增粗的结果。因此,提高光合效率和淀粉积累是提高葛根产量的重要途径。
3.2 葛根淀粉积累与淀粉合成关键酶的关系
淀粉合成涉及AGPase、SSS、GBSS和SBE等系列关键酶。前人研究表明,马铃薯、青稞、糜子和小麦等多数作物的贮藏器官中AGPase、SSS、GBSS和SBE活性均为先增大后降低的单峰曲线变化(甘晓燕等,2017;郑许光等,2018;陈光华等,2019),而AGPase虽然影响淀粉积累速率,但和淀粉及其组分的合成积累并无关系(Nakamura et al., 1996; 王芳和王宪泽,2004;左振朋等,2011)。马铃薯高淀粉品种的AGPase、SSS、GBSS和SBE活性高于低淀粉品种,与高淀粉品种的直链淀粉和支链淀粉含量均高于低淀粉品种一致(吕文河等,2017),SSS与SBE活性在不同器官中呈显著或极显著负相关,在支链淀粉的合成与积累过程中彼此起到反馈调节的作用(唐宏亮等,2015)。木薯块根AGPase活性在块根发育过程中呈先增大后降低的单峰曲线变化,与其直链淀粉、支链淀粉和总淀粉含量由快速增加到缓慢增加或趋于稳定的趋势一致,高淀粉品种的AGPase活性均高于低淀粉品种,与淀粉含量呈正相关(冯燕,2015)。山药块茎膨大期AGPase和SSS活性呈双峰曲线变化,高淀粉品种高于低淀粉品种,与块茎直链淀粉、支链淀粉和总淀粉含量呈先升高后下降、高淀粉品种的直链淀粉含量高于低淀粉品种的趋势一致;其AGPase活性与直链淀粉和总淀粉含量呈极显著正相关,与支链淀粉含量呈负相关,SSS活性与直链淀粉、支链淀粉和总淀粉含量呈正相关(赵令敏等,2019)。非糯小麦和糯小麦AGPase、SSS、GBSS和SBE活性与其直链淀粉和总淀粉含量呈“缓慢-快速-缓慢”的增长变化趋势一致,且非糯小麦的AGPase和GBSS活性高于糯小麦,与其直链淀粉和总淀粉含量高于糯小麦的结果相吻合,而非糯小麦的SSS和SBE活性低于糯小麦;籽粒AGPase和SSS活性与籽粒支链淀粉和总淀粉含量呈极显著正相关,与直链淀粉含量呈正相关,GBSS活性与直链淀粉、支链淀粉和总淀粉含量均呈极显著正相關,SBE活性与支链淀粉和总淀粉含量呈正相关,与直链淀粉含量呈负相关(Zi et al., 2018)。
本研究结果表明,葛块根AGPase、SSS、GBSS和SBE活性呈先增大后降低的单峰曲线变化,与直链淀粉、支链淀粉和总淀粉含量由缓慢增长到快速增长后趋于稳定的变化基本一致,在膨大后期达到最大值后,AGPase、SSS、GBSS和SBE活性下降,与其直链淀粉、支链淀粉和总淀粉含量则不再增长维持在较高水平相对应。块根AGPase、SSS、GBSS和SBE活性与直链淀粉、支链淀粉、总淀粉含量呈显著和极显著正相关,且高淀粉品种的酶活性显著高于低淀粉品种。这些结果与前人报道的高淀粉品种间支链淀粉和总淀粉含量显著高于低淀粉品种相吻合(冯燕,2015;吕文河等,2017),说明块根块茎直链淀粉和支链淀粉的合成可能由AGPase、SSS、GBSS和SBE共同作用完成。但葛根AGPase和淀粉及其组分的合成积累呈显著正相关,SSS与SBE在发育过程中呈显著正相关关系,直链淀粉含量为‘桂葛1号’品种显著高于‘桂葛8号’品种,与‘桂葛8号’的4个酶活性显著高于‘桂葛1号’的趋势相反,与前人报道相反(赵令敏等,2019)。可能使用品种、当地气候条件不同,对淀粉合成关键酶活性影响也不同(Azoulay-Shemer et al., 2018;成臣等,2019;Prathap et al., 2019;Dong et al., 2019),也可能与淀粉代谢途径中其他的关键酶基因家族成员及其淀粉酶的降解能力有关(宋健民等,2009;谭彩霞,2009;李明月,2017;郑许光等,2018)。‘桂葛8号’SSS与SBE彼此协同竞争ADPG底物合成与积累支链淀粉的能力可能强于GBSS合成与积累直链淀粉能力,而‘桂葛1号’的GBSS相对SSS、SBE竞争底物能力较强,导致尽管‘桂葛8号’GBSS活性显著高于‘桂葛1号’,但由于底物不足,最终产生的直链淀粉含量较低的结果。综上所述,葛根直链淀粉和支链淀粉含量差异是GBSS和SSS、SBE两种酶同时竞争底物的结果,而竞争底物的能力可能与SSS和SBE活性是协同还是反馈调节有关(唐宏亮等,2015)。因此,可通过调控葛根淀粉合成关键酶的活性以提高淀粉组分含量和产量,达到高产高淀高质的目标。
参考文献:
AZOULAY-SHEMER T, SCHWANKL N, ROG I, et al., 2018. Starch biosynthesis by AGPase, but not starch degradation by BAM1/3 and SEX1, is rate-limiting for CO2 -regulated stomatal movements under short-day conditions [J]. FEBS Lett, 592: 2739-2759.
CHEN GH, HAN HK, MA HC, et al., 2019. Characteristics of protein and starch accumulation and the dynamic changes of key enzymes during grain filling of proso millet (Panicum miliaceum L.) [J]. J Chin Agric Univ, 24(7): 28-36. [陈光华, 韩浩坤, 马洪驰, 等, 2019. 糜子籽粒形成过程中蛋白质、淀粉积累与相关合成酶特性 [J]. 中国农业大学学报, 24(7): 28-36.]
CHENG C, ZENG YJ, CHENG HH, et al., 2019. Effects of different temperature from full heading to milking on grain filling stage on grain hormones concentrations, activities of enzymes involved in starch synthesis and accumulation in rice Nanjing 9108 [J]. Chin J Rice Sci, 33(1): 57-67. [成臣, 曾勇军, 程慧煌, 等, 2019. 齐穗至乳熟期不同温度对水稻南粳9108籽粒激素含量、淀粉积累及其合成关键酶活性的影响 [J]. 中国水稻科学, 33(1): 57-67.]
CHENG FM, ZHONG LJ, SUN ZX, 2003. Effect of temperature at grain-filling stage on starch biosynthetic metabolism in developing rice grains of early-indica [J]. Sci Agric Sin, 36(5): 492-501. [程方民, 钟连进, 孙宗修, 2003. 灌浆结实期温度对早籼水稻籽粒淀粉合成代谢的影响 [J]. 中国农业科学, 36(5): 492-501.]
DONG MY, FAN XW, LI YZ, 2019. Cassava AGPase genes and their encoded proteins are different from those of other plants [J]. Planta, 250(5): 1621-1635.
FENG Y, 2015. Different kinds of cassavas starch accumulation research on physiological and biochemical characteristics [D]. Nanning: Guangxi University. [冯燕, 2015. 不同木薯品种淀粉积累的生理生化特性研究 [D]. 南宁: 广西大学.]
GAN XY, GONG L, ZHANG L, et al., 2017. Analysis of starch accumulation and key enzymes activities for starch sysnthesis in potato [J]. Mol Plant Breed, 15(11): 4625-4628. [甘晓燕, 巩檑, 张丽, 等, 2017. 马铃薯块茎淀粉积累及相关酶活性的研究 [J]. 分子植物育种, 15(11): 4625-4628.]
GUO LJ, ZHANG J, XIAO D, et al., 2018. Relationship between photosynthesis characteristics and starch accumulation of Pueraria lobata during different growth stages [J]. J S Agric, 49(4): 662-668. [郭麗君, 张静, 肖冬, 等, 2018. 不同生长时期葛根光合特性及其与淀粉积累的关系 [J]. 南方农业学报, 49(4): 662-668.]
GUO SJ, LI JR, QIAO WH, et al., 2006. Analysis of amylose accumulation during seed development in maize [J]. Acta Genet Sin, 33(11): 1014-1019.
HAO JP, WANG F, SONG Q, et al., 2016. Study on distribution and botany characteristics of Pueraria lobata (Willd.) Ohwi from Shanxi [J]. J Plant Genet Resour, 17(1): 39-44. [郝建平, 王峰, 宋强, 等, 2016. 山西省野葛种质资源分布与植物学性状研究 [J]. 植物遗传资源学报, 17(1): 39-44.]
HE ZF, 1985. Grain quality of cereal and oil and its analytical technology [M]. Beijing: Agriculture Press: 275-297. [何照范, 1985. 粮油籽粒品质及其分析技术 [M]. 北京: 农业出版社: 275-297.]
HIROSE T, TERAO T, 2004. A comprehensive expression analysis of the starch synthase gene family in rice (Oryza sativa L.) [J]. Planta, 220: 9-16.
HUANG BQ, 2012. Functions of key enzymes:AGPase and isoamylase involved in maize starch biosynthesis [D]. Ya’an: Sichuan Agricultural University. [黄斌全, 2012. 玉米淀粉合成关键酶: AGPase和isoamylase的功能研究 [D]. 雅安: 四川农业大学.]
JIANG H, HU ZZ, 2013. Determination of amylose and amylopectin content in indica rice by dual-wavelength spectrophotometry [J]. Cereal Feed Ind, (2): 22-25. [蒋卉, 胡中泽, 2013. 双波长法测定籼米中直链淀粉和支链淀粉含量 [J]. 粮食与饲料工业, (2): 22-25.]
KEUNG WM, 2002. Pueraria: The genus Pueraria [M]. New Jersey: Crc Press: 51-55.
LI MY, 2017. Comparison analysis of expression characteristics and promoter sequence structures of starch branching enzyme gene in rice [D]. Harbin: Northeast Agricultural University. [李明月, 2017. 水稻淀粉分支酶基因表达特性及启动子结构比较分析 [D]. 哈尔滨: 东北农业大学.]
LI TG, SHEN B, CHEN N, et al., 1997. Effect of Q-Enzyme on the chalkiness formation of rice grain [J]. Acta Agron Sin, 23(3): 338-344. [李太貴, 沈波, 陈能, 等, 1997. Q酶在水稻籽粒垩白形成中作用的研究 [J]. 作物学报, 23(3): 338-344.]
LIANG RF, LI CZ, ZHANG J, et al., 2011. Changes of matter accumulation and relative enzymatic activity during yam tuber development [J]. Acta Agron Sin, 37(5): 903-910. [梁任繁, 李创珍, 张娟, 等, 2011. 山药块茎发育中物质积累及相关代谢酶变化 [J]. 作物学报, 37(5): 903-910.]
LUO HL, GONG MX, ZHOU YY, et al., 2018. Analysis of starch accumulation and differentially expressed proteins during the development of Chinese yam tuber [J]. J S Chin Agric Univ, 39(6): 61-69. [罗海玲, 龚明霞, 周芸伊, 等, 2018. 山药块茎发育过程中淀粉积累及差异蛋白分析 [J]. 华南农业大学学报, 39(6): 61-69.]
L CW, WANG JC, TANG DB, et al., 2011. Dynamic characteristics of carbohydrate synthesis and accumulation in tuberous roots of sweet potato [J]. J Chin Cereals Oils Assoc, 26(2): 23-27. [吕长文, 王季春, 唐道彬, 等, 2011. 甘薯块根碳水化合物合成与积累动态特性研究 [J]. 中国粮油学报, 26(2): 23-27.]
L WH, HUO DD, LI Y, et al., 2017. Comparison of starch contents and starch synthase activities in different parts of potato tuber [J]. J NE Agric Univ, 48(6): 1-8. [吕文河, 霍丹丹, 李勇, 等, 2017. 马铃薯块茎不同部位淀粉含量及淀粉合成关键酶活性差异比较 [J]. 东北农业大学学报, 48(6): 1-8.]
MIN Y, 2010. The preliminary studies on starch morphology and enzymic activities relating to starch accumulation in cassava storage root [D]. Haikou: Hainan University. [闵义, 2010. 木薯块根淀粉形态发生与积累的酶活性动态初步研究 [D]. 海口: 海南大学.]
NAKAMURA Y, UMEMOTO T, OGATA N, et al., 1996. Starch debranching enzyme (R- enzyme or pullulanase) from developing rice endosperm purification, cDNA and chromosomal localization of the gene [J]. Planta, (199): 209-218.
NAKAMURA Y, YUKI K, PARK SY, et al., 1989. Carbohydrate metabolism in the developing endosperm of rice grains [J]. Plant Cell Physiol, 30(6): 833-839.
PRATHAP V, ALIA K, SINGHA A, et al., 2019. Starch accumulation in rice grains subjected to drought during grain filling stage [J]. Plant Physiol Biochem, 142: 440-451.
SHEN P, JIN ZX, LUO QX, et al., 2006. Relationship between activity of key starch synthetic enzymes during grain filling and quality of eating and cooking in rice [J]. Chin J Rice Sci, 20(1): 58-64. [沈鹏, 金正勋, 罗秋香, 等, 2006. 水稻灌浆过程中籽粒淀粉合成关键酶活性与蒸煮食味品质的关系 [J]. 中国水稻科学, 20(1): 58-64. ]
SHI YL, TIAN JC, 2003. Progress in research of granule-bound starch synthase [J]. J Tritic Crops, 23(3): 119-122. [时岩玲, 田纪春, 2003. 颗粒结合型淀粉合成酶研究进展 [J]. 麦类作物学报, 23(3): 119-122.]
SLATTERY CJ, KAVAKLI IH, OKITA TW, 2000. Engineering starch for increased quantity and quality [J]. Trends Plant Sci, 5(7): 291-298.
SONG JM, LIU AF, CHENG DG,et al., 2009. Effect of different Wx protein combinations on wheat starch biosynthesis in developing endosperm [J]. Sci Agric Sin, 42(3): 765-771. [宋健民, 劉爱峰, 程敦公, 等, 2009. Wx蛋白组成对小麦籽粒淀粉合成的影响 [J]. 中国农业科学, 42(3): 765-771.]
TAN CX, 2009. Expressions of starch synthase genes and starch synthesis in wheat grains [D]. Yangzhou: Yangzhou University. [谭彩霞, 2009. 小麦籽粒淀粉合成酶基因表达与淀粉合成的关系 [D]. 扬州: 扬州大学.]
TANG HL, SHI Y, TIAN X, et al., 2015. Relationship between key enzymes of starch synthesis and tuber starch accumulation [J]. Chin Agric Sci Bull, 31(27): 88-93. [唐宏亮, 石瑛, 田洵, 等, 2015. 马铃薯淀粉合成关键酶与块茎淀粉积累的关系 [J]. 中国农学通报, 31(27): 88-93.]
WANG F, WANG XZ, 2004. Study on the dynamic changes of starch synthesis and their related enzymes in wheat [J]. J Tritic Crops, 24(2): 57-60. [王芳, 王宪泽, 2004. 小麦籽粒淀粉合成动态及其相关酶活性的研究 [J]. 麦类作物学报, 24(2): 57-60.]
YU CJ, ZHAO XW, QI G, et al., 2017. Integrated analysis of transcriptome and metabolites reveals an essential role of metabolic flux in starch accumulation under nitrogen starvation in duckweed [J]. Biotechnol Biofuels, 10: 167.
ZHANG HY, DONG ST, GAO RQ, 2006. The study progress in plant starch [J]. J Chin Cereals Oils Assoc, 21(1): 41-46. [张海艳, 董树亭, 高荣岐, 2006. 植物淀粉研究进展 [J]. 中国粮油学报, 21(1): 41-46.]
ZHANG J, YANG XD, GUO LJ, et al., 2017. Study on the quality of germplasm resources of Pueraria lobata using the method of membership function [J]. J Chin Med Mat, 40(6): 1314-1317. [张静, 杨旭东, 郭丽君, 等, 2017. 利用隶属函数法分析葛根种质资源品质的研究 [J]. 中药材, 40(6): 1314-1317.]
ZHAO LM, SHAO Y, ZHANG YF, et al., 2019. Analysis of key enzyme activity and gene expression in starch synthesis during tuber expansion of yam [J]. J Henan Agric Univ, 53(6): 847-854. [赵令敏, 邵盈, 张艳芳, 等, 2019. 山药块茎膨大期淀粉合成关键酶活性及调控基因的表达分析 [J]. 河南农业大学学报, 53(6): 847-854.]
ZHENG XG, QI JC, WANG F, et al., 2018. Study on the relationship between amylase activity and starch accumulation characteristics in hulless barley at filling stage [J]. Seed, 37(2): 19-28. [郑许光, 齐军仓, 王凤, 等, 2018. 青稞籽粒灌浆期淀粉代谢酶活性与淀粉积累特征的关系研究 [J]. 种子, 37(2): 19-28.]
ZI Y, DING JF, SONG JM, et al., 2018. Grain yield, starch content and activities of key enzymes of waxy and non-waxy wheat (Triticum aestivum L.) [J]. Sci Rep, 8: 4548.
ZUO ZP, TIAN FL, JIANG P, et al., 2011. Comparison of kernel starch accumulation and related enzyme activities among six maize cultivars of different yield types [J]. Acta Agron Sin, 37(3): 529-536. [左振朋, 田凤龙, 姜朋, 等, 2011. 六个不同产量玉米品种籽粒淀粉积累及相关酶活性的比较 [J]. 作物学报, 37(3): 529-536.]
(责任编辑周翠鸣)

