南高丛蓝莓‘奥尼尔’工厂化组培快繁技术研究
夏科 赵志国 吴巧芬 郭伦发 秦洪波 仇硕




摘要: 為了建立南高丛蓝莓‘奥尼尔’工厂化组培快繁技术体系,该文以带腋芽的茎段为外植体,研究外植体灭菌、丛生芽诱导、丛生芽增殖培养、瓶内生根以及移栽驯化。结果表明:(1)外植体最佳灭菌方法为10% NaClO处理15 min,污染率降低至14.44%,诱导率达49.38%;同样添加1.5 mg·LZT,以WPM为基础培养基诱导出的丛生芽明显多于MS。(2)丛生芽增殖的最佳培养基为 WPM+ NAA 0.1 mg·L + ZT 1.5 mg·L ,接种 60 d 后增殖系数达8.6,长势良好;瓶内生根的最佳处理方式为先用500 mg·L IBA浸蘸20 s,然后接种于WPM+IBA 0.2 mg·L的生根培养基中,培养90 d后,生根率、有效生根率、生根数量和根长分别达到96.3%、96.3%、12.7条和43.3 mm,且根系较发达、粗壮。(3)生根苗在移栽基质Ⅰ(河沙∶蛭石∶珍珠岩=1∶1∶1)的移栽成活率最高,达92.22%。以上说明,外植体经10% NaClO处理15 min,利用培养基WPM+ ZT 1.5 mg·L和WPM+ NAA 0.1 mg·L + ZT 1.5 mg·L分别进行丛生芽诱导及增殖;丛生芽经500 mg·L IBA浸蘸20 s,再接种于WPM+IBA 0.2 mg·L 进行生根,生根苗在河沙∶蛭石∶珍珠岩=1∶1∶1的基质移栽驯化,是南高丛蓝莓‘奥尼尔’最适工厂化组培快繁技术体系。该研究结果为今后‘奥尼尔’工厂化种苗快繁奠定了基础。
关键词: 蓝莓, 组培快繁, 丛生芽诱导, 瓶内生根, 移栽驯化
中图分类号: Q946文献标识码: A文章编号: 1000-3142(2022)04-0691-09
Tissue culture and rapid propagation in factory
of southern highbush blueberry ‘O’Neal’
XIA Ke, ZHAO Zhiguo, WU Qiaofen, GUO Lunfa, QIN Hongbo, QIU Shuo
( Guangxi Key Laboratory of Functional Phytochemicals Research and Utilization, Guangxi Institute of Botany, Guangxi
Zhuang Autonomous Region and Chinese Academy of Sciences, Guilin 541006, Guangxi, China )
Abstract: In order to establish a rapid propagation system of southern highbush blueberry ‘O’ Neal’, the stem section with axillary bud were sterilized as explants, induction of shoot cluster, and proliferation of shoot cluster, test-tube rooting, transplanting and domestication were also studied. The results were as follows: (1) The best sterilization treatment was that the explant was treated by 10% NaClO with 15 min, and the contamination rate decreased to 14.44% and the induction rate reached 49.38%; The best medium for induction of shoot cluster was WPM+ ZT 1.5 mg·L. (2) The optimum medium for proliferation of shoot cluster was WPM+ NAA 0.1 mg·L + ZT 1.5 mg·L, and the coefficient of propagation reached 8.6 after subcultured for 60 d; The best treatment for test-tube rooting was that the shoot cluster dipped in 500 mg·L IBA for 20 s firstly, then cultivated them with the medium WPM+IBA 0.2 mg·L, the rooting rate and effective rooting rate all reached 96.3%, and the rooting number and length were 12.7 and 43.3 mm after cultured for 90 d, at the same time, and the root developed well. (3) The survival rate of rooted seedlings reached 92.22% after transplanted in Media Ⅰ(river sand∶vermiculite∶perlite=1∶1∶1). Thus, the best rapid propagation system of southern highbush blueberry ‘O’Neal’ was that: the explant treated by 10% NaClO with 15 min, the shoot cluster was inducted and proliferated with WPM+ ZT 1.5 mg·L and WPM+ NAA 0.1 mg·L + ZT 1.5 mg·Lrespectively; The shoot cluster dipped in 500 mg·L IBA for 20 s and cultivated with WPM+ IBA 0.2 mg·L, and rooted seedlings were transplanted in media(river sand∶vermiculite∶perlite=1∶1∶1). The results play a foundation for providing rapid propagation seedlings and factory production of ‘O’Neal’ in the future.
Key words: blueberry, tissue culture and rapid propagation, induction of shoot cluster, test-tube rooting, transplanting and domestication
蓝莓(Vacciniums pp.)属杜鹃花科(Ericaceae)越橘属,为多年生落叶或常绿浆果类灌木(方瑞征,1986)。蓝莓果实呈深蓝色,果肉细腻、酸甜、风味独特,蓝莓果浆中富含大量的脂肪、蛋白质和碳水化合物等成分,具有较高的营养价值;此外,果浆中还含有较高的花青素、黄酮类、多酚类和多种维生素等,具有改善视力、抗氧化及抗癌等保健和药用功效(Bornsek et al., 2012)。因此,蓝莓被国际粮农组织列为人类五大健康食品之一(Kader et al., 1996),被誉为“水果皇后”,具有较高的深加工应用前景。蓝莓‘奥尼尔’属南高丛品种,果实品质优良,产量较高,经近几年的推广种植发现,该品种比较适合在广西桂北地区发展,特别适合鲜果销售或观光采摘。
目前,国内对蓝莓的组培快繁技术研究已有较多报道,如高丛蓝莓(刘庆忠和赵红军,2002)和兔眼蓝莓(董朝莉,2009;李丽容和金开正,2010)等。胡选萍等(2018)總结了外植体的灭菌、培养基的选择、诱导再生及增殖、试管苗生根等。蓝莓外植体灭菌多采用0.1%的升汞处理,但容易引起残留而影响其生长,而NaClO处理蓝莓可以降低污染率,提高诱导率(王小敏等,2020)。不同的生长调节剂对蓝莓‘奥尼尔’丛生芽增殖系数影响较大,使用ZT的效果要好于6-BA、TDZ或2iP等(陈冰心等,2014;岳健等,2015),但ZT使用浓度过高会导致丛生芽长势弱且出现玻璃化(陈冰心等,2014)。因此,如何提高蓝莓‘奥尼尔’的增殖系数,同时又能保持较好的生长势一直是亟待解决的关键问题之一。蓝莓组培苗瓶内生根相对困难,多采用瓶外生根,王雪娇等(2017)报道蓝莓‘美登’瓶外生根率达78%,而蓝莓‘奥尼尔’瓶外生根率不足60%(朱世银等,2016),因此,如何突破蓝莓‘奥尼尔’生根相对困难的瓶颈也是需要解决的关键问题。蓝莓品种繁多,不同基因型瓶内生根对培养基和外源生长调节剂的种类及浓度要求均不同(孙书伟,2009;阳翠等,2016),因此,蓝莓‘奥尼尔’能否诱导出数量众多、根系健壮的生根苗是工厂化组培快繁技术研究的关键环节。鉴于此,本研究以蓝莓‘奥尼尔’带腋芽的茎段为外植体,研究外植体的灭菌方法,筛选适合丛生芽增殖的培养基及生长调节剂,并研究提高瓶内生根率及移栽成活率等关键技术,为生产优质种苗提供工厂化组培快繁技术体系。
1材料与方法
1.1 试验材料
供试的南高丛蓝莓优良品种‘奥尼尔’从浙江蓝美农业有限公司引进的2年生苗木,种植于桂林市雁山区广西植物研究所。约6月中旬,待天气放晴2~3 d后,于早上(9:00—11:00)采集鲜嫩枝条放入保鲜袋,然后立刻放置于装有冰袋的冰盒内保鲜,当天内需将材料进行灭菌处理后培养。
1.2 试验方法
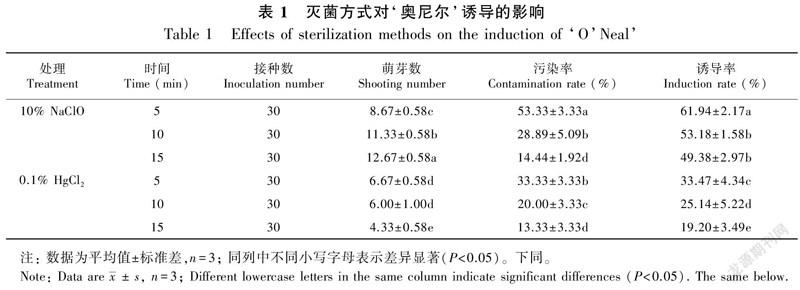
1.2.1 外植体的灭菌及诱导将采集的蓝莓进行预处理后,先在超菌台上使用75%的乙醇处理50 s,然后分别使用NaClO和HgCl灭菌处理,备用。将灭菌的外植体分别接种于MS和WPM诱导培养基中进行丛生芽的诱导培养,其中诱导培养基中均加入1.5 mg·L 玉米素(ZT),每个处理接种30个外植体,3个重复。培养条件,LED光源,光照时间12 h、光强1 500~2 000 lx、温度(25±2)℃。培养30 d左右,统计萌芽数、污染率(污染率=污染的外植体数/接种的外植体数×100%)和诱导率(诱导率=诱导出的外植体数/未污染的外植体数×100%),取平均值。
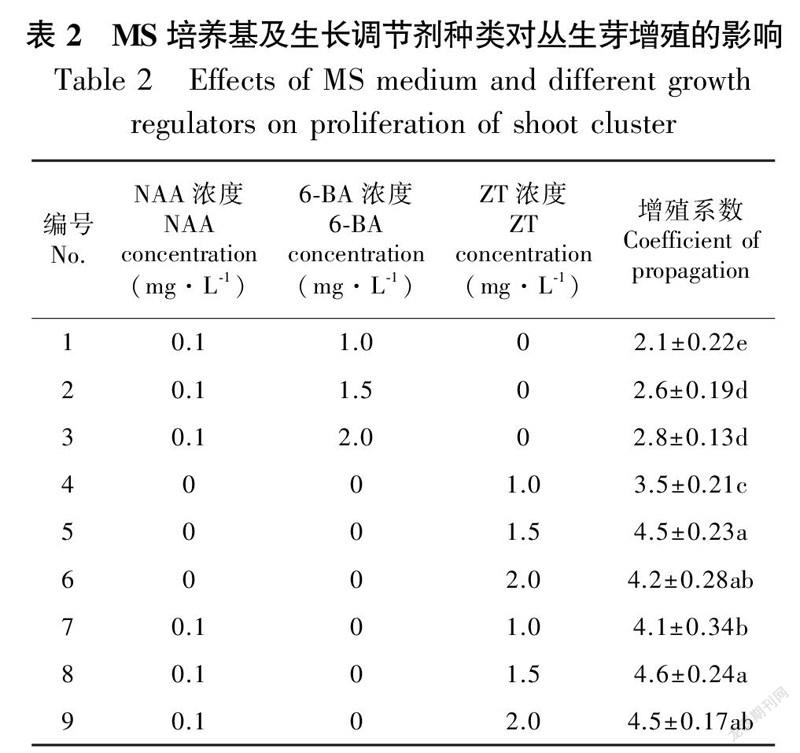
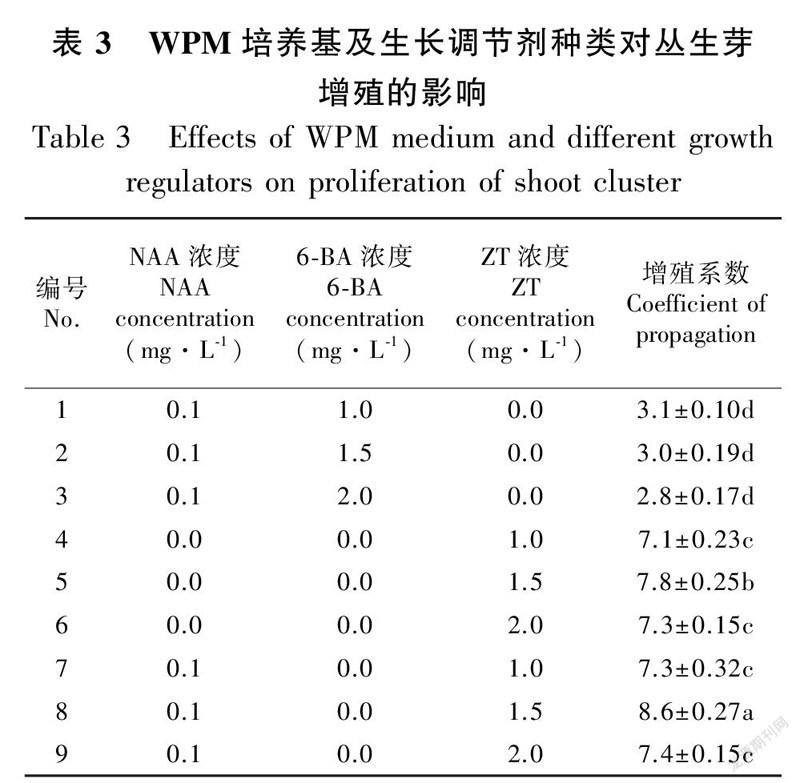
1.2.2 丛生芽的增殖培养诱导出的丛生芽生长到一定大小后,剪成带单个腋芽的茎段,分别以MS和WPM为基础培养基,分别添加1-萘乙酸(NAA)、6-苄氨基嘌呤(6-BA)、ZT等不同浓度及组合的外源生长调节剂,pH为5.4,每个处理接种30个,重复3次。培养条件,LED光源,光照时间12 h、光强1 500~2 000 lx、温度(25±2)℃。继代培养60 d左右,统计增殖数和增殖系数(增殖系数=增殖数/接种数),取平均值。
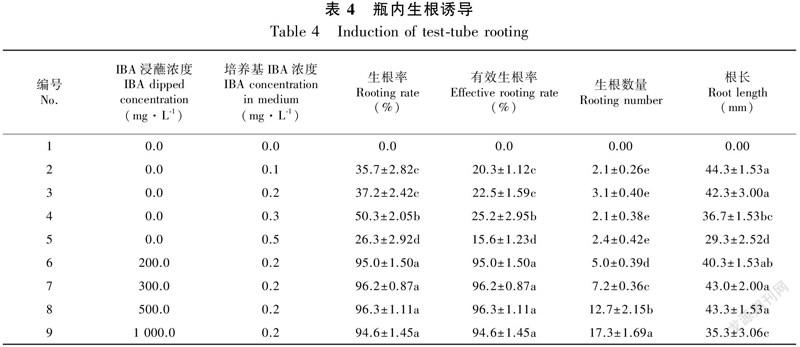
1.2.3 瓶内生根培养选择生长健壮的丛生芽苗,剪成带2~3个腋芽的茎段,备用。处理一:直接接种到添加不同3-吲哚乙酸(IBA)浓度的生根培养基上培养。处理二:浸蘸处理,即把带腋芽的茎段经高浓度的IBA浸蘸处理,再接种到生根诱导培养基内培养。生根诱导培养以WPM为基础培养基,pH为5.4,每个处理接种30个,重复3次。培养条件,LED光源,光照时间12 h、光强1 500~2 000 lx、温度(25±2)℃。继代培养90 d左右,统计生根率、有效生根率(每株生根数≥3条)、根长和根生长状况等,取平均值。
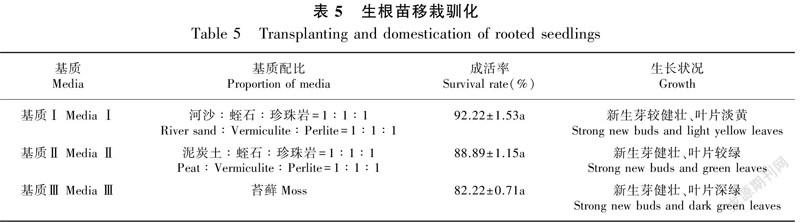
1.2.4 移栽驯化 将生根后的瓶苗,于3—4月室外炼苗,开瓶驯化7 d后,洗净根部培养基,移栽到经多菌灵灭菌处理的以下 3 种移栽基质中,移栽基质Ⅰ [河沙∶珍珠岩∶蛭石=1∶1∶1(体积比)];移栽基质Ⅱ [泥炭土∶珍珠岩∶蛭石=1∶1∶1(体积比)];移栽基质Ⅲ(苔藓)。用底部带孔的塑料杯(9 cm × 10 cm)种植,然后置于塑料大棚内,初期用塑料薄膜盖好,后期逐渐通风,每个处理种植90 株,3 次重复,移栽60 d后统计组培苗成活率及生长情况。
1.2.5 数据处理统计数据使用Excel软件和SPSS 19.0软件处理。
2结果与分析
2.1 外植体灭菌及诱导
外植体不同灭菌方式结果统计见表1。由表1可知,使用10%的NaClO时,随着处理时间的延长,污染率逐渐降低,同时诱导率也逐渐降低,但萌芽总数逐渐增多,处理时间为15 min时,效果最好,污染率仅有14.44%,诱导率49.38%,萌芽数平均12.67个。同样,外植体随0.1%的HgCl2处理时间的延长,污染率和诱导率也均下降,但萌芽数减少,处理15 min时,污染率降低至13.33%,但诱导率仅有19.20%,萌芽数仅有4.33个。这说明不同灭菌方式及不同处理时间均对外植体污染率、诱导率及萌芽数影响较大。综合分析认为,10% NaClO处理15 min是比较理想的灭菌处理方法,降低污染率的同时也能保证相对较高的诱导率,最后诱导出的材料最多。本研究还发现,WPM的诱导效果要好于MS,诱导出的丛生芽较多,如图1所示。
2.2 丛生芽的增殖培养
丛生芽的增殖培养情况统计见表2和表3。表2是以MS为基础培养基,添加了不同组合的生长调节剂。当NAA为0.1 mg·L、6-BA为1.0~2.0 mg·L时,丛生芽增殖效果较差,培养60 d后,增殖系数仅为2.1~2.8,显著低于其他处理组合( P<0.05)。当MS培养基中仅添加1.0~2.0 mg·L ZT时,其增殖效果较好,1.5 mg·L的增殖系数达到4.5。添加0.1 mg·L NAA后,同浓度的ZT处理,增殖系数均有不同程度的提高,其中效果最好的为MS+NAA 0.1 mg·L + ZT 1.5 mg·L,增殖系数高达4.6,增殖苗较粗壮,如图2:A所示。
表3是以WPM为基础培养基,同样添加了不同组合的植物生长调节剂。当NAA为0.1 mg·L、6-BA为1.0~2.0 mg·L时,丛生芽增殖效果同样较差,增殖系数仅有2.8~3.1,显著低于其他处理组合( P<0.05)。当培养基仅添加1.0~2.0 mg·L ZT時,其增殖效率显著提高,增殖系数达到7.1~7.8。添加0.1 mg·L NAA后,同浓度的ZT处理,增殖系数均有不同程度的提高,其中处理效果最好的为WPM + NAA 0.1 mg·L+ ZT 1.5 mg·L处理组,增殖系数高达8.6,长势良好,说明此培养基为丛生芽增殖的最佳培养基(图2:B)。从表2和表3还可以看出,添加相同植物生长调节剂的情况下,WPM基础培养基的增殖系数均优于MS基础培养基。
2.3 瓶内生根诱导
将生长健壮且大小一致的丛生芽,剪成带2~3个腋芽的茎段,接种于生根诱导培养基上。结果发现,不定根的生长数量和生长速度随培养基不同而异,培养90 d后观察统计瓶内生根情况如表4所示。由表4可知,将带腋芽的茎段直接接种在WPM中培养,未能诱导出不定根。在培养基中添加0.1~0.5 mg·L IBA后,茎段基部切口处能诱导不定根,约7 d后开始有少量的不定根长出,但生根数较少,根系较粗(图3:A-D)。生根率及有效生根率均呈先升高后降低的趋势,其中0.3 mg·L的IBA处理组,生根率和有效生根率均最高,分别为50.3%和25.2%;但根系长度随IBA浓度的升高而变短,从44.3 mm降低到29.3 mm,差异显著(P<0.05)。此外,IBA浓度为0.3和0.5 mg·L时,茎段基部切口处产生较多的愈伤组织,浓度越高,愈伤组织越多(图3:C,D)。
从表4还可以看出,先将待接种的带腋芽的茎段于不同浓度的IBA浸蘸20 s,再接种到含0.2 mg·L IBA的WPM培养基中,生根率、有效生根率及生根数均明显好于直接接种于WPM中培养(图3)。从表4还可看出,浸蘸不同浓度IBA后,生根率和有效生根率均高达95%;生根数量随处理浓度升高而逐渐增多,1 000 mg·L 的IBA处理组,生根数量达每株17.3条;根长呈先升高后降低的趋势,500 mg·L的 IBA浸蘸处理根系最长(43.3 mm)。综合分析认为,带腋芽的茎段先经500 mg·L的 IBA浸蘸20 s,再接种于WPM+ IBA 0.2 mg·L的培养基上培养,是诱导瓶内生根的最佳的培养方式,其生根率、有效生根率、生根数量和根长分别达96.3%、96.3%、12.7条和43.3 mm,且根系较发达、粗壮,如图3:G所示。
2.4 生根苗室外移栽驯化
生根后的瓶苗于3—4月份移栽,60 d后统计成活率如表5所示。由表5可知,生根苗在基质Ⅰ(河沙∶蛭石∶珍珠岩=1∶1∶1)的配比中成活率最高,达92.22%,新生芽较健壮、叶片淡黄(图4:A);基质Ⅱ(泥炭土∶蛭石∶珍珠岩=1∶1∶1)的配比,移栽成活率次之,达88.89%,新生芽健壮、叶片较绿(图4:B);基质Ⅲ(苔藓)的移栽成活率为82.22%,但长势最好,表现为新生芽健壮、叶片深绿(图4:C)。
3讨论与结论
MS和WPM是蓝莓组培快繁研究常用的2种培养基,本研究发现,在生长调节剂相同的情况下,以WPM为基础培养基的诱导和增殖效果远好于MS培养基,可能是WPM 培养基中无机盐浓度较低,适合木本植物组织培养(Wolfe et al., 1983;胡选萍等,2018)。本研究发现,1.0~2.0 mg·L ZT对蓝莓‘奥尼尔’的增殖培养效果均明显好于NAA和6-BA;在1.5 mg·LZT基础上,添加0.1 mg·L NAA能有利于提高增殖系数,最高达8.6,虽略低于增殖系数10.45的报道(陈冰心等,2014),但本研究诱导的丛生芽无玻璃化现象,长势好,丛生芽粗壮。综合分析认为,蓝莓‘奥尼尔’丛生芽增殖培养的最优培养基配方为WPM + NAA 0.1 mg·L+ ZT 1.5 mg·L。
本研究发现,将蓝莓‘奥尼尔’带腋芽的茎段直接在0.1~0.5 mg·LIBA的培养基中培养时,不定根仅在基部切口处形成,生根率较低(最高为50.3%),有效生根率(平均生根数≥3条)更低(最高为25.2%);采用500 mg·L的 IBA浸蘸20 s,再接种到含有0.2 mg·L IBA的培养基中培养,生根率及有效生根率均达到96.3%,且生根条数较多,根系粗壮,好于直接在IBA的培养基中培养的报道(陈原国等,2016)。除了基部切口外,还能在培养基以上的腋芽和节间处诱导出大量不定根, 从而有效提高了瓶内生根率和有效生根率。据报道,这是由于IBA浓度对根的形成影响较大,能刺激侧根原基形成并掀起其表皮,生根数量随着IBA浓度的增加而增加(李欣欣等,2013)。
不同的移栽基质,对蓝莓成活率的影响不同,蓝莓的移栽驯化常采用腐殖土、草炭灰和苔藓等基质。蓝莓进行瓶内生根后再移栽,成活率可达85%左右(郑琪等, 2011),这表明蓝莓瓶内生根能有效提高移栽驯化成活率。广西桂北地区春夏季节高温高湿,易引起移栽驯化过程中的烂根等问题,因此,筛选适宜的移栽基质对提高移栽成活率至关重要。而本研究的生根苗在河沙∶蛭石∶珍珠岩=1∶1∶1的成活率可达92.22%,但移栽苗在苔藓中的长势最好,今后可在移栽基质中加入适量苔藓,在提高成活率的同时,移栽苗长势可能更好。
参考文献:
BORNSEK SM, ZIBEMA L, POLAK T, et al., 2012. Bilberry and blueberry anthocyanins act as powerful intracellular antioxidants in mammalian cells [J]. Food Chem, 134 (4): 1878-1884.
CHEN BX, LIU QC, DENG XY, et al., 2016. Rapid propagation of southern highbush blueberry O’Neal [J]. Life Sci Res, 18(3): 246-249. [陈冰心, 刘奇畅, 邓喜艳, 等, 2016. 南高丛蓝莓奥尼尔快速增殖的研究 [J]. 生命科学研究, 18(3): 246-249.]
CHEN YG, MA P, WANG Y, et al., 2016. Effect of different phytohormone combinations on tissue culture of two varieties of blueberries [J]. J Zaozhuang Univ, 33(2): 87-91. [陈原国, 马鹏, 王语, 等, 2016. 不同激素配比对两个蓝莓品种组织培养的影响 [J]. 枣庄学院学报, 33(2): 87-91.]
DONG CL, 2009. Induction and regeneration of blueberry buds [J]. Guangxi Agric Sci, 40(3): 293-295. [董朝莉, 2009. 藍莓芽诱导与再生研究 [J]. 广西农业科学, 40(3): 293-295.]
FANG RZ, 1986. Study on Vaccinium in China [J] . Acta Bot Yunnan, 3(8): 239-258. [方瑞征, 1986. 中国越橘属的研究 [J]. 云南植物研究, 3(8): 239-258.]
HU XP, QIN GW, CAO XY, 2018. Research progress on tissue culture technology of blueberry [J]. Mol Plant Breed, 3(16): 960-965. [胡选萍, 秦公伟, 曹小勇, 2018. 蓝莓组织培养技术的研究进展 [J]. 分子植物育种, 3(16): 960-965.]
KADER F, ROVEL B, GIRARDIN M, et al., 1996. Fractionation and identification of the phenolic compounds of highbush blueberries (Vaccinium corgmbosum L.) [J]. Food Chem, 55 (1): 35-40.
LI LR, JIN KZ, 2010. The tissue culture and rapid propagation of Vaccinium ashei [J]. S Chin Fruits, 39(1): 71-72. [李丽容, 金开正, 2010. 兔眼蓝莓组培快繁试验 [J]. 中国南方果树, 39(1): 71-72.]
LI XX, ZHAO J, LIAO H, 2013. Effects of indoleacetic acid, indolebutyric acid and naphthylacetic acid on soybean [Glycine max (L.) Merr] root growth [J]. Plant Physiol J, 49(6): 573-578. [李欣欣, 赵静, 廖红, 2013. 吲哚乙酸、吲哚丁酸和萘乙酸对大豆幼根生长的影响 [J]. 植物生理学报, 49(6): 573-578.]
LIU QZ, ZHAO HJ, 2002. Tissue culture and rapid propagation of Vaccinium corymbosum [J]. Plant Physiol Comm, 38(3): 253-253. [刘庆忠, 赵红军, 2002. 高灌蓝莓的组织培养及快速繁殖 [J]. 植物生理学通讯, 38(3): 253-253.]
SUN SW, 2009. Study on root taking I of Semen trigonellae tissue culture seedling in the bottles[J]. Hubei Agric Sci, 48(4): 786-788. [孙书伟, 2009. 蓝莓组培苗瓶内生根的探讨[J]. 湖北农业科学, 48(4): 786-788.]
WANG XJ, DAI ZG, GAO QY, et al., 2017. Study on ex vitro cutting rooting for blueberry [J]. Jiangsu Agric Sci, 45(4): 30-32. [王雪嬌, 代志国, 高庆玉, 等, 2017. 蓝莓组培苗瓶外扦插生根的研究 [J]. 江苏农业科学, 45(4): 30-32.]
WANG XM, FAN SF, WU WL, et al., 2020. Optimum tissue culture conditions of blueberry ‘Biloxi’ by orthogonal test [J]. N Hortic, (3): 28-35. [王小敏, 樊苏帆, 吴文龙, 等, 2020. 利用正交实验优选蓝莓“比洛克西”组织培养条件 [J]. 北方园艺, (3): 28-35.]
WOLFE DE, ECK P, CHIN CK, 1983.Evaluation of seven mediafor micropropagation of high bush blueberry[J].Hortscience, 18: 703-705.
YANG C, WANG J, DONG SW, et al., 2016. The effect of different culture media on the rooting of blueberry shoots in vitro [J]. Plant Physiol J, 52(9): 1438-1442. [阳翠, 王军, 董顺文, 等, 2016. 培养基组分对蓝莓组培苗瓶内生根的影响 [J]. 植物生理学报, 52(9): 1438-1442.]
YUE J, YANG D, DONG ZB, et al., 2015. Establishment of rapid propagation technology of tissue culture of blueberry O’Neal [J]. J Zhejiang Agric Sci, 56(9): 1419-1421. [岳健, 杨东, 董正兵, 等, 2015. 奥尼尔蓝莓组培快繁体系的建立 [J]. 浙江农业科学, 56(9): 1419-1421.]
ZHENG Q, SUN YF, ZHAO H, et al., 2011. Study on rapid propagation technology of tissue culture of southern highbush blueberry [J]. Shanghai Agric Sci Technol, (2): 24. [郑琪, 孙叶芳, 赵虎, 等, 2011. 几种“南高丛”蓝莓新品种的组培快繁技术研究 [J]. 上海农业科技, (2): 24.]
ZHU SY, WU KM, CAI RJ, et al., 2016. Primary studies on ex vitro rooting culture of different blueberry in different media [J]. S Chin Agric, 10(15): 61-62. [朱世银, 武孔敏, 蔡荣靖, 等, 2016. 不同蓝莓组培苗在不同基质中的瓶外生根技术初探 [J]. 南方农业, 10(15): 61-62.]
(责任编辑周翠鸣)

