双斑长跗萤叶甲取食对棉花挥发物组成和含量的影响
杨陈 郭丹丹 何婉洁 孟涵颖 朱佳伟 施文龙 陈静






摘要:基于固相微萃取及气相色谱-质谱联用方法(GC-MS)检测双斑长跗萤叶甲危害前后棉花叶片的挥发物。以期明晰双斑长跗萤叶甲取食危害对棉花挥发物的影响。结果表明,在健康的棉花叶片中总计检测到挥发物40种,主要为醇类、酯类、酸类、萜类和酮类等;双斑长跗萤叶甲取食后6、18、24、36、48 h分别检测到18、23、19、20、13种挥发物。挥发物中3-已醛、1,3-丁二烯醇、α-蒎烯、β-紫罗酮、棕榈酸等28种挥发物在双斑长跗萤叶甲取食危害后消失;β-月桂烯、β-羅勒烯、橙花叔醇等12种挥发物在取食前后均有所释放;β-蒎烯、正十五碳醛、β-檀香醇等12种挥发物则在取食危害后产生。棉花叶片在受到双斑长跗萤叶甲危害前后,萜类和醛类挥发性物质变化较明显。危害后各时间段收集到的挥发性物质中均以萜烯类为主,其次为醇类和醛类挥发物。
关键词:双斑长跗萤叶甲;棉花;植物挥发性物质;虫害诱导挥发物;挥发物日节律变化
中图分类号:S435.622+.9 文献标志码: A
文章编号:1002-1302(2022)08-0117-08
双斑长跗萤叶甲(Monolepta hieroglyphica Motschulsky)是新疆棉田常见的多食性害虫,会影响棉花产量,造成一定的经济损失[1]。植物气味会影响昆虫的取食、寄主定位和产卵选择等行为[2]。研究双斑长跗萤叶甲对棉花取食前后挥发物组分变化情况,可以为后续研究棉花抗虫性和利用引诱剂控制害虫种群数量奠定基础。
植物释放的挥发性化学物质可分为2类,一类是植物在生长发育过程中释放的挥发性化学物质,这类物质会影响昆虫对寄主的定向选择、产卵和取食等行为[3-4];另一类是植物受到昆虫攻击后诱导产生的化学物质,即虫害诱导植物挥发物,这类物质更容易被天敌及其临近植株所利用,或是同种植株间的告警信息素作用等[5-9]。这2类物质在种类和含量上都有所不同。蒋方一丁等利用自动热脱附仪-气相色谱仪-质谱仪(TD-GC-MS)技术对椰树健康叶和被椰心叶甲(Brontispa longissimi Gestro)取食后叶片挥发性物质进行测定,结果表明取食前后挥发物变化明显,其中萜烯烃类物质及其衍生物变化最为明显[10]。未受损茶树有6种挥发性物质,而经茶丽纹象甲(Myllocerinus aurolineatus Voss)取食后产生的挥发物中,有47种新形成挥发物[11]。棉花在斜纹夜蛾(Spodoptera litura Fabricius)取食后增加了8种挥发物[12],一点拟灯蛾(Asota caricae Fabricius)取食木瓜榕后,挥发物的释放量增加了40倍[13]。挥发物含量也会随时间的变化发生相应的改变。
在双斑长跗萤叶甲对棉花叶片挥发物的触角电生理和嗅觉行为反应中,双斑长跗萤叶甲对寄主植物挥发物有明显的反应。双斑长跗萤叶甲雌虫对α-红没药醇和β-紫罗酮有明显趋向性,γ-萜品烯和氧化石竹烯对它有明显的驱避性;雄虫对 α-蒎烯、γ-萜品烯和D-柠檬烯有明显趋向性,β-紫罗酮对它有明显的驱避性[14-15]。但是这些挥发物是来源于健康棉花,还是虫害诱导后释放的,以及昆虫取食后日节律的变化如何,目前尚未见报道。
本研究选用的材料为健康的和被双班长跗萤叶甲危害的棉花植株,利用固相微萃取和气相色谱-质谱联用(GC-MS)方法,探究该叶甲取食棉花前后不同时间挥发物释放的规律,旨在探讨双斑长跗萤叶甲取食前后,棉花释放挥发物在组分和含量上的变化差异,为揭示植物-植食性昆虫-天敌三重营养关系的影响提供科学依据。
1 材料与方法
1.1 供试材料和虫源
供试昆虫:在石河子大学试验站(86°3′27″E、44°18′32″N)棉花地及其周围杂草上采集双斑长跗萤叶甲成虫,带回室内鉴别雌雄后,放入自制的饲养装置进行饲养,室内温度为28 ℃,相对湿度控制在40%~50%,每天更换新鲜的棉花叶片。备用。
供试棉花:选用耐黄萎病的陆地棉海高49品系。
健康叶片:所选棉花品种于2017年5月进行盆栽种植,在种植期间不施用任何化肥农药。共种植6盆。
损伤叶片:将50头(雌雄各半)健壮、活性较好的成虫接在棉花上,并用1 m×1 m×1 m防虫笼将其罩住。重复3次。
1.2 挥发物采集和鉴定
待棉花长至35 cm时,在中国科学院新疆理化技术研究所进行挥发物收集鉴定。分别收集鉴定健康棉花叶片和双斑长跗萤叶甲取食危害6、18、24、36、48 h后的棉花叶片植物挥发性物质,在采集植物挥发物之前清除双斑长跗萤叶甲及其排泄物。
采用固相微萃取的方法收集挥发物。将5 g棉花叶片放入10 mL可密闭的萃取瓶中,置于50 ℃水浴锅中预热15 min,在50 ℃水浴锅中用100 μm聚二甲基硅氧烷(PDMS)(美国Supelco)萃取头萃取50 min。萃取完毕后,将萃取头放入气质联用仪(GCMS-7890A-5975C,安捷伦,美国)的进样口中,于290 ℃解析脱附10 min[12]。
气质联用仪参数设定如下。色谱柱:PE-5 MS;载气:高纯氦气(99.999%),流速为1 mL/min;进样口温度为250 ℃;升温程序:柱温50 ℃,保持 3 min,以 3 ℃/min 升温至200 ℃,再以5 ℃/min升温至 280 ℃ 保持30 min。质谱条件:电离源EI,离子源温度为230 ℃,GC-MS传输线温度为200 ℃,质量扫描范围为35~600 amu,EI电离能量为 70 eV。对采集到的各峰经质谱计算机数据系统检索,与标准普库Nist2008比对,用峰面积归一化法测定各挥发物成分的百分含量。
2 结果与分析
2.1 健康棉花叶片挥发性化学物质的分析鉴定
由表1可知,经过固相微萃取收集挥发物、GC-MS 定性分析,在健康棉花叶片中共检测出40种挥发性物质,其峰面积占比为98.99%。这些挥发物主要是萜烯类,占比约为87%,而醇类和醛类等所占比例仅为12%。萜烯类挥发物中α-蒎烯、
γ-萜品烯、(+)-α-长叶蒎烯、1-石竹烯、葎草烯等含量较高,其中1-石竹烯、(+)-α-长叶蒎烯分别占总含量已鉴定组分的42.14%、 20.75%;β-红没药醇含量是其他几种醇类含量总和的16.28倍,乙酸冰片酯和诺卜醇乙酸酯含量均为0.06%。
2.2 棉花虫害叶片挥发性化学物质的日节律变化
由表2可知,棉花叶片受到双斑长跗萤叶甲危害后,各时间段收集到的挥发性化学物质种类和数量各有不同,其中18 h收集到的挥发物最多,有23种;48 h收集到的最少,仅13种。虫害危害6 h时,共收集到18种挥发物,其中1-石竹烯、葎草烯、甘香烯、(E)-β-金合欢烯、β-红没药醇等挥发物含量较高,其余挥发物含量较低。虫害危害18 h时,共收集到23种挥发物,与6 h相比,新收集到β-崖柏烯、叶醇等5种挥发物,萜烯类中β-蒎烯、β-月桂烯等6种挥发物的含量均有不同幅度的增加,其余含量均有所降低;醇类和醛类物质中,除正十五碳醛外,其余物质含量均增加。虫害危害24 h时,共收集到19种挥发物,新收集到α-广藿香烯,未收集到D-柠檬烯、β-罗勒烯等5种萜烯类物质;与18 h相比,萜类物质中仅有1-石竹烯、葎草烯、氧化石竹烯含量上升;而醇类和醛类物质中,除 β-檀香醇外,其余均有所提高。虫害危害36 h时,共收集到20种挥发物,未收集到(+)-香橙烯、橙花叔醇、异长叶醇、正十五碳醛;与24 h相比,新收集到D-柠檬烯、β-罗勒烯等4种挥发物;β-蒎烯、β-月桂烯等4种萜烯类物质的含量有所提高,其余物质含量均降低。虫害危害48 h时仅收集到13种挥发物,未收集到β-崖柏烯、β-檀香醇等11种物质;与36 h相比,新收集到橙花叔醇和正十五碳醛。与6、18、24、36 h相比,1-石竹烯、β-檀香烯的含量在虫害危害48 h时释放量最高。
在双斑长跗萤叶甲取食棉花叶片后,不同时间段收集到的挥发物中,以萜烯类物质为主,其含量均占50%以上;醇类挥发物种类相对较少,含量变化较大;醛类挥发物种类较少。
棉花叶片被双斑长跗萤叶甲取食后的48 h内,萜烯类挥发物含量最高,均占50%以上,最高为危害后6 h,占61.92%,其中变化最明显的为β-月桂烯,其次为1-石竹烯、葎草烯。双斑长跗萤叶甲取食6 h后,β-崖柏烯、β-罗勒烯、β-檀香烯、α-广藿香烯、β-红没药烯均未检测到;18 h时,除α-广藿香烯外,其余均被检测到,榄香烯异构体、1-石竹烯、葎草烯、氧化石竹烯、α-荜澄茄油烯这5种物质含量均有所下降;α-广藿香烯在取食后24 h检测到,与18 h时相比除1-石竹烯、葎草烯、氧化石竹烯外,其余萜类物质含量均有所下降;在取食后36 h,β-蒎烯、β-月桂烯、β-崖柏烯、D-柠檬烯、β-罗勒烯等的含量达到最高值,分别为2.92%、9.75%、0.36%、0.78%、1.54%,仅有(+)-香橙烯未被检测到;48 h 时,大量挥发物消失,仅有9种萜类挥发物被检测到(图1)。
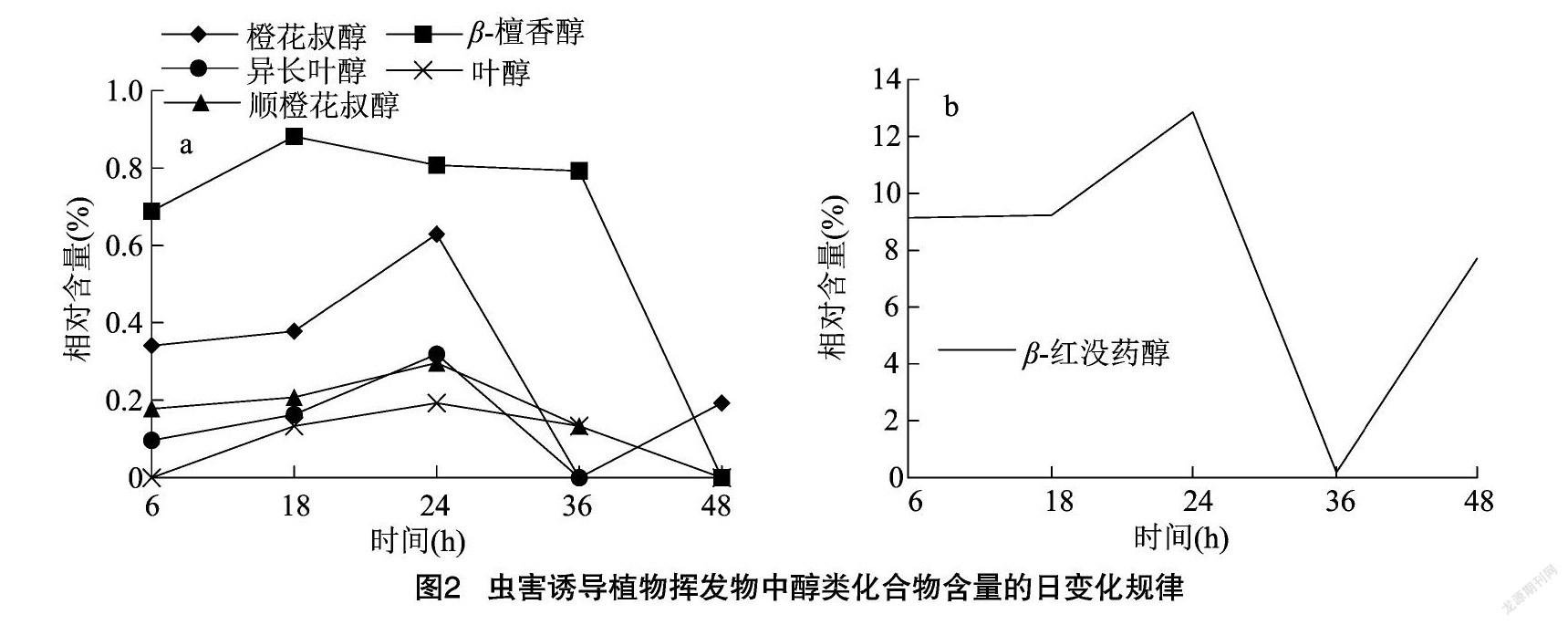
棉花叶片被双斑长跗萤叶甲取食后,随时间的增加,醇类挥发物种类变化较小,但含量变化较大(图2),β-红没药醇、β-檀香醇和橙花叔醇的含量变化较大。叶甲取食棉花后6 h,β-红没药醇和β-檀香醇含量较高;取食后18 h,叶醇释放,5种醇類挥发物均开始逐渐增加,其中β-檀香醇含量达到最高值,为0.88%;取食后24 h,除β-檀香醇外,其余物质含量均达到最大值,随后所有种类挥发物的含量均开始降低;36 h时,未检测到异长叶醇和橙花叔醇,其他挥发物含量也有所降低;48 h时,仅检测到橙花叔醇和β-红没药醇。
醛类挥发物种类较少,(E)-2-己醛含量变化趋势较正十五碳醛相对较大(图3)。叶甲取食棉花后6 h,正十五碳醛含量达到峰值,为0.29%;18 h时,正十五碳醛含量降低,(E)-2-己醛含量升高;至24 h时,(E)-2-己醛含量达最高值,为1.06%,随后开始降低;36 h时,(E)-2-己醛含量下降,未检测到正十五碳醛;48 h时,(E)-2-己醛含量上升,正十五碳醛有被检测到,但含量较低。
2.3 健康棉花和虫害棉花挥发物的比较
在健康棉花上共收集到40种挥发物,主要是烷烃类、醇类、醛类、酯类、萜烯类。经双斑长跗萤叶甲危害后有28种挥发物消失,其峰面积占健康棉花挥发物的36.31%(表3),其余12种挥发物除少量醇类外大多数为萜烯类挥发物,如β-罗勒烯、β-月桂烯和1-石竹烯等挥发物(表4)。
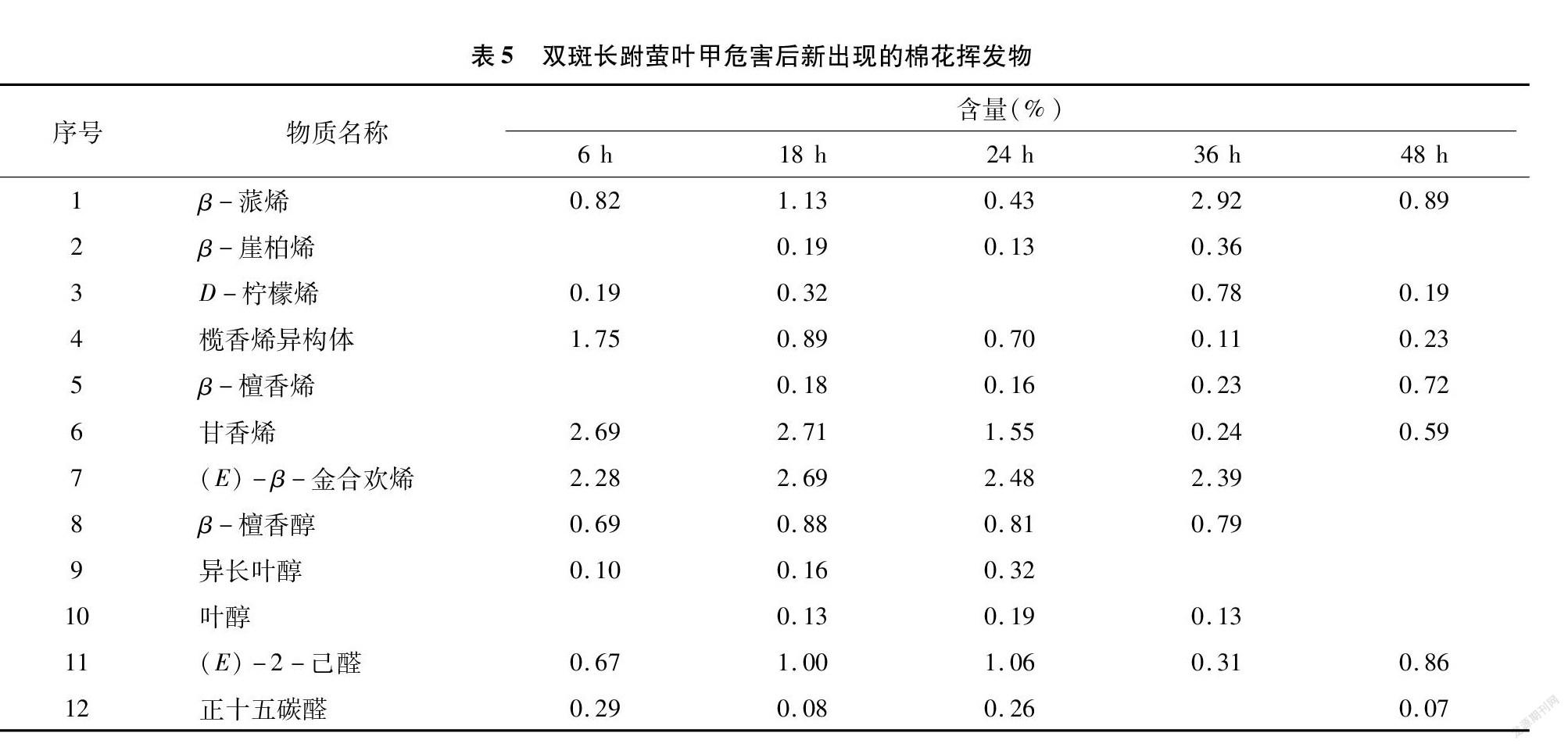
双斑长跗萤叶甲危害棉花后,新收集到12种挥发物,其中大多为萜烯类和少量的醇及醛类。除β-崖柏烯、β-檀香烯、叶醇这3种物质在危害后18 h收集到,其余均在危害后6 h被收集到。β-蒎烯、榄香烯异构体、甘草烯、(E)-2-己醛这4种物质在危害后48 h内均有被收集到(表5)。
3 讨论
研究表明,在受到植食性昆虫危害后,在数量和种类上都与健康植物释放的挥发物有所不同[16]。双斑长跗萤叶甲取食棉花前后的挥发物经GC-MS分析,γ-萜品烯、3-蒈烯、β-紫罗酮、δ-杜松烯、棕榈酸等28种挥发物消失,新收集到β-崖柏烯、甘草烯、(E)-β-金合欢烯等12种挥发物。这可能是由于寄主植物受到植食性昆虫取食的影响,从而调整了挥发物的组成进行直接或间接的防御反应,达到进一步调控植食性昆虫行为的目的[17]。
植物在受到危害时产生挥发物,在一定时间内大量产生,随后开始降低。双斑长跗萤叶甲危害棉花后18 h释放的挥发物含量最多,共收集到23种,随后下降,当取食后48 h仅有13种挥发物质被收集到。同样,茶树在被茶丽纹象甲、假眼小绿叶蝉和茶尺蠖3种害虫危害后6 h,主要诱导挥发物的释放量要显著高于危害后的28 h[11]。β-蒎烯、β-月桂烯、榄香烯异构体、1-石竹烯、葎草烯、β-红没药醇、(E)-2-己醛等物质在双斑长跗萤叶甲取食后48 h持续存在,其中β-月桂烯、1-石竹烯、葎草烯、β-红没药醇等组分的相对含量较高。此外,铁观音和肉桂在茶小绿叶蝉危害后,β-月桂烯和α-法呢烯醇均大量释放,这些物质可能跟茶树的抗虫性有关[18]。
虫害诱导植物挥发物中重要的一类还有C6-绿叶性挥发物[19],主要包括C6-醛、C6-醇及其酯类。双斑长跗萤叶甲取食棉花后,异长叶醇、叶醇、(E)-2-己醛等3种挥发物在短时间内增加较多。甜菜夜蛾(S. exigua Hübner)幼虫危害棉花后,(Z)-2-己烯醛、(E)-3-己烯醛、(Z)-2-己烯醇和(Z)-3-己烯醇等4种挥发物的含量均明显增加[20]。茶树在茶丽纹象甲、假眼小绿叶蝉及茶尺蠖危害后,检测到了释放新形成的挥发物叶醇[11]。这些绿叶性挥发物可以作为告警信息化合物,是植物自身抗性防御反应的信号物质[21-22],不仅如此,这些绿叶性挥发物还能吸引大量害虫,可作为引诱剂从而进一步控制害虫。(Z)-3-己烯醇不仅可以引诱苹果绵蚜(Eriosoma lanigerum Hausemann)[23],还可引诱榆紫叶甲(Ambrostoma quadriimpressum)[24]、马铃薯甲虫(Leptinotarsa decemlineata Say)[25-26]等。
在遭受植食性昆虫危害时,植物释放的绿叶性气体增加,同时促使植物合成释放以萜烯类挥发物为主的新的挥发物组分[27-29]。双斑长跗萤叶甲危害后,棉花新产生许多挥发性挥发物,如D-柠檬烯、β-檀香烯、甘草烯等。Pare等研究发现,棉花受害后,由植物体内的类异戊二烯生物合成途径生成的萜类挥发物DMNT、TMTT才会出现[27],植物细胞生长及分裂相关物质也由该途径合成[30-31],因此萜类挥发物又被称为类异戊二烯挥发物[32],这类挥发物在植物与环境的相互作用中扮演着重要的角色[33]。黄瓜经二斑叶螨(Tetranychus urticae)危害后,与健康黄瓜植株相比萜类挥发物不仅种类从2种增加到7种,释放量也显著增加[34]。在虫害诱导植物挥发物中,萜类挥发物的种类和相对含量较健康植株明显增加,并且机械损伤是不能诱发这些萜类挥发物释放的。这说明萜类挥发物是只有在植食性昆虫诱导下才能产生的一个挥发物中的重要组分[35]。
植物挥发物具有多种功能,如吸引或驱避,可利用这一特性在一定程度上可以减轻害虫对植物的危害[36]。植食性昆虫通过挥发物远距离定位寄主植物,人们利用这些物质对昆虫的引诱作用,吸引昆虫前来取食,从而将其集中诱杀,如白杨叶甲(Chnsomela populi)[37]、石斛簍象(Nassophasis sp.)[38]、三杨叶甲(Chrysomela poputi)[39]等。相反也能对部分昆虫产生一定的驱避作用,番茄天蛾(Manduca quinquemaculata Haworth)很少把卵产在取食后的烟草上[40],褐飞虱对经斜纹夜蛾(S. littoralis Boisduval)诱导的水稻挥发物有显著的驱避性[41]。植物挥发物不仅影响植食性昆虫的行为,在一定程度上还影响着天敌的行为,尤其是虫害诱导植物产生的挥发物。二斑叶螨(T. urticae Koch)和桃蚜(Myzus persicae Passerini)同时危害甜椒后,释放出的2种新挥发物对捕食性盲蝽(Macrolophus caliginosus Wagner)的吸引作用显著增强[42]。假眼小绿叶蝉的卵寄生蜂对该叶蝉危害茶梢产生的挥发物有显著的引诱效果[43]。植物挥发物对昆虫既有引诱作用,同时还有驱避作用,可通过推拉(push-pull)策略,使害虫远离作物,同时还能吸引天敌,减少害虫对农作物的影响。
4 结论
对双斑长跗萤叶甲危害棉花前后不同时间段挥发物进行分析检测,在健康棉花叶片中共检测出40种挥发物,主要为萜类、酯类、醇类等物质;虫害危害棉花叶片后6、18、24、36、48 h,分别收集到18、23、19、20、13 种挥发物。与健康的棉花叶片相比,双斑长跗萤叶甲取食后的叶片中,萜类和醛类物质种类变化较明显,其中,β-蒎烯、正十五碳醛等12种挥发物是虫害后新产生挥发物,γ-萜品烯、(+)-α-长叶蒎烯等28种挥发物在虫害后消失。棉花叶片受到双斑长跗萤叶甲取食危害后,18 h 收集到的挥发物最多,有23种;48 h收集到的最少,仅13种。不同时间段收集到的挥发物,以萜烯类为主要成分,其次为醇类和醛类。本试验结果将为后续研究棉花抗虫性和利用天敌昆虫控制双斑长跗萤叶甲奠定基础。
参考文献:
[1]王俊铎,梁亚军,龚照龙,等. 新疆植棉区2019年棉花种业报告[J]. 棉花科学,2021,43(1):3-10.
[2]王振华,赵 晖,李金甫,等. 植物源挥发物对昆虫信息素的增效作用及其增效机制[J]. 应用生态学报,2008,19(11):2533-2537.
[3]钦俊德. 昆虫与植物关系的研究进展和前景[J]. 动物学报,1995,41(1):12-20.
[4]孙江华,Roques A,严善春. 害虫行为调节与森林害虫管理[J]. 世界林业研究,2000,13(2):24-29.
[5]孙晓玲,高 宇,陈宗懋. 虫害诱导植物挥发物(HIPVs)对植食性昆虫的行为调控[J]. 应用昆虫学报,2012,49(6):1413-1422.
[6]蔡晓明,孙晓玲,董文霞,等. 虫害诱导植物挥发物(HIPVs):从诱导到生态功能[J]. 生态学报,2008,28(8):3969-3980.
[7]严善春,张丹丹,迟德富. 植物挥发性物质对昆虫作用的研究进展[J]. 应用生态学报,2003,14(2):310-313.
[8]杜家纬. 植物-昆虫间的化学通讯及其行为控制[J]. 植物生理学报,2001,27(3):193-200.
[9]穆 丹,付建玉,刘守安,等. 虫害诱导的植物挥发物代谢调控机制研究进展[J]. 生态学报,2010,30(15):4221-4233.
[10]蒋方一丁,吕宝乾,唐继洪,等. 椰心叶甲危害对椰树心叶挥发物的影响[J]. 生物安全学报,2020,29(4):264-267.
[11]蔡晓明. 三种茶树害虫诱导茶树挥发物的释放规律[D]. 北京:中国农业科学院,2009:100-102.
[12]迟国梁,谭炳昌,王建武.斜纹夜蛾取食对Bt玉米挥发物组成和含量的影响[J]. 应用生态学报,2010,21(4):1007-1013.
[13]夏尚文,陈 进. 昆虫取食和人工损伤处理对五种榕树挥发物释放的影响[J]. 云南植物研究,2007,29(6):694-700.
[14]张志虎,陈 静,唐思琼,等. 双斑长跗萤叶甲成虫对α-红没药醇等棉花和玉米挥发物的嗅觉行为反应[J]. 新疆农业科学,2018,55(6):1117-1123.
[15]郭丹丹,張志虎,陈 静,等. 双斑长跗萤叶甲对棉花和玉米七种挥发物的EAG及行为反应[J]. 应用昆虫学报,2018,55(1):79-86.
[16]娄永根,程家安.虫害诱导的植物挥发物:基本特性、生态学功能及释放机制[J]. 生态学报,2000,20(6):1097-1106.
[17]莫圣书,赵冬香,陈 青. 植物挥发物与昆虫行为关系研究进展[J]. 热带农业科学,2006,26(6):84-89,93.
[18]金 珊,韩李伟,叶乃兴,等. 茶小绿叶蝉危害乌龙茶茶树品种的挥发物分析[J]. 热带作物学报,2019,40(3):576-582.
[19]王国昌,孙晓玲,董文霞,等. 虫害诱导挥发物的生态调控功能[J]. 生态学报,2010,30(24):7016-7028.
[20]Loughrin J H,Manukian A,Heath R R,et al. Volatiles emitted by different cotton varieties damaged by feeding beet armyworm larvae[J]. Journal of Chemical Ecology,1995,21(8):1217-1227.
[21]Bate N J,Rothstein S J.C6-volatiles derived from the lipoxygenase pathway induce a subset of defense-related genes[J]. The Plant Journal,1998,16(5):561-569.
[22]Kishimoto K,Matsui K,Ozawa R,et al. Volatile C6-aldehydes and allo-ocimene activate defense genes and induce resistance against Botrytis cinerea in Arabidopsis thaliana[J]. Plant and Cell Physiology,2005,46(7):1093-1102.
[23]王平彦,亓玲美,孙绪艮,等. 苹果绵蚜对不同苹果品种枝条的选择及与挥发物的关系[J]. 林业科学,2009,45(8):91-95.
[24]程 彬,付晓霞,韩 启,等. 虫害诱导的家榆挥发物对榆紫叶甲寄主选择行为的影响[J]. 林业科学,2010,46(10):76-82.
[25]Visser J H,Piron P G M,Hardie J.The aphids peripheral perception of plant volatiles[J]. Entomologia Experimentalis et Applicata,1996,80(1):35-38.
[26]Bolter C J,Dicke M,van Loon J J A,et al. Attraction of colorado potato beetle to herbivore-damaged plants during herbivory and after its termination[J]. Journal of Chemical Ecology,1997,23(4):1003-1023.
[27]Pare P W,Tumlinson J H.De novo biosynthesis of volatiles induced by insect herbivory in cotton plants[J]. Plant Physiology,1997,114(4):1161-1167.
[28]Paré P W,Tumlinson J H.Cotton volatiles synthesized and released distal to the site of insect damage[J]. Phytochemistry,1998,47(4):521-526.
[29]Paré P W,Tumlinson J H.Induced synthesis of plant volatiles[J]. Nature,1997,385(6611):30-31.
[30]徐昌杰,张上隆. 植物类胡萝卜素的生物合成及其调控[J]. 植物生理学通讯,2000,36(1):64-70.
[31]刘 涤,胡之壁. 植物类异戊二烯生物合成途径的调节[J]. 植物生理学通讯,1998,34(1):1-9.
[32]陈大华,叶和春,李国凤,等. 植物类异戊二烯代谢途径的分子生物学研究进展[J]. 植物学报,2000,42(6):551-558.
[33]李 莉,高凌云,董 越,等. 植物类异戊二烯生物合成相关酶基因研究进展[J]. 浙江师范大学学报(自然科学版),2008,31(4):461-466.
[34]Takabayashi J,Dicke M,Posthumus M A.Variation in composition of predator-attracting allelochemicals emitted by herbivore-infested plants:relative influence of plant and herbivore[J]. Chemoecology,1991,2(1):1-6.
[35]宋晓君,唐 超,覃伟权,等. 虫害诱导植物挥发物的释放机制及应用[J]. 中国农学通报,2009,25(13):161-165.
[36]刘陈玮,陈素梅,郑 丽. 园艺作物挥发物合成及其生物学功能研究进展[J]. 江苏农业学报,2019,35(6):1506-1512.
[37]Brilli F,Ciccioli P,Frattoni M,et al. Constitutive and herbivore-induced monoterpenes emitted by Populus × euroamericana leaves are key volatiles that orient Chrysomela populi beetles[J]. Plant,Cell and Environment,2009,32(5):542-552.
[38]高晓余,何月秋,赵 艳,等. 石斛篓象成虫对不同来源气味的行为反应[J]. 昆虫学报,2009,52(7):814-819.
[39]Kendrick A P,Raffa K F.Sources of insect and plant volatiles attractive to cottonwood leaf beetles feeding on hybrid poplar[J]. Journal of Chemical Ecology,2006,32(12):2585-2594.
[40]Kessler A,Baldwin I T.Defensive function of herbivore-induced plant volatile emissions in nature[J]. Science,2001,291(5511):2141-2144.
[41]Xu T,Zhou Q,Xia Q,et al. Effects of herbivore-induced rice volatiles on the host selection behavior of brown planthopper,Nilaparvata lugens[J]. Chinese Science Bulletin,2002,47(16):1355.
[42]Moayeri H R S,Ashouri A,Poll L,et al. Olfactory response of a predatory mirid to herbivore induced plant volatiles:multiple herbivory vs.single herbivory[J]. Journal of Applied Entomology,2007,131(5):326-332.
[43]韓善捷,潘 铖,韩宝瑜. 假眼小绿叶蝉为害致茶梢挥发物变化及其引诱微小裂骨缨小蜂效应[J]. 中国生物防治学报,2016,32(2):142-148.

