果糖基碳微球的制备及其吸附性能研究
刘源源 刘 昕 王 萌 黄剑波 许 凤 张学铭,*
(1.北京林业大学林木生物质资源与化学北京市重点实验室,北京,100083;2.清华大学化学工程系,北京,100084;3.中国制浆造纸研究院有限公司,北京,100102)
随着工业的迅速发展,工业废水的排放对环境造成了严重污染。目前,水污染已被列为全球最亟需解决的环境问题之一。在各类污水中,含有大量有机染料的废水引起了研究人员的广泛关注[1-3]。在诸多染料中,碱性染料亚甲基蓝(MB)由于其着色能力极强,被广泛应用于纺织工业和造纸工业。然而,该染料即使在较低浓度下显色度也极高,且容易在水溶液中形成一价有机季铵盐阳离子基团,已成为一种主要的水体污染物。因此,如何快速、高效地净化MB染料污染废水是亟待解决的一个重要难题[4-6]。
生物质基衍生碳材料具有制备工艺简单、原料来源广泛,比表面积大、稳定性良好和绿色环保等优点,被广泛用作水处理吸附剂[7-8]。在众多生物质原料中,壳聚糖基及葡萄糖基微球的制备和应用较为广泛。Xing等[9]利用均苯四甲酸二酐对壳聚糖微球进行羧基化,由于微球表面含有大量羧基,其对亚甲基蓝最大吸附量达到935 mg/g;吸附动力学研究表明,该吸附过程受化学吸附控制。潘媛媛等[10]采用乳化交联法制得柠檬酸改性的磁性壳聚糖微球,与空白样相比,该材料的吸附率提高了16%,其吸附过程可采用Langmuir和Freundlich模型进行描述,且符合准二级吸附动力学方程。Xu等[11]利用自由基聚合法成功制备了2-丙烯酰胺-2-甲基丙磺酸接枝的磁性壳聚糖微球并进行MB的吸附研究;结果表明,其吸附容量随着溶液初始pH值及温度的升高而增大,吸附过程符合二级吸附动力学模型和Langmuir等温模型,证实其对MB为单层吸附。此外,潘翔等[12]以葡萄糖为碳源,采用KOH和H3PO4二次活化法制备得到微纳米级葡萄糖/膨胀石墨(AC/EG)复合材料,在pH值=7、吸附温度25℃、吸附时间30 min的条件下,其对MB的去除率可达97%。在前人的研究中,虽已制备出多种生物质糖基吸附材料,但实验中多需对原料进行化学改性,制备工艺相对复杂,同时所用化学药品较多,因此环境友好性还有待提高。
基于以上研究所存在的不足,本课题以廉价无毒、可持续获得的富碳生物质果糖为碳前驱体,表面活性剂聚环氧乙烷-聚环氧丙烷-聚环氧乙烷三嵌段共聚物(Pluronic P123)为模板,采用简单高效的软模板水热碳化法制备果糖基碳微球,并以MB为模型污染物考察其吸附性能,获得生产工艺简单、吸附率较高、绿色环保的新型生物质糖基碳吸附材料,为生物质的高值化利用及废水污染的处理提供新思路和借鉴。
1 实验
1.1 试剂及仪器
果糖,分析纯,购自北京化工厂;Pluronic P123(平均分子质量约5800),分析纯,购自西格玛奥德里奇(上海)贸易有限公司;MB,分析纯,购自天津化工厂。
KQ5200DE数控超声波清洗器,昆山市超声仪器有限公司;Modulyod-230冷冻干燥器、Nicolet iN10傅里叶红外光谱仪(FT-IR)、K-Alpha X射线光电子(XPS)仪,美国赛默飞世尔科技公司;SU8010扫描电子显微镜(SEM)、HT7700透射电镜(TEM),日本日立公司;UV2300Ⅱ紫外分光光度计,上海天美科学仪器有限公司。
1.2 实验方法
1.2.1 果糖基碳微球的制备
称取3 g果糖和0.0435 g Pluronic P123,分别溶解于40 mL和20 mL去离子水中。将果糖溶液少量多次加入到Pluronic P123水溶液中,随后将此混合溶液在70℃条件下搅拌1 h。然后,将混合溶液转移至高压反应釜中,在160℃条件下反应数小时。反应结束后,待溶液冷却至室温,倒入离心管中静置48 h,静置分层后的液体,倒出上层清液,下层沉淀物在转数为9500 r/min的条件下离心15 min,洗涤3次后置于70℃烘箱中烘干,即得果糖基碳微球。
1.2.2 MB吸附实验
配制不同浓度的MB溶液,调节溶液pH值=6,在装有100 mL MB溶液的烧杯中投入一定量果糖基碳微球,在温度30℃、搅拌速度300 r/min的条件下进行吸附实验。待吸附达到平衡后,取上层清液进行吸光度测定。利用标准曲线和下列公式进行平衡吸附量及吸附率的计算。

式中,Qe为达到吸附平衡时果糖基碳微球对MB的吸附量,mg/g;E为果糖基碳微球对MB的吸附率,%;C0为MB的初始浓度,mg/L;Ce为达到吸附平衡时MB的浓度,mg/L;V为溶液体积,L;m为果糖基碳微球的质量,g。
2 结果与讨论
2.1 果糖基碳微球表观形貌及形成过程表征
2.1.1 表观形貌表征
图1为果糖基碳微球的TEM图和SEM图。从图1可以看出,在水热条件下,果糖自组装形成实心球状物体,表面较为光滑,且该碳微球尺寸分布较均匀,平均粒径约为350 nm。

图1 果糖基碳微球的TEM图和SEM图Fig.1 TEMand SEM images of fructose-based carbon microspheres
为探究果糖基碳微球的组装过程及机理,采用SEM对不同水热反应时间(2、2.5、3、3.5、4和6 h)下产物的形貌进行了表征,结果如图2所示。由图2可知,反应时间为2 h(见图2(a))时,产物呈薄片状,未有球体出现;当反应时间增至2.5 h(见图2(b)),部分产物以球状形式存在,但仍有部分产物呈半碗状。随着反应时间延长至3和3.5 h(见图2(c)和图2(d))时,产物逐渐形成球状形貌,但生成的球状物表面不平滑,褶皱状明显。当反应时间逐渐增至6 h(见图2(f)),可以观察到产物表面越来越光滑。因此,随着反应时间的延长,产物从最初的薄片状结构逐渐变成球状结构,最终制备出表面光滑且尺寸较为均匀的果糖基碳微球。结合有关学者对葡萄糖水热碳化所进行的研究[13],推测果糖成球机理主要为:在水热处理过程中,果糖首先发生脱水反应,生成呋喃类化合物和有机酸。在酸性条件下,呋喃类化合物发生分子间脱水及羟醛缩合等反应,生成聚合物。同时,随着水热反应时间的不断延长,Pluronic P123胶束大量聚集成团簇,为果糖在其上的组装提供了生长位点,从而使果糖基碳微球发生了从片状结构到球状结构的转变。

图2 不同反应时间下产物的SEM图Fig.2 SEMimagesof products synthesized under different reaction time
2.1.2 元素分析
对果糖基碳微球进行XPS分析,以表征其元素分布,结果如图3所示。由图3可知,285.1和533.1 eV处的波峰分别代表C1s和O1s,经计算,果糖基碳微球的C/O比为3.62,而未经处理的果糖C/O比为1,可知果糖基碳微球的含氧量相比果糖明显减少;推测这是由于经过水热处理,果糖发生了脱水反应,导致大量H原子和O原子脱除,从而使C/O升高。C含量的明显增加说明果糖在实验过程中已完成较大程度的碳化。
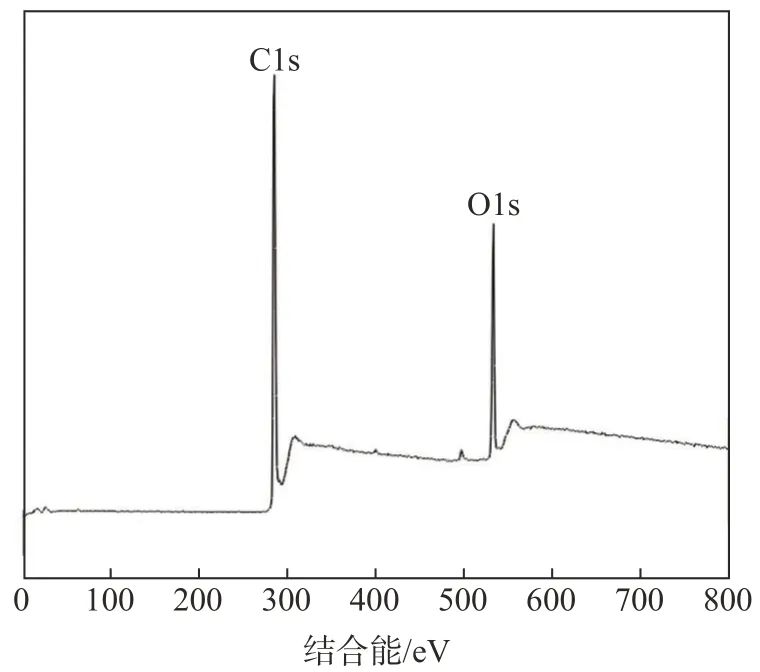
图3 果糖基碳微球的XPS谱图Fig.3 XPSspectrumof fructose-based carbon microsphere
2.2 果糖基碳微球吸附行为研究
2.2.1 FT-IR表征
果糖及果糖基碳微球吸附MB前后的FT-IR谱图如图4所示。由图4可知,相较于果糖,水热碳化后的果糖基碳微球在3400~3500 cm-1处的—OH吸收峰明显减弱,且在1610 cm-1处出现新的特征吸收峰,这可能是因为果糖水热碳化后发生了脱水、缩合、芳构化,导致—OH伸缩振动的弱化与新骨架呋喃环/苯环的形成。但2900 cm-1处的—CH特征吸收峰、1700 cm-1处的C=O特征吸收峰以及1115 cm-1处的C—O—C振动特征吸收峰,说明果糖虽发生脱水反应,但水热碳化后产物的骨架没有发生改变,仍保留果糖的基本结构。对比吸附MB前后果糖基碳微球的FT-IR谱图,发现二者的红外吸收峰峰形相近,吸收峰峰位没有出现较大偏移,吸附MB后,果糖基碳微球的FT-IR谱图仅在1015 cm-1处出现新的C—S特征吸收峰,此峰为MB的特征吸收峰。
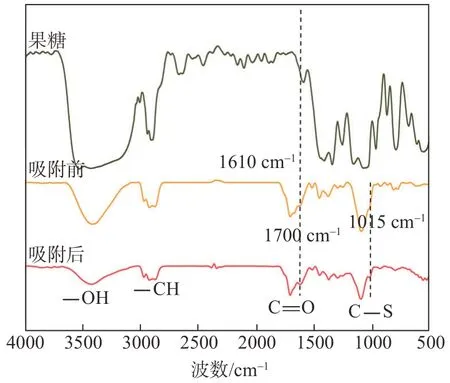
图4 果糖及果糖基碳微球吸附MB前后的FT-IR谱图Fig.4 FT-IRspectra of fructose,fructose-based carbon microspheresbeforeand after adsorption of MB
2.2.2 果糖基碳微球用量对其吸附性能的影响
通过改变果糖基碳微球的用量,探究其对MB吸附性能的影响,结果如图5所示。由图5可知,当果糖基碳微球的用量从5 mg增至50 mg,其对MB的吸附量由188.72 mg/g降至36.41 mg/g,而吸附率则从47.2%提高至91.4%。随着果糖基碳微球用量的增加,其中的吸附位点数量不断增加,因此,其对MB的吸附率有所提高,然而单位质量的吸附量有所下降。当果糖基碳微球用量大于20 mg,吸附率曲线逐渐趋于平缓,平衡时吸附率为91.5%。综合考虑吸附率和吸附量,后续实验中选定果糖基碳微球的用量为20 mg。

图5 果糖基碳微球用量对吸附量和吸附率的影响Fig.5 Effect of dosageof fructose-based carbon microspheres on the adsorption capacity and adsorption rate
2.2.3 吸附时间对吸附性能的影响及吸附动力学分析
图6为吸附时间对果糖基碳微球吸附MB的影响,其中MB初始浓度C0=20 mg/L。由图6可知,随着吸附时间的延长,果糖基碳微球对MB的吸附量呈先快速增加后逐渐趋于平缓的趋势,吸附时间为100 min时,达到吸附平衡。随着MB将果糖基碳微球表面的吸附位点占满而进入碳微球内部,吸附随之较难进行,导致吸附速率下降,吸附逐渐达到平衡。
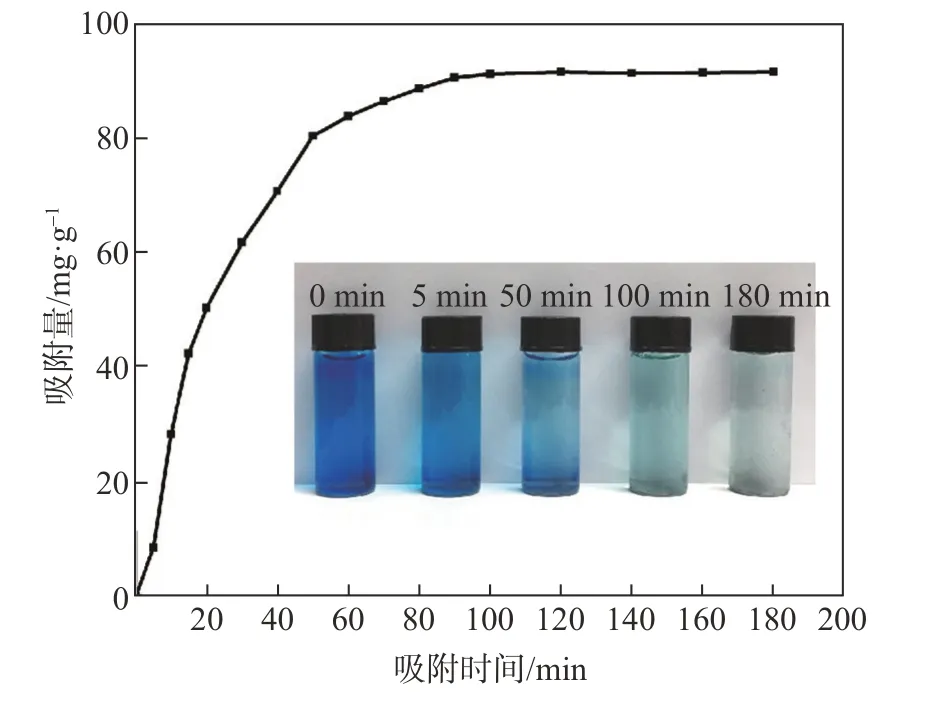
图6 吸附时间对吸附量的影响Fig.6 Effect of adsorption timeon theadsorption capacity
为探究果糖基碳微球的吸附机理,采用准一级、准二级动力学方程对吸附数据(公式(3)和公式(4))进行线性拟合,拟合结果如表1所示。由表1可知,准二级动力学方程拟合的相关系数R2为0.9946,高于准一级动力学方程拟合系数(0.9931),准二级动力学方程计算的理论平衡吸附量与实测值(91.67 mg/g)也较为接近,结合相关系数R2及理论平衡吸附量可知,果糖基碳微球吸附MB更符合准二级动力学模型所描述的规律,其吸附过程主要以化学吸附为主[14-16]。

表1 果糖基碳微球吸附MB的准一级和准二级动力模型参数Table 1 Pseudo-first-order and pseudo-second-order model parameters for MB adsorption by fructosebased carbon microspheres
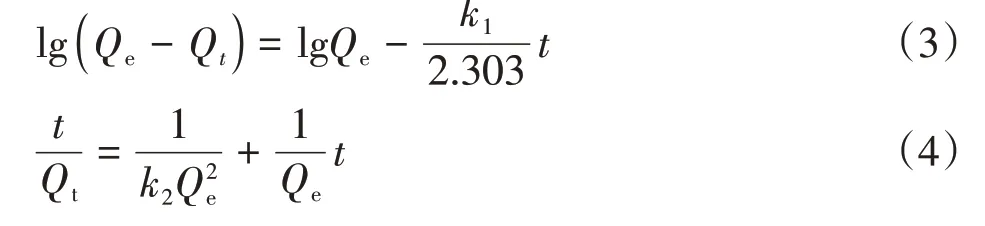
式中,Qt表示时间为t时的吸附量,mg/g;k1为准一级动力学平衡常数,min-1;k2为准二级动力学平衡常数,g·mg/min。
2.2.4 MB初始浓度对吸附性能的影响及吸附等温曲线分析
图7为不同初始浓度的MB(0~25 mg/L)在不同实验温度(293~313 K)下对果糖基碳微球吸附MB的影响。由图7可知,在不同温度下,随着MB初始浓度的增加,果糖基碳微球对MB的吸附量均呈升高趋势。此外,随着温度的升高,分子运动速率加快,吸附剂更加活泼。因此,在同一初始浓度下,升高温度有利于果糖基碳微球对MB吸附量的提高。

图7 不同温度下MB初始浓度对吸附量的影响Fig.7 Effect of initial MBconcentration on the adsorption capacity at different temperatures
分别采用Langmuir吸附方程和Freundlich吸附方程拟合果糖碳微球对MB的等温吸附模型(公式(5)和公式(6)),结果如表2所示。从表2可以看出,各温度下Langmuir等温吸附模型的相关系数R2均大于0.99且大于采用Freundlich等温吸附模型拟合的R2,说明MB以单分子层方式吸附于果糖基碳微球表面,MB各分子间无相互作用[17-19]。本课题中,果糖基碳微球对MB的吸附更适合以Langmuir等温吸附模型描述。

表2 不同温度下果糖基碳微球吸附MB的Langmuir和Freundlich等温吸附模型参数Table 2 Langmuir and Freundlich isotherm adsorption model parameters for MB adsorption by fructose-based carbon microspheres at different temperatures

式中,KL为Langmuir等温吸附模型的平衡吸附常数,L/mg;KF为Freundlich等温吸附模型的单位容量常数,L/mg;n为Freundlich等温吸附模型的常数,mg/g;Qmax为吸附过程的理论饱和吸附量,mg/g;Ce为达到吸附平衡时MB的浓度,mg/L。
2.2.5 重复回用性能
吸附剂的重复利用对吸附成本的降低,以及减少吸附剂所产生的二次环境污染均具有重要意义。因此,本课题对所制备的果糖基碳微球循环使用性能进行了研究,结果如图8所示。由图8可知,随着吸附循环次数的增加,果糖基碳微球对MB的吸附量逐渐下降,从初始的91.43 mg/g降至5次循环使用后的70.27 mg/g,为初始吸附量的76.9%。这是因为,果糖基碳微球经反复吸附-解吸后,一部分吸附位点未能完全解吸,吸附位点的减少使得其吸附量下降。虽然经过多次吸附-解吸后果糖基碳微球的吸附能力有所下降,但仍具有较高的吸附量,表明果糖基碳微球是一种稳定的吸附材料,可被循环利用。

图8 果糖基碳微球的循环使用性能Fig.8 Reusability of fructose-based carbon microspheres
3 结论
3.1 利用水热碳化法成功制备新型果糖基碳微球吸附材料,通过扫描电子显微镜(SEM)和透射电子显微镜(TEM)对其进行形貌结构表征;结果表明,经反应6 h后,可制得表面光滑且尺寸分布均匀的果糖基碳微球,其平均粒径为350 nm。果糖主要经历脱水、聚合和芳构化过程,最终制得果糖基碳微球。
3.2 利用果糖基碳微球对亚甲基蓝(MB)进行吸附实验,结果表明,在pH值=6、MB初始浓度20 mg/L、果糖基碳微球用量20 mg的条件下,经100 min后可达到吸附平衡;经计算,果糖基碳微球对MB的平衡吸附量为91.43 mg/g。经过拟合,表明果糖基碳微球对MB的吸附过程符合准二级吸附动力学,可采用Langmuir和Freundlich等温吸附模型描述其吸附过程,但Langmuir等温吸附模型相对更准确。经5次吸附循环后,果糖基碳微球对MB的吸附量为70.27 mg/g,为其初始吸附量的76.9%,表明本课题制备的果糖基碳微球具有良好的循环使用性能。
3.3 本课题以果糖为原料所制备的碳微球吸附材料是一种绿色环保的生物质基材料,进行废水吸附后可被回收重复利用,不会对环境造成二次污染,是一种环境友好型吸附材料,在水处理方面具有较好的应用前景。

