玉米黄素对衣霉素诱导的SH-SY5Y细胞周期、自噬、凋亡的保护作用
章丽娜,李梦洁,商迎辉,刘芸如,黄汉昌,劳凤学
(北京市生物活性物质和功能食品重点实验室,北京联合大学功能因子与脑科学研究院,北京 100191)
阿尔茨海默症(Alzheimer disease,AD)又称原发性老年痴呆,是最常见的具有复杂病理生物学特性的痴呆症,伴随着至少大脑两个区域的思维和记忆功能损伤[1-2]。AD患者的神经心理特征包括记忆力以及其他认知领域(语言)的减退[3],其特征性病理表现为老年斑、Tau蛋白磷酸化形成神经元纤维缠结(neurofibrillary tangles,NFT)以及神经元细胞发生丢失等[4]。AD引起的痴呆与整个疾病过程中进行性疾病发作有关,在症状发作的5~12 年内通常不可避免地导致死亡的发生[5]。因此,开发预防或减慢疾病进展速度的疾病改良疗法变得十分迫切,中晚期临床试验的不断失败阻碍着AD药物开发的进程[6]。
内质网应激(endoplasmic reticulum stress,ERS)是AD早期阶段的重要病理表现,内质网中未折叠蛋白发生积累会触发一种称为未折叠蛋白反应(unfolded protein response,UPR)的细胞应激反应,在AD患者中其激活量会增加[7]。在哺乳动物体内,UPR细胞有3种感受器可以感应出ERS的激活,分别是抑制物阻抗性酯酶1α(inositol-requiring enzyme-1α,IRE1α)、蛋白激酶R样内质网激酶(protein kinase R-like endoplasmic reticulum kinase,PERK)、活化转录因子6(activating transcription factor 6,ATF6)[8]。
在体外实验中,衣霉素(tunicamycin,TM)已广泛应用于ERS模型[9],其可诱导细胞凋亡[10]、细胞周期变化[11]、细胞自噬[12]。从酵母到哺乳动物,细胞自噬是通过促进衰老和细胞毒性成分的降解和循环来维持细胞内稳态的重要机制,在自噬期间,目标物被捕获至双膜囊泡,形成自噬小体,并通过溶酶体融合降解[13]。TM可以诱导SH-SY5Y产生细胞毒性,上调葡萄糖调节蛋白78(glucose-regulated protein 78,GRP78)、促凋亡蛋白C/EBP同源蛋白(C/EBP homologous protein,CHOP)和磷酸化的真核生物起始因子2α(phosphorylation of eukaryotic initiation factor 2α,p-eIF2α)等ERS标记物蛋白水平[14]。ERS诱导剂TM可以诱导黑色素瘤细胞细胞周期发生G1期阻滞[11]。TM可以诱导自噬,而内质网中未折叠蛋白质的积累是ERS条件下自噬的触发因素[12]。此外,TM诱导ERS而引起的自噬能缓解短暂性脑缺血损伤[15]。综上,细胞自噬、周期、凋亡与ERS之间存在联系,且在机体中存在协调细胞稳态的作用。
有研究表明,维甲酸和脑源性神经营养因子(brainderived neurotrophic factor,BDNF)分化的神经母细胞瘤细胞(SH-SY5Y)用以亚致死剂量冈田酸和β-淀粉样蛋白(amyloid β-protein,Aβ)的可溶性寡聚体联合刺激,在不引起细胞活力显著下降的情况下,可有效提供一种模拟AD作用下胆碱能神经元早期病理生理的体外模型[16]。Aβ42处理SH-SY5Y细胞后可导致细胞活力下降、形态学改变,从而增加活性氧水平,该研究证明SH-SY5Y细胞可以作为研究阿尔茨海默病病理的模型[17]。因此,本实验采用SH-SY5Y细胞进行ERS AD模型的构建,以期为后期AD病理的研究提供数据支撑。
玉米黄素(zeaxanthin,Zea)是一种类胡萝卜素,在自然界中分布广泛,多存在于玉米种子、万寿菊和绿色蔬菜等植物组织以及一些蓝藻、光致性细菌的光合膜中[18],其在部分食品中玉米黄素的含量如表1所示。玉米黄素的分子结构式如图1所示,其在自然界中绝大多数以(3R,3’R)-玉米黄素存在,(3R,3’S)-玉米黄素为内消旋玉米黄素,(3S,3’S)-玉米黄素型则占少量。玉米黄素在每个β-紫罗兰酮环上具有一个羟基。这些羟基之一与Aβ的两个氨基酸(缬氨酸39和异亮氨酸41)相互作用,另一个β-紫罗兰酮环上的羟基与Aβ的甘氨酸25相互作用,而玉米黄素与Aβ的氨基酸作用都不存在于Aβ位点,因而很可能导致β原纤维的崩解[19]。玉米黄素的生物活性成分在大脑疾病(特别是AD领域)中研究较少,但玉米黄素可以通过血脑屏障并且存在抗Aβ聚集的相关结构,具有干预脑部疾病的研究价值。

表1 玉米黄素在食品中的含量Table 1 Contents of zeaxanthin in foods
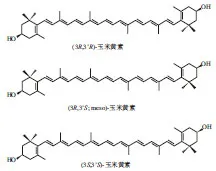
图1 玉米黄素的化学结构式Fig. 1 Chemical structures of zeaxanthin
本实验用TM处理SH-SY5Y细胞,建立ERS模型,用玉米黄素对其进行干预,测定细胞存活率、细胞周期、自噬和凋亡相关蛋白表达,以研究玉米黄素对TM引起的细胞自噬、凋亡、周期的调节作用,为玉米黄素的功能性作用研究及AD的预防和治疗提供理论依据。
1 材料与方法
1.1 材料与试剂
SH-SY5Y细胞 中国医学科学院基础医学研究所细胞资源中心。
衣霉素 北京华越洋生物科技有限公司;玉米黄素(纯度为85.7%) 上海源叶生物科技有限公司;RPMI 1640培养基 美国Gibco公司;双抗(青霉素-链霉素)北京Solarbio公司;胎牛血清、胰蛋白酶 美国Hyclone公司;噻唑蓝、Anti-β-actin抗体 美国Sigma公司;Anti-Beclin1抗体、Anti-Beclin1-C 中国台湾Abnova公司;Anti-GAPDH和Anti-LC3B抗体 美国Cell Signaling Technology公司;Anti-BCL2抗体 英国Abcam公司;辣根过氧化物酶山羊抗鼠免疫球蛋白(immunoglobulins,Ig)G(H+L) 北京中杉金桥公司;BCA蛋白定量测定试剂、辣根过氧化物酶山羊抗兔IgG(H+L)北京鼎国昌盛生物技术有限责任公司;细胞周期检测试剂盒 北京四正柏生物公司;ECL化学发光试剂盒武汉Servicebio公司。
1.2 仪器与设备
E191IR型CO2细胞培养箱 美国金西盟公司;CKX41倒置显微镜 日本Olympus公司;Varioskan Flash多功能酶标仪、ND-1000型紫外-可见分光光度计 美国赛默飞世尔科技公司;凝胶成像分析仪 日本Image Quant RTECL公司;5840R型低温高速离心机 德国Eppendorf公司;043BR57802转膜装置、EN027015电泳装置 美国BIO-RAD公司。
1.3 方法
1.3.1 SH-SY5Y细胞培养
将复苏后的SH-SY5Y细胞与10%胎牛血清和1%青霉素-链霉素的RPMI 1640培养基混合均匀后,置于37 ℃、5% CO2的恒温培养箱中培养,取处于对数生长期的细胞进行后续实验。细胞密度占培养皿皿底70%~80%的时候进行传代,按细胞的生长状态和速度进行培养液的更换。
1.3.2 建立损伤模型
用新鲜培养基重悬处于对数生长期的SH-SY5Y细胞,混匀后进行细胞计数,根据实验需求及培养皿大小接种SH-SY5Y细胞,在5% CO2、37 ℃条件下过夜培养,覆盖率达到70%~80%时,使用5 μg/mL TM(TM用二甲基亚砜溶解配制成10 μg/μL的储存液,-20 ℃保存,使用时用培养基稀释至所需质量浓度)在37 ℃培养箱中静置36 h诱导ERS模型。
1.3.3 细胞实验分组
细胞培养过程同1.3.1节,将细胞分组为空白对照组、玉米黄素组、TM损伤组、损伤加保护组,其中空白对照组不作处理,玉米黄素组仅使用5 μmol/L玉米黄素(玉米黄素用无水乙醇配制成30 mmol/L的原溶液,使用时用新鲜培养液稀释至所需浓度)处理(6 h预处理加24、36、48 h处理),TM损伤组仅使用5 μg/mL TM处理(24、36、48 h),TM损伤加保护组为5 μmol/L玉米黄素预处理6 h后加TM共处理24、36、48 h。
1.3.4 细胞活性检测
取生长状态良好的SH-SY5Y细胞,用0.25 g/mL胰蛋白酶溶液于室温条件下消化,摇晃培养皿直到细胞在显微镜下快速脱落后,按1×105个/mL细胞密度接种于96 孔板,37 ℃、5% CO2培养箱中培养过夜,采用1.3.3节分组处理,每孔加入提前配好的噻唑蓝溶液,与培养液混匀,使噻唑蓝溶液终质量浓度至5 mg/mL,室温孵育4 h,然后终止培养,1 000 r/min离心10 min使结晶物沉于96 孔板底部,小心吸弃上清液,每孔中加入150 μL二甲基亚砜,振荡10 min充分溶解结晶物。利用酶标仪在570 nm波长处测定OD值。使用下式计算细胞相对存活率。
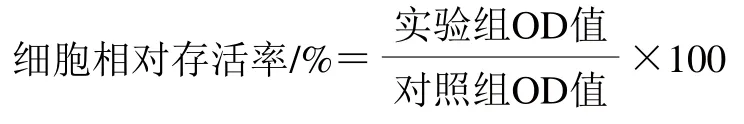
1.3.5 细胞周期检测
将处于对数生长期的SH-SY5Y细胞按3×104个/mL接种到6 cm培养皿,放入恒温培养箱中37 ℃培养过夜。次日按1.3.3节分组加药处理后,继续培养36 h。按照细胞周期检测试剂盒说明书对样品进行处理,所得样品24 h内利用流式细胞仪检测细胞周期,收集数据于CELL QUEST PRO软件,细胞周期分析用Modifit LT软件进行。
1.3.6 Western blot分析
细胞培养与药物处理同1.3.1节和1.3.3节。用1 mL的磷酸盐缓冲液(phosphate buffered saline,PBS)洗涤细胞2~3次后,在6 mL培养皿中加入约150 μL含蛋白酶抑制剂的RIPA细胞裂解液,使用细胞刮收集细胞于培养皿中,冰上裂解30 min,4 ℃、12 000×g离心10 min后收集上清液,BCA法测定上清液中蛋白质质量浓度。5×十二烷基硫酸钠(sodium dodecyl sulfate,SDS)上样缓冲液按体积比4∶1加入到蛋白裂解液中,于100 ℃条件下煮沸变性5 min。冷却后置于-20 ℃保存。样品中目标蛋白采用SDS-聚丙烯酰胺凝胶电泳分离,再将目标蛋白转移到聚偏氟乙烯膜上,利用5%的脱脂奶粉室温封闭2 h,一抗4 ℃条件下振荡过夜孵育。次日,TBST缓冲液洗涤3次,每次10 min,二抗37 ℃孵育2 h,用TBST缓冲液洗涤3次。利用ECL化学发光试剂盒处理聚偏氟乙烯膜蛋白条带,在化学发光成像系统上曝光膜上条带。以β-actin和GAPDH为内参,使用Image J软件分析条带的灰度。
1.4 数据处理与分析
各实验分组进行3组及以上平行,所有数据结果用平均值±标准差表示,利用SPSS 19.0软件中单因素方差分析法进行分析,并通过Bonferroni法进行多重比较,以P<0.05表示差异显著,P<0.01表示差异极显著;利用Origin 2018软件作直方图。
2 结果与分析
2.1 玉米黄素与TM共处理时间筛选
采用玉米黄素预处理6 h后再与TM共处理24、36、48 h,检测各组的细胞洗涤存活率,由图2可知,玉米黄素预处理6 h后TM与玉米黄素共处理24、36、48 h,与单独TM处理相比,共处理不同时间对TM引起的SH-SY5Y细胞损伤均存在一定缓解作用,随着处理时间的延长,损伤加保护组与TM损伤组之间开始出现显著性差异。由图2A~C可知,与空白对照组相比,TM单独处理时在不同时间下细胞相对存活率均极显著下降(P<0.01),共处理时间为24、36、48 h时TM损伤组SH-SY5Y细胞的相对存活率分别为73.38%、59.86%、55.13%(当相对存活率约为40%时建模效果较好),损伤加保护组细胞存活率均高于TM损伤组,分别为77.10%、74.60%、67.97%,其中与TM损伤组相比,36 h时SH-SY5Y细胞相对存活率出现极显著上升(P<0.01)。综合各因素考虑,后续实验选择TM与玉米黄素共处理时间为36 h进行实验。
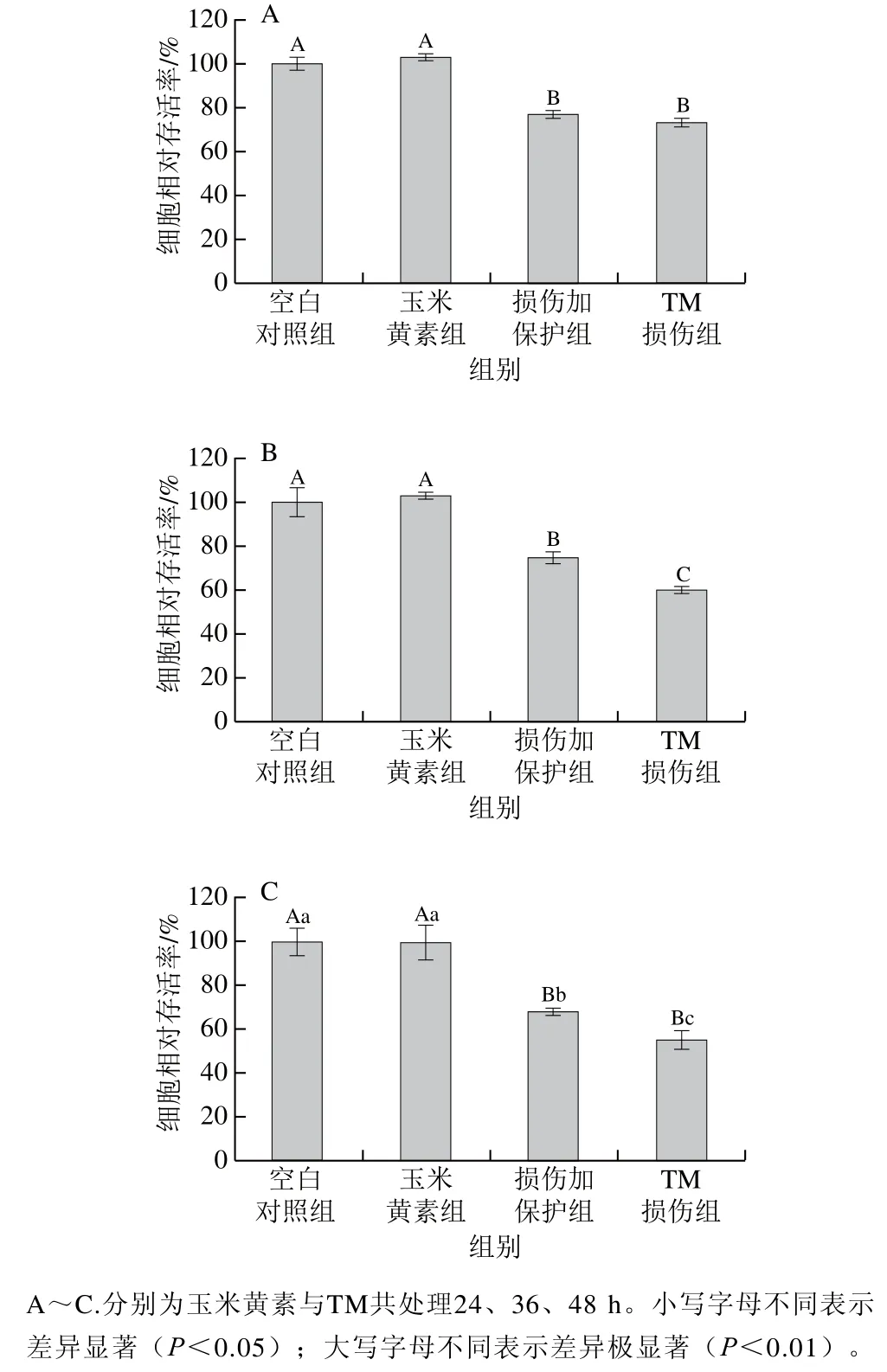
图2 玉米黄素与TM共处理时间对SH-SY5Y细胞活性的影响Fig. 2 Effect of co-treatment time of zeaxanthin and TM on cell viability of SH-SY5Y cells
2.2 玉米黄素对TM引起的细胞周期的影响
采用流式细胞术检测TM与玉米黄素处理引起的细胞周期改变。由图3A~D和表2可知,与空白对照组相比,TM损伤组G0/G1期细胞量均出现极显著上升(P<0.01),同时G2/M期细胞量极显著减少(P<0.01)。玉米黄素预处理6 h后再与用TM共处理的细胞,相较于TM损伤组,G0/G1期的细胞数量发生减少。由图2E可知,TM损伤组、损伤加保护组的G2/M和S期样品数据偏小、颜色偏蓝,G0/G1期样品数据偏大、颜色偏红;空白对照组、玉米黄素组G2/M和S期的样品数据偏大、颜色偏红,而G0/G1期的样品数据偏小、颜色偏蓝,结果同表2结果一致。说明玉米黄素可以延缓TM引起的G1期阻滞。
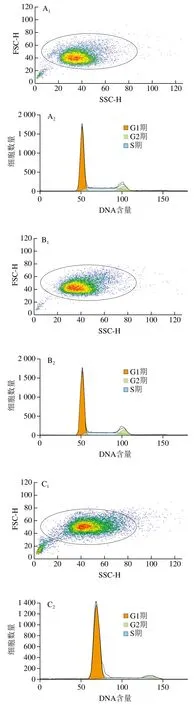
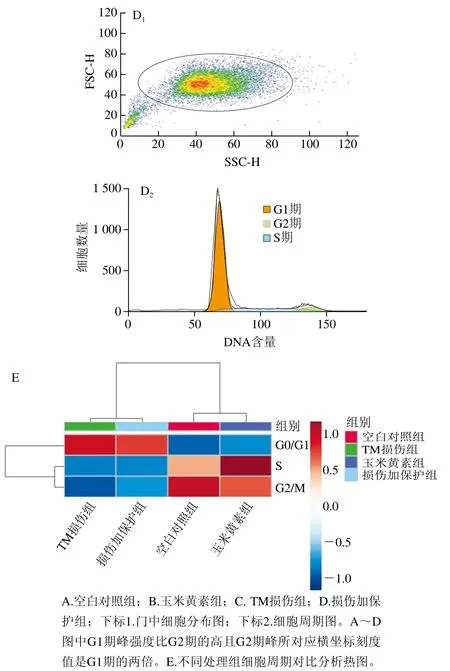
图3 玉米黄素处理对TM引起的SH-SY5Y细胞周期的影响Fig. 3 Effect of zeaxanthin treatment on cell cycle of SH-SY5Y cells damaged by TM
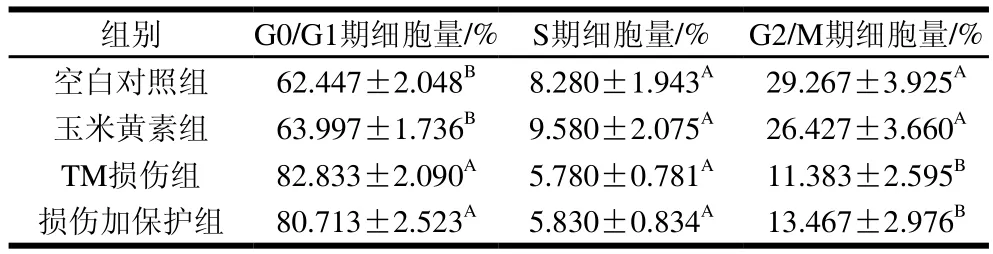
表2 定量分析玉米黄素对TM诱导SH-SY5Y细胞周期的影响Table 2 Effect of zeaxanthin on cell cycle of SH-SY5Y cells damaged by TM
2.3 玉米黄素对TM处理引起的细胞自噬和凋亡相关蛋白的影响
2.3.1 玉米黄素对TM处理引起的细胞自噬蛋白的影响
2.3.1.1 玉米黄素对TM处理引起Beclin1蛋白表达量的影响
在稳态的平衡中,自噬可能起到双重作用,一种是保护细胞免于凋亡,另一种则是其过度激活会促进ERS诱导细胞死亡。而Beclin1基因被证实是第一个在哺乳动物中发现的自噬基因,其有助于自噬体的形成[20]。如图4和表3所示,与空白对照组相比,TM损伤组Beclin1蛋白的表达水平显著增加(P<0.05),而损伤加保护组可以使TM引起的Beclin1表达增加得到缓解。说明玉米黄素通过缓解TM引起的Beclin1表达增加来实现对细胞自噬的减轻作用。
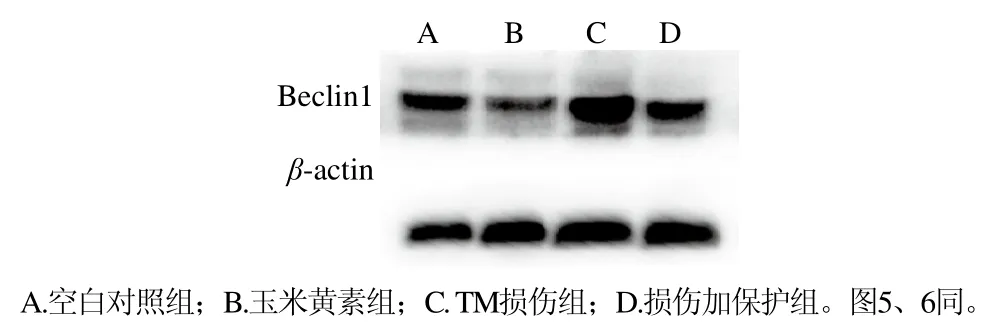
图4 玉米黄素联合TM对SH-SY5Y细胞自噬蛋白Beclin1的影响(n= 3)Fig. 4 Effect of zeaxanthin combined with TM on the expression of Beclin1 in SH-SY5Y cells (n = 3)
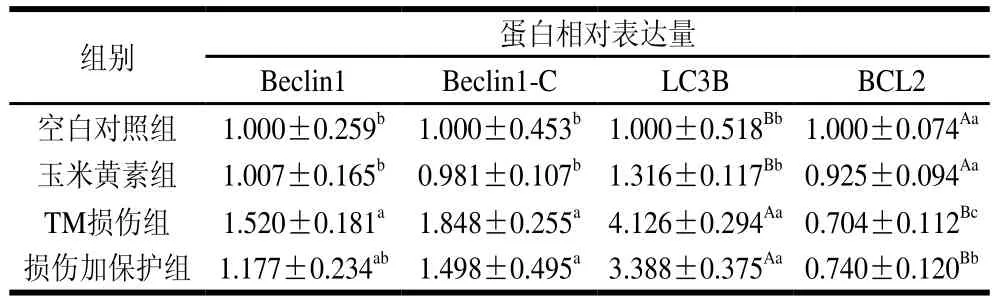
表3 玉米黄素对TM诱导SH-SY5Y细胞自噬和凋亡蛋白的影响Table 3 Effect of zeaxanthin on the expression of protein associated with autophagy and apoptosis in SH-SY5Y cells induced by TM
2.3.1.2 玉米黄素对TM处理引起Beclin1-C和LC3B蛋白表达量的影响
自噬蛋白Beclin-1裂解产生N和C末端。C末端片段在细胞中对凋亡信号敏感,N末端则无活性。因此,Beclin1-C蛋白表达增加可以诱导凋亡的发生,是细胞自噬转向凋亡的关键蛋白。LC3B是研究最多的自噬家族蛋白,它与自噬体的发育和成熟有关,可用于监测自噬活性[13]。如图5和表3所示,对Beclin1-C蛋白而言,TM损伤组与空白对照组相比Beclin1-C表达量显著上升(P<0.05)。与TM损伤组相比,损伤加保护组Beclin1-C表达量出现下降但差异不显著。而对LC3B蛋白而言,与空白对照组相比,TM损伤组LC3B表达量出现极显著上升(P<0.01)。与TM损伤组相比,损伤加保护组能够下调TM引起的LC3B表达量上调,但效果不显著。
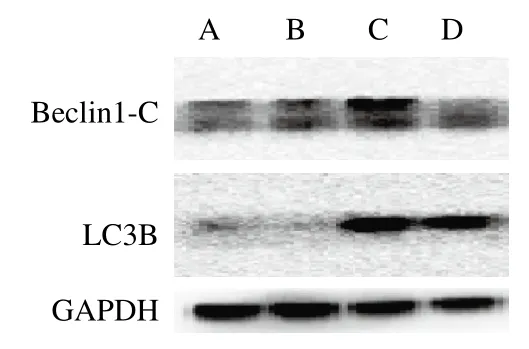
图5 玉米黄素联合TM对SH-SY5Y细胞自噬蛋白Beclin1-C和LC3B的影响(n= 3)Fig. 5 Effect of zeaxanthin combined with TM on the expression of Beclin1-C and LC3B in SH-SY5Y cells (n = 3)
2.3.2 玉米黄素对TM处理引起凋亡蛋白BCL2表达量的影响
BCL2是一种抗凋亡蛋白,在内质网中BCL2与Beclin-1密切相关且相互结合,抑制Beclin-1免受切割,从而起到促进自噬的功能。由图6和表3可知,与空白对照组相比,TM处理可以极显著降低BCL2的表达水平(P<0.01),起到促进凋亡的作用,而损伤加保护组能显著缓解该蛋白表达量的下降(P<0.05)。说明玉米黄素可以缓解TM引起的抗凋亡蛋白BCL2表达量的下降。

图6 玉米黄素联合TM对SH-SY5Y细胞凋亡蛋白BCL2的影响(n= 4)Fig. 6 Effect of zeaxanthin combined with TM on the expression of BCL2 protein in SH-SY5Y cells (n = 4)
本研究结果表明,玉米黄素(5 μmol/L)可有效拮抗TM(5 μg/mL)诱导的细胞自噬和凋亡。与空白对照组相比,TM损伤显著增加Beclin1(P<0.05)、LC3B(P<0.01)和Beclin1-C(P<0.05)的表达量,降低BCL2表达量(P<0.01),而玉米黄素对TM引起的自噬蛋白表达量的上升和抗凋亡蛋白表达量的下降均具有拮抗作用,其中BCL2表达改变差异显著(P<0.05)。由此可知,玉米黄素可以缓解TM诱导的细胞自噬和凋亡。
3 讨 论
2021年,65岁及以上AD患者所支付的医疗、长期护理和临终关怀服务的总金额估计为3 550亿 美元[21]。因此,对AD的干预研究刻不容缓。目前为止,细胞内Tau蛋白磷酸化所形成NFT仍然同细胞外的Aβ沉积所形成轴突斑块一起作为AD的主要病理学特征[22-23]。然而AD的发病机制一直未明,缺乏有效的诊断与治疗方法[24]。
ERS是AD的早期事件,其被激活时间在AD病理征状出现之前。主要是由于AD神经元中内质网错误折叠蛋白质的增多引发内质网内稳态的失衡[25]。ERS被激活后会引发自噬,自噬是哺乳动物细胞清除异常蛋白的重要过程,是维持蛋白质稳态重要防御系统,但过度的自噬会引起细胞的死亡[26]。此外,自噬在细胞凋亡过程中扮演双重角色,分别表现出抗凋亡和促凋亡的特性[27-28]。研究表明,ERS可调控自噬、凋亡、周期过程[29]。因此,寻找有效的生物活性物质在AD早期阶段抑制ERS过程具有重要意义。
玉米黄素作为类胡萝卜素,其化学结构中存在羟基,对抗淀粉样蛋白生成活性至关重要[30]。在一项针对AD患者的临床试验中,与对照组患者相比,AD患者血清中玉米黄素浓度降低,视力下降,年龄相关性黄斑变性发生率增高[31]。此外,类胡萝卜素的多烯主链通过疏水性相互作用抑制Aβ原纤维的形成[32-33]。综上,玉米黄素具有抗AD的潜力。
本实验通过ERS诱导剂TM建立SH-SY5Y ERS损伤模型,研究玉米黄素干预对ERS损伤引起的细胞周期、自噬、凋亡的影响,进而探究其在AD细胞模型中的作用。结果表明,在共处理时间(24、36、48 h)筛选中,玉米黄素与TM共处理36 h可合理地对SH-SY5Y细胞进行损伤保护。对SH-SY5Y细胞分组进行细胞周期检测与分析,发现TM明显具有阻滞G1期细胞向S期转变的作用,而玉米黄素处理可以减轻TM诱导的G1期细胞阻滞。Western blot结果表明,TM可以诱导细胞自噬蛋白Beclin1、Beclin1-C、LC3B的表达,下调抗凋亡蛋白BCL2的表达,而玉米黄素均起到逆转作用。
综上所述,玉米黄素对TM诱导的SH-SY5Y细胞损伤具有保护作用,其可能是通过玉米黄素减轻细胞在G1期发生的阻滞、缓解自噬以及抗凋亡来实现。

