普洱熟茶对D-半乳糖衰老模型小鼠肠道菌群的影响
雷舒雯,侯 艳,2,陈德洪,龚加顺,*
(1.云南农业大学食品科学技术学院,云南 昆明 650201;2.云南农业大学茶学院,云南 昆明 650201;3.云南农业大学动物医学院,云南 昆明 650201)
衰老是指机体的结构、功能的代谢及适应性逐渐衰退的总现象[1]。机体的衰老与其生理机能及各种病理过程密切相关。我国已经进入老龄化严重阶段,截至2019年底,中国60岁以上老年人口约2.54亿,占总人口的18.1%。随着人口老龄化加快,由衰老导致的慢性病(如帕金森病、阿尔兹海默症、癌症、糖尿病等)已成为人们关注和研究的热点。有研究报道,人类的健康、衰老和长寿与肠道微生物群有关[2]。当人们处于衰老期,肠道生理功能随着时间的推移,其免疫功能逐渐减退,加之多种外因(生活方式、饮食习惯、运动情况、药物使用等)使肠道菌群发生质和量的变化,导致肠道微生物群多样性降低[3-4]。已有研究表明生活在肠道中的微生物或能改变机体的老化进程[5]。
普洱茶是我国云南特有名茶,深受消费者喜爱。现代医学研究表明,普洱茶具有调节肠道菌群、抗衰老、抗氧化、增强免疫、减肥降脂等功效[6-9],对人体起到保健的作用。普洱茶能够避免氧化剂造成的氧化损伤,改善体内氧化还原状态,进而发挥抗衰老作用[10]。普洱熟茶对肠道菌群失调小鼠有改善作用,并在一定程度上能够调节肠道内的菌群结构使其趋于多样性,从而使肠道微生态系统更加健康稳定,维持机体的健康[11]。目前有关普洱熟茶通过调节肠道菌群来改善机体衰老的研究鲜见报道。因此,本研究采用D-半乳糖(D-galactose,D-gal)致衰老模型小鼠,以普洱熟茶水提物为受试物对衰老小鼠进行干预,通过16S rDNA测序技术分析衰老小鼠肠道菌群的变化,探究普洱熟茶能否通过改善小鼠的肠道菌群而达到延缓衰老的作用,以期为普洱熟茶保健功效进一步的开发利用提供科学依据。
1 材料与方法
1.1 动物、材料与试剂
SPF级雄性C57BL/6小鼠,5~6周龄,体质量为(20±2)g,购自常州卡文斯实验动物有限公司(许可证号:SCXK(苏)2016-0010);动物饲料 江苏省协同医药生物工程有限责任公司。
大益牌普洱熟茶(‘唛号7262’,批次1801,2018年7月5日生产) 勐海茶厂;D-gal 美国Sigma-Aldrich公司;0.9%生理盐水 山东齐都药业有限公司;超氧化物歧化酶(superoxide dismutase,SOD)试剂盒、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)试剂盒、丙二醛(malondialdehyde,MDA)试剂盒、二喹啉甲酸(bicinchoninic acid,BCA)蛋白浓度检测试剂盒上海酶联生物科技有限公司;4%多聚甲醛通用型组织固定液 广州赛国生物科技有限公司;无水乙醇、二甲苯、中性树胶 国药集团化学试剂有限公司;苏木素-伊红(hematoxylin-eosin,HE)染液套装 赛维尔生物科技有限公司。
1.2 仪器与设备
RE-52AA旋转蒸发仪 上海亚荣生化仪器厂;RT-6100酶标仪 济南骏驰生物科技有限公司;TG16W离心机 长沙湘智离心机仪器有限公司;JJ-12J脱水机、JB-P5包埋机 武汉俊杰电子有限公司;RM2016病理切片机 上海徕卡仪器有限公司;GFL-230烤箱 天津市莱玻瑞仪器设备有限公司;Nikon Eclipse E100正置光学显微镜、NIKON DS-U3成像系统 日本尼康公司。
1.3 方法
1.3.1 普洱熟茶水提物制备
普洱熟茶磨碎80目过筛,将茶样按1∶50(m/V)茶水比于沸水浸提10 min,趁热过滤,重复5次,茶汤减压低温((60±1)℃)浓缩至1 g/mL,装瓶灭菌(120 ℃、15 min),4 ℃低温冷藏。
1.3.2 普洱熟茶水提物组分的测定
蛋白质含量测定采用考马斯亮蓝法[12],标准曲线方程为y=0.531 3x+0.025 2,R2=0.990 4(x为牛血清白蛋白质量浓度/(mg/mL)、y为595 nm波长处吸光度)。氨基酸含量测定采用茚三酮比色法[13],标准曲线方程为y=1.118 5x-0.035 2,R2=0.996 7(x为谷氨酸质量浓度/(mg/mL)、y为570 nm波长处吸光度)。总糖、多糖含量测定采用蒽酮-硫酸法[14],标准曲线方程为y=1.762 7x+0.036 6,R2=0.998 9(x为葡萄糖质量浓度/(mg/mL)、y为625 nm波长处吸光度)。总多酚、总黄酮含量测定采用福林-酚比色法[15],标准曲线方程为y=5.667 7x+0.064 4,R2=0.999 0(x为没食子酸质量浓度/(mg/mL)、y为765 nm波长处吸光度)。总儿茶素含量测定采用香兰素比色法[16],标准曲线方程为y=2.136 8x+0.056 0,R2=0.991 7(x为表儿茶素质量浓度/(mg/mL)、y为500 nm波长处吸光度)。茶色素(茶黄素、茶红素和茶褐素)含量测定采用Roberts萃取比色法[17]。
1.3.3 动物分组、建模与取样
将30只小鼠适应性饲养2周后,随机分为对照组、衰老组和普洱熟茶组,每组各10只。对照组颈背部皮下注射10 mL/kgmb0.9%生理盐水;其他组颈背部皮下注射500 mg/kgmbD-gal溶液,持续8周建立小鼠衰老模型。在建模的第9周开始,普洱熟茶组灌胃3 g/kgmb普洱熟茶水提物(根据日本东京桑野研究所推荐成人每日平均用茶量6 g,按人体标准体质量60 kg计算得成人每日用茶量为0.1 g/kgmb。小鼠与人的等效剂量约为10 倍,即每只小鼠正常的剂量为1 g/kgmb水提物。同时结合课题组前期研究结果,本实验采用3 g/kgmb水提物作为灌胃剂量),对照组和衰老组灌胃等量蒸馏水。实验期间每7 d称质量1次,按体质量变化调整注射及灌胃剂量。
18周采集小鼠的新鲜粪便(约0.5 g)于灭菌离心管中,-80 ℃冻存待测。实验结束后,将小鼠脊椎脱臼处死,冰上取出肝脏组织,在冰浴条件下加入一定量的磷酸盐缓冲液(phosphate buffered saline,PBS)(pH 7.4)制成组织匀浆液,3 000 r/min离心20 min,取上清液,置于-80 ℃冻存待测。同时冰上取出完整肠道,分离出空肠,于空肠中段剪下约1 cm长的肠段放入4%多聚甲醛组织固定液固定。
1.3.4 小鼠抗氧化指标测定
采用相对应的试剂盒对肝脏组织匀浆中SOD、GSH-Px活力以及MDA含量进行检测,再根据BCA蛋白浓度检测试剂盒测定匀浆蛋白质量浓度,抗氧化指标均以蛋白质量计。
1.3.5 小鼠小肠病理切片
空肠组织→石蜡包埋→切片→脱蜡至水→HE染色→脱水封片→显微镜镜检→图像采集分析。
应用Image-Pro Plus 6.0软件以右下角100 倍和200 倍标尺为标准,100 倍视野下,每张切片从3个视野中选取5 根最高最完整的绒毛,分别测量绒毛高度、隐窝深度和肌层厚度。
1.3.6 16S rDNA高通量测序
采用Qubit®dsDNA Assay Kit试剂盒提取粪便样品中菌群总DNA,以提取的DNA为模板,使用带有barcode的特异引物(341F:CCTACGGGRBGCASCAG、806R:GGACTACNNGGGTATCTAAT)扩增16S rDNA的V3~V4区,运用Illumina NovaSeq测序平台测序。经过Reads拼接过滤,分类单元(operational taxonomic units,OTUs)聚类进行物种注释及丰度分析。基于OTU对测序进行物种多样性指数分析以及深度检测;基于分类学信息在各个分类水平上进行群落结构的统计分析。在上述分析的基础上,对多样本的群落组成和系统发育信息进行多元分析和差异显著性检验等一系列深入的统计学和可视化分析。
1.4 数据处理与分析
2 结果与分析
2.1 普洱熟茶水提物组分
由表1可知,普洱熟茶水提物中蛋白质含量为70.64 g/kg、氨基酸含量为24.86 g/kg、总糖含量为178.34 g/kg、多糖含量为11.28 g/kg、总多酚含量为62.69 g/kg、总黄酮含量为40.61 g/kg、总儿茶素含量为18.85 g/kg,茶色素中茶黄素含量为1.61 g/kg,茶红素未检测到,茶褐素含量最高,为249.96 g/kg。
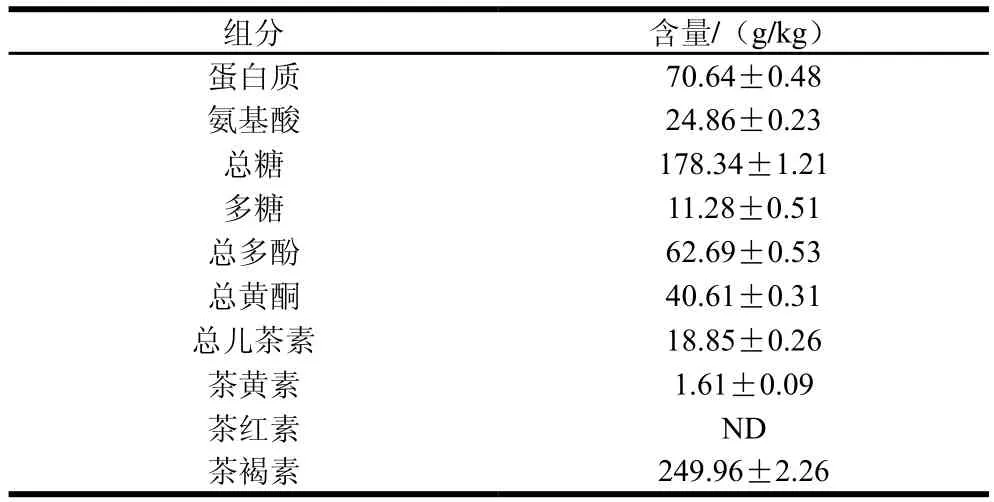
表1 普洱熟茶水提物组分Table 1 Composition of Pu-erh tea infusion
2.2 小鼠衰老模型判定
小鼠衰老模型是否构建成功,是后期实验进行的基础。衰老模型的评价初步通过观察小鼠在实验过程中毛色、精神状态、活跃度、摄食量、行动的灵活度等来判定[18-19]。建模8周后,对照组小鼠活跃,毛色光滑,精神状态良好;衰老模型组小鼠行动较迟缓,毛色、胡须变白并有所脱落,精神状态较差(图1)。由此看出,衰老模型建立成功。
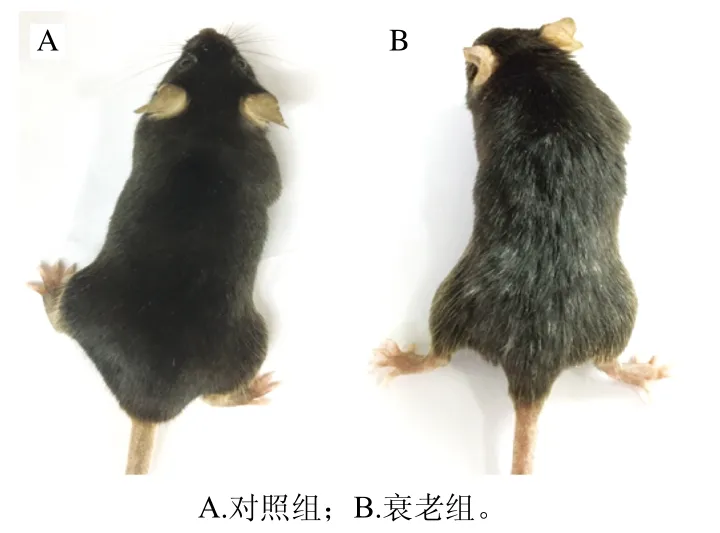
图1 建模8周后小鼠外观Fig. 1 Mice appearance after eight weeks of modeling
2.3 普洱熟茶对小鼠体质量的影响
体质量常用于反映机体的健康状况,作为衡量小鼠生长发育的重要指标之一[20]。由图2可知,前10周(主要为建模期)小鼠体质量增长较快,衰老组小鼠体质量增加量比对照组多,说明注射D-gal影响了小鼠正常发育;第10周后(干预期),普洱熟茶组小鼠体质量逐渐下降。与对照组相比,衰老组小鼠最终体质量略有减轻;与衰老组相比,普洱熟茶组小鼠最终体质量减轻,这可能是普洱熟茶具有减肥效果,对体质量增长有一定的抑制作用。
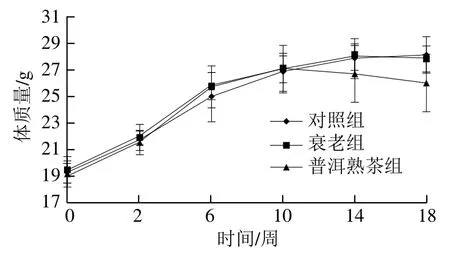
图2 普洱熟茶对小鼠体质量的影响Fig. 2 Effect of ripe Pu-erh tea on body mass of mice
2.4 普洱熟茶对小鼠抗氧化指标的影响

表2 普洱熟茶对小鼠抗氧化指标的影响Table 2 Effect of ripe Pu-erh tea on antioxidant indexes in mice
由表2可知,与对照组相比,衰老组小鼠的肝脏组织中SOD和GSH-Px活力均显著降低(P<0.05),MDA含量显著升高(P<0.05);与衰老组相比,普洱熟茶组小鼠的肝脏组织中SOD和GSH-Px活力均显著升高(P<0.05),MDA含量显著降低(P<0.05)。这表明D-gal持续摄入会导致小鼠体内氧化应激,促进脂质过氧化,普洱熟茶干预后可提高衰老小鼠肝脏组织的抗氧化能力,清除体内过多的自由基,抑制脂质过氧化,降低MDA含量。
2.5 小鼠小肠组织病理结果的分析
2.5.1 普洱熟茶对小鼠小肠组织形态的影响
由图3可知,对照组小肠组织结构完整,绒毛均匀细长,呈指状排列,上皮细胞未见脱落,肠腺排列紧密;衰老组小肠绒毛缺损,肿胀肥大,组织黏膜层损伤,局部黏膜上皮细胞脱落,固有层肠腺排列疏松,间隙增宽;普洱熟茶组小肠绒毛长度较衰老组明显增长,无肥大现象,黏膜层及上皮细胞未见脱落,固有层肠腺排列紧密。
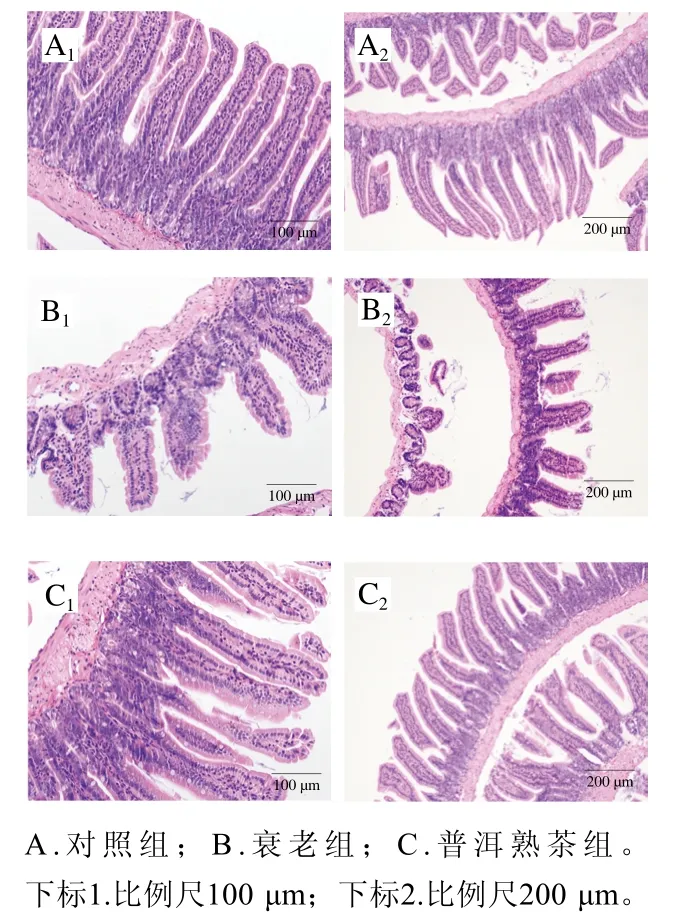
图3 普洱熟茶对小鼠小肠组织形态的影响Fig. 3 Effect of ripe Pu-erh tea on small intestinal morphology of mice
2.5.2 普洱熟茶对小鼠小肠组织绒毛长度、隐窝深度及肌层厚度的影响
小肠是机体营养物质消化吸收的主要部位,其结构完整是保证营养物质能够正常消化吸收的基础[21]。绒毛长度、隐窝深度及肌层厚度等是衡量小肠消化吸收能力的相关指标[22]。由表3可以看出,与对照组相比,衰老组绒毛长度、隐窝深度和肌层厚度显著降低(P<0.05)。与衰老组相比,普洱熟茶组绒毛长度、隐窝深度和肌层厚度显著升高(P<0.05)。说明D-gal对小鼠的小肠形态结构有一定影响,而普洱熟茶可以改善衰老小鼠的小肠形态结构。
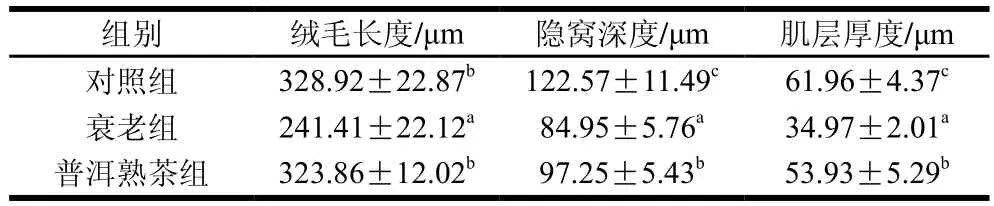
表3 普洱熟茶对小鼠小肠绒毛长度、隐窝深度及肌层厚度的影响Table 3 Effect of ripe Pu-erh tea on villus length, crypt depth and muscle layer thickness of small intestine in mice
2.6 普洱熟茶对小鼠肠道菌群结构的影响
2.6.1 物种多样性分析
Shannon指数不仅反映了样本中物种的数量(即丰富度),还反映了样本中各物种的丰度分布情况(即均匀度)。由图4可知,与对照组相比,衰老组Shannon指数显著升高(P<0.05),这说明D-gal致衰老小鼠的肠道微生物菌群结构发生了显著变化。当衰老小鼠摄入普洱熟茶后,肠道菌群Shannon指数显著降低(P<0.05),提示普洱熟茶干预有助于改善衰老小鼠肠道菌群结构。
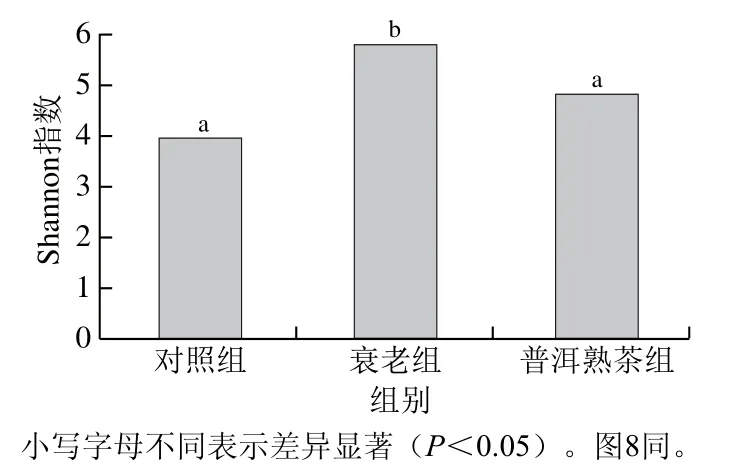
图4 小鼠肠道微生物多样性指数Fig. 4 Diversity index of gut microflora in mice
2.6.2 物种组成分析
2.6.2.1 物种Venn图分析
Venn图可用于统计多个样品中所共有和独有的OTU数目。通常情况下,分析时选用相似水平为97%的OTU样品表。由图5可知,衰老组中的OTU数目最多,达到779个,对照组OTU数目最少,有608个,普洱熟茶组OTU数目有695个。对照组特有29个OTU,衰老组特有179个OTU,普洱熟茶组特有106个OTU。各组样品中共有的OTU是496个,仅对照组与衰老组共有的OTU数目是47个,仅衰老组与普洱熟茶组共有的OTU 数目是57个。
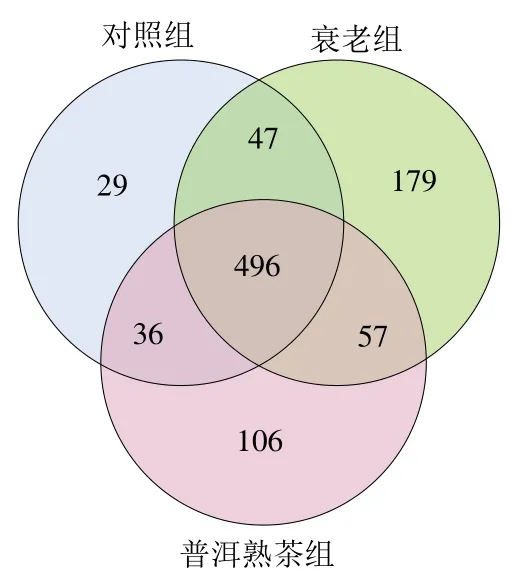
图5 各组物种Veen图Fig. 5 Venn diagram between groups species
2.6.2.2 基于门水平的物种组成分析
选取每个组别在门水平上最大丰度排名前10的物种,制作生成物种相对丰度柱形累加图,以便直观查看各组别在门水平上相对丰度较高的物种及其比例。由图6可知,对照组、衰老组和普洱熟茶组小鼠的肠道菌群门水平都以厚壁菌门(Firmicutes)(分别为40.23%、49.65%和33.39%)和拟杆菌门(Bacteroidetes)(分别为54.22%、32.19%和58.94%)为主。
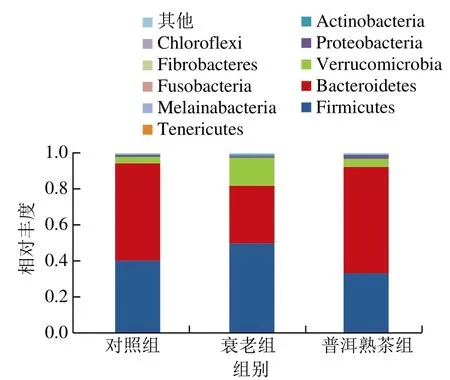
图6 小鼠肠道菌群门水平相对丰度柱状图(丰度前10的菌门)Fig. 6 Relative abundance of top ten most dominant intestinal bacterial phyla in mice
2.6.2.3 基于属水平的物种组成分析
选取每个组别在属水平上最大丰度排名前30的物种,制成生成物种相对丰度柱形累加图。由图7可知,在属水平上,与对照组相比,衰老组乳杆菌属(Lactobacillus)、拟杆菌属(Bacteroides)、拟普雷沃菌属(Alloprevotella)、另枝菌属(Alistipes)相对丰度降低,杜氏乳杆菌属(Dubosiella)相对丰度升高;与衰老组相比,普洱熟茶组拟杆菌属(Bacteroides)、拟普雷沃菌属(Alloprevotella)、另枝菌属(Alistipes)、丁酸弧菌属(Butyrivibrio)、劳特氏菌属(Blautia)相对丰度升高,乳杆菌属(Lactobacillus)和Dubosiella菌属相对丰度降低。
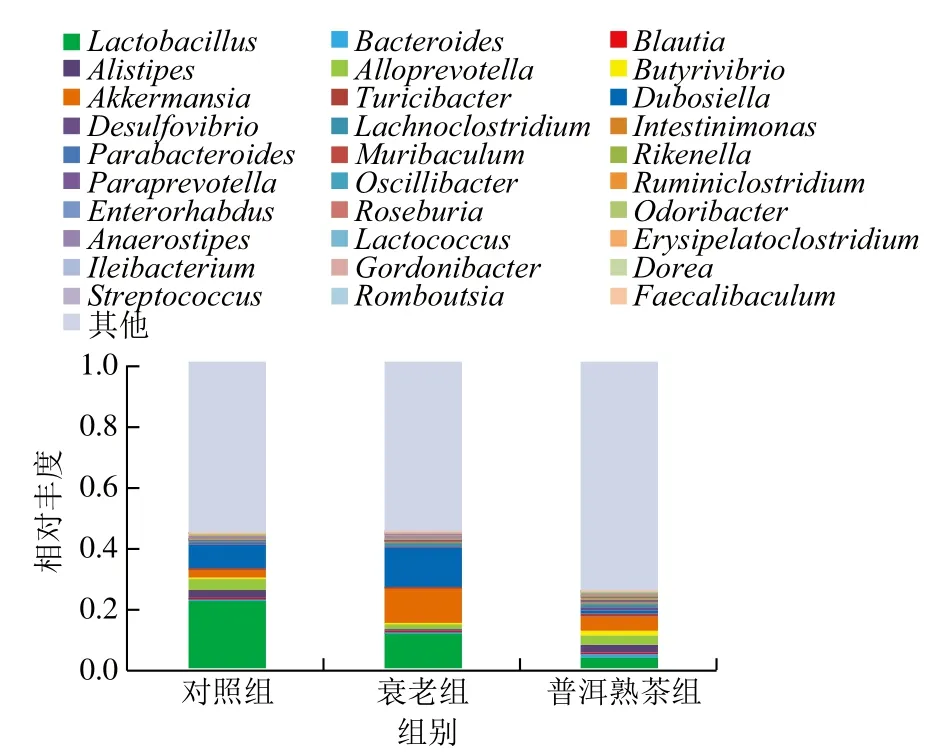
图7 小鼠肠道菌群属水平相对丰度柱状图(丰度前30的菌属)Fig. 7 Relative abundance of top 30 most dominant intestinal bacterial genus in mice
2.6.3 物种特征性差异分析
由图8可知,与对照组相比,衰老组小鼠肠道的拟杆菌门与厚壁杆菌门数量比(Bacteroidetes/Firmicutes,B/F)值降低,但差异不显著(P>0.05);与衰老组相比,普洱熟茶组B/F值显著升高(P<0.05)。说明在门水平上,衰老组的肠道菌群出现了衰老特征,并且普洱熟茶通过提高B/F值明显改善了衰老小鼠在门水平上的菌群紊乱现象。
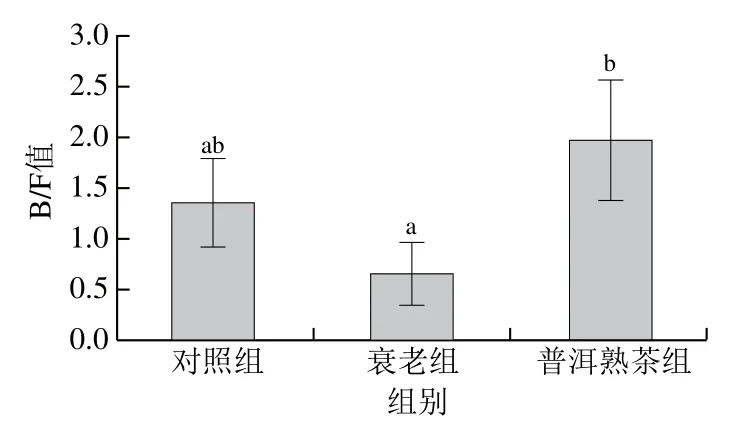
图8 普洱熟茶对小鼠肠道菌群B/F值的影响Fig. 8 Effect of ripe Pu-erh tea on B/F ratio in mice
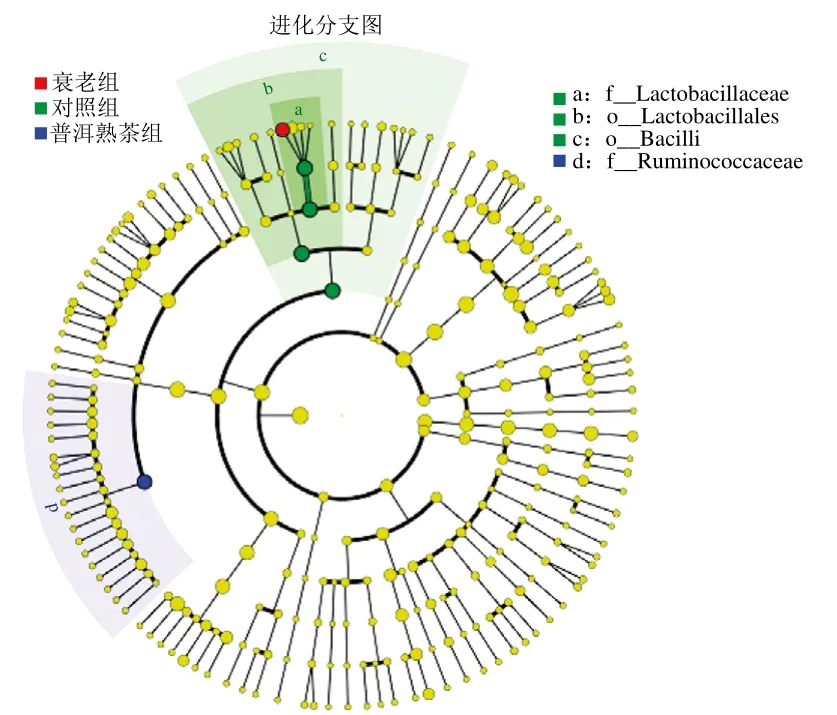
图9 各组小鼠肠道菌群物种线性判别分析值分布图Fig. 9 Differences in relative abundance of intestinal bacteria between groups species in mice
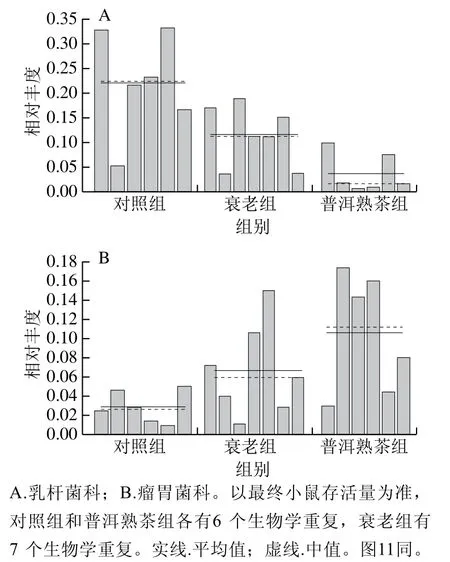
图10 各组小鼠肠道菌群科水平相对丰度直方图Fig. 10 Relative abundance of intestinal bacterial families between groups in mice
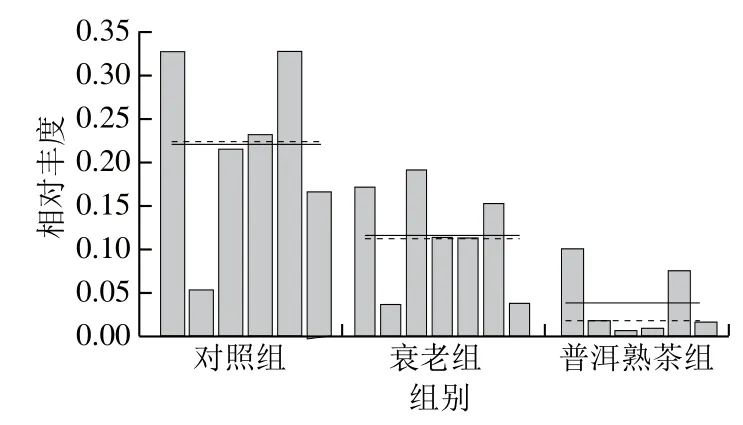
图11 各组小鼠肠道乳杆菌属水平相对丰度直方图Fig. 11 Relative abundance of intestinal Lactobacillus between groups in mice
线性判别分析差异贡献分析(linear discriminant analysis effect size,LEfSe)强调统计意义和生物相关性,能够在组与组之间寻找具有统计学差异的生物标志物,识别不同丰度的特征以及相关联的类别[23]。图9展示出各组微生物群落在各分类水平下存在明显差异的物种,衰老组物种丰度显著差异的科为乳杆菌科(Lactobacillaceae),普洱熟茶组物种丰度显著差异的科为瘤胃菌科(Ruminococcaceae)。乳杆菌科中仅包括乳杆菌属(Lactobacillus)1个属。由图9得到图10、11特征性菌群的相对丰度直方图,与对照组相比,衰老组小鼠肠道中Lactobacillaceae和Lactobacillus相对丰度显著降低(P<0.05),Ruminococcaceae相对丰度显著升高(P<0.05);与衰老组相比,普洱熟茶组小鼠肠道中Lactobacillaceae和Lactobacillus相对丰度显著降低(P<0.05),Ruminococcaceae相对丰度显著升高(P<0.05)。
3 讨 论
小鼠长期注射D-gal可导致自然衰老,并造成动物体内代谢紊乱,产生大量自由基,打破氧化与抗氧化的动态平衡,从而导致氧化应激、认知障碍等衰老相关病理现象的发生[24]。研究发现普洱茶水提取物能减少MDA产生,保护自由基引起的细胞损伤,增加SOD和GSH-Px活性[25]。本研究发现在普洱熟茶干预下,D-gal致衰老小鼠肝脏组织中的SOD和GSH-Px抗氧化酶活力得到显著改善,同时脂质过氧化物MDA的水平含量显著降低,说明普洱熟茶可以增强抗氧化系统活性,这可能与普洱熟茶的茶色素含有大量的具有极强清除自由基和抗氧化作用的活性酚羟基等活性因子有关。
小肠在机体衰老的过程中会出现退行性变化。肠绒毛能够增加小肠吸收面积,提高营养物质的消化利用率;隐窝深度反映小肠细胞的生成率;肌层厚度则反映小肠运动状态[26-28]。组织结构完整是肠道正常发挥消化吸收功能及免疫机能的基本保证。本研究发现衰老小鼠绒毛长度、隐窝深度和肌层厚度降低,这与彭秀颖等[29]的研究结果一致,普洱熟茶干预的衰老小鼠小肠绒毛长度、隐窝深度和肌层厚度显著升高,表明普洱熟茶对小肠退行性变化具有保护作用,提高对营养物质的吸收力,增强小肠运动力,缓解衰老导致的小肠黏膜组织损伤,从而保护小肠黏膜免疫功能。
人体肠道微生物群是一个巨大的生态系统,为宿主发育,正常免疫系统的形成新陈代谢均需要菌群的参与。B/F值是衡量机体衰老进程的一个重要指标,老年人的B/F比值低于年轻成年人[30-31]。本研究发现普洱熟茶干预后,小鼠肠道优势菌群为Bacteroidetes和Firmicutes这两个细菌门,同时B/F值也显著上升,与赵祎[32]的研究结果一致。Bacteroidetes可将糖类物质转化为对身体有益的产物[33]。同时,普洱熟茶干预的衰老小鼠Bacteroides相对丰度上升,这表明普洱熟茶可调节衰老小鼠肠道中Bacteroidetes和Firmicutes的相对丰度,调整肠道菌群结构,从而延缓衰老进程。
肠道菌群组成随衰老发生改变,但未发现统一的老年菌群特征[34]。Lachnospiraceae中的Blautia、Lachnospira以及Ruminococcaceae中的Faecalibacterium、Oscillospir等被证明是与短链脂肪酸(short-chain fatty acids,SCFAs)产生相关的菌属[35]。SCFAs能够稳定肠道内环境,改善衰老过程中肠道微生物菌群的失衡状态,进而起到延缓衰老的作用[36]。Blautia具有防止炎症发生、维持肠道稳态的功能,具有潜在益生菌特性[37]。Ruminococcaceae是厚壁菌门中产生丁酸盐的一类菌群,丁酸盐被证实能够调节肠道免疫反应,缓解肠道炎症和氧化损伤[38]。本研究发现普洱熟茶干预的衰老小鼠肠道Blautia相对丰度上升和Ruminococcaceae相对丰度显著上升,这表明普洱熟茶在一定程度上增加了衰老小鼠肠道内有益菌,调节了肠道微生物结构。Lactobacillus是健康成人肠道内普遍存在的细菌,具有调节肠道菌群、增强免疫力、改善肠道功能、抗氧化等作用[39]。路晓杰[40]通过高通量测序分析发现普洱茶提取物降低了高脂饮食条件下Lactobacillus等与肥胖呈正相关的菌在相应分类水平上的丰度。本研究发现D-gal致衰老小鼠Lactobacillus的相对丰度显著下降,普洱熟茶干预后其相对丰度也下降,这是否与摄入普洱熟茶小鼠的体质量减轻有关,还需要进一步地深入研究分析。
4 结 论
本研究结果表明普洱熟茶在正常的3 倍高剂量条件下能够增强衰老小鼠肝脏组织的抗氧化酶活性,保护衰老小鼠的小肠形态结构及小肠黏膜免疫功能,改善衰老小鼠的肠道微生物菌群组成结构,一定程度上增加了肠道内有益菌的相对丰度,维持肠道平衡与稳定,从而延缓衰老。

