利用对虾消化腺丝氨酸蛋白酶制备鲍鱼外套膜ACE抑制肽
纪梦雅,万楚君,翁 凌,马 婷,张凌晶,章 骞,曹敏杰
(集美大学海洋食品与生物工程学院,福建厦门 361021)
另一方面,我国是凡纳滨对虾生产大国,2020年产量达186.3万t[1]。同样,在对虾加工过程中也产生了大量副产物。但一般情况下,对虾加工副产物除了用于制备甲壳素外,相当部分被作为垃圾直接丢弃,不仅浪费了大量的自然资源,还造成了环境污染。因此,将水产加工副产物高效利用,具有十分重要的环境和经济效益[4−6]。虾头消化腺含丰富的内源蛋白酶,这些内源蛋白酶以丝氨酸蛋白酶为主,Wu等[7]从太平洋白虾虾头中提取了丝氨酸蛋白酶并进行性质分析,发现白虾虾头丝氨酸蛋白酶活性在pH为8.0~11.0范围内都比较稳定;翁凌等[8]从南美白对虾虾头中提取了丝氨酸蛋白酶,该酶在pH7.0~10.0,40 ℃以下具有较好的稳定性。但目前虾头丝氨酸蛋白酶还未得到广泛的应用。
血管紧张素转换酶(angiotensin converting enzyme,ACE)是肾素-血管紧张素系统(renin-angiotensin system,RAS)和激肽释放酶-激肽系统(kallikreinkinin system,KKS)的关键酶。在RAS中,ACE可以将无升压活性的血管紧张素Ⅰ水解为具有升压活性的血管紧张素Ⅱ;同时,在KKS中,ACE可以使具有降压活性的缓激肽降解,从而失去降血压的功能。因此,抑制ACE活性是控制血压上升的一个有效途径[9]。研究发现,体外酶或消化道酶水解蛋白质后释放出的分子量不同的小肽,可被人体直接吸收发挥不同的生理调节功能[10]。迄今为止,已有大量文献报道了ACE抑制肽的相关研究,其中来源于天然食物蛋白,尤其是从海洋食物蛋白中分离制备的ACE抑制肽对血压正常者无副作用,安全性高,是最具研究价值的功能性食品[11−12]。近年来,随着生物活性肽被越来越多的关注,研究者们以动植物蛋白为原料制备了大量降压肽。Lin等[13]研究了军曹鱼皮水解物对ACE的抑制作用,并分离出4种ACE抑制肽。Ketnawa等[14]利用微波和水解法从虹鳟鱼副产物中提取出了ACE抑制肽。Zhang等[15]从水母性腺中纯化得到了具有ACE抑制活性的二肽,并对其进行表征。也有研究者以鲍鱼性腺[16]、内脏[17]和裙边[18]为原料制备ACE抑制肽,但目前国内外还没有以鲍鱼外套膜为原料制备ACE抑制肽的相关报道。
本文拟以鲍鱼加工副产物外套膜为原料,利用从凡纳滨对虾虾头消化腺提取的丝氨酸蛋白酶对其进行酶解,制备具有ACE抑制活性的多肽,并测定其氨基酸序列,分析可能的作用机理,以期为鲍鱼外套膜和虾头的高值化利用提供新思路。
1 材料与方法
1.1 材料与仪器
鲜活皱纹盘鲍(Haliotis discus hannaiIno) 带壳平均体质量(50.0±4.0)g,购自厦门集美菜市场,带回实验室宰杀取其外套膜,立即使用或暂存于−80 ℃冰箱;凡纳滨对虾消化腺丝氨酸蛋白酶(酶活力为76000 U/mL) 参考本实验室的方法[8]制备;ACE酶(A2580)、马尿酰组氨酰亮氨酸(Hippuryl-histidylleucune,HHL) 美国Sigma公司;三羟甲基氨基甲烷(tris(hydroxymethyl)methyl aminomethane,Tris) 青岛福林生物化学公司;SDS-PAGE标准蛋白、SDS、丙烯酰胺 美国Bio-Rad公司;Tris-base 德国Roche公司;FastBlue蛋白染色液 中科瑞泰生物科技有限公司;甲醇、乙酸乙酯等试剂 均为国产分析纯。
PT-2100组织捣碎机 瑞士Kinematica公司;pH计 美国Denver公司;超滤膜浓缩装置 美国Millipore公司;恒温水浴锅 德国Memmert公司;蛋白质电泳装置 美国Bio-Rad公司;AKTA蛋白纯化系统 美国GE Healthcare公司;GF-260高效液相色谱仪 美国Agilent公司;凝胶成像仪 英国Syngene公司;Lambda 35紫外分光光度计 美国Perkin Elmer公司。
1.2 实验方法
1.2.1 丝氨酸蛋白酶酶解鲍鱼外套膜过程分析 参照邱娟等[19]的方法,并略作修改。具体操作如下:取10 g鲍鱼外套膜,加入100 mL浓度为20 mmol/L的Tris-HCl缓冲液(pH8.0),组织捣碎后,在4 ℃,3500 r/min下离心3 min,收集上清液,并取上层细腻沉淀,用少量20 mmol/L Tris-HCl缓冲液(pH8.0,含0.15 mol/L NaCl)复溶后,与上清液混匀即成鲍鱼外套膜前处理液。
取1 mL前处理液置于1.5 mL PE管中,37 ℃预热5 min后,加入0.5%(v/v)的丝氨酸蛋白酶,保持37 ℃,分别在酶解0、5、30、60、120、180、240 min时取样,取样后迅速在95 ℃下加热10 min,冷却后进行SDS-PAGE分析。
中国英语学习者的实验在被试所在中学或大学的教师办公室进行,英语母语者分别在各自所在大学的图书馆中进行,一次仅有一个被试在房间中接受测试。被试首先阅读实验要求,然后开始测试。在电脑的自测步速阅读完成后,被试还要做二语水平测试,并填个人语言背景表。二语水平测试题选自Oxford Proficiency Test,共50道语法选择题,用以检测学生的二语语法水平。所有学生均未在之前做过这一测试。语法选择题每题1分,小于30分被界定为低水平;30~35分为低到中等水平;35分以上为中等以上水平。
1.2.2 SDS-PAGE分析 参考Laemmli[20]的方法分析鲍鱼外套膜蛋白的酶解情况,所用浓缩胶浓度为5%、分离胶浓度为10%。电泳结束后,以Fast Blue蛋白染色液染色,用凝胶成像仪记录结果。
1.2.3 鲍鱼外套膜ACE抑制肽的制备 鲍鱼外套膜ACE抑制肽的制备与1.2.1类似,但鲍鱼外套膜组织捣碎后无需离心,直接37 ℃预热5 min后,加入0.5%(v/v)的丝氨酸蛋白酶,在37 ℃、pH8.0下酶解4 h后,于95 ℃加热10 min终止反应,即得鲍鱼外套膜酶解液。用冰水冷却鲍鱼外套膜酶解液,后将其在6500 r/min下冷冻离心20 min,弃去沉淀,取上清液进行生物活性肽制备。
1.2.4 超滤膜分离 选用截留分子量为3 kDa的超滤膜,将上清液进行超滤分级,收集超滤膜滤过液,冷冻干燥后,用少量20 mmol/L Tris-HCl复溶,测定对ACE的抑制活性。
1.2.5 凝胶色谱分离 将冷冻干燥样品用少量去离子水复溶后,上样于Superdex peptide 10/300 GL凝胶过滤柱(10 mm I.D.×300 mm),洗脱液为去离子水。在流速为0.5 mL/min条件下,测定波长220 nm处的吸光值,收集不同组分(1 mL/管),冷冻干燥后复溶,测定相应组分的ACE抑制活性。
1.2.6 RP-HPLC分离 将Superdex peptide 10/300 GL凝胶过滤柱分离所得ACE抑制活性较强的组分冷冻干燥后复溶,利用GF-260 Agilent HPLC纯化系统进一步分离纯化。色谱柱为ZORBAX SB-C18(4.6 mm×250 mm),流动相为去离子水(含0.1% TFA)和乙腈(含0.1% TFA),洗脱条件为0~10 min,5%~10%乙腈;10~40 min,10%~40%乙腈;40~60 min,40%~70%乙腈。检测波长220 nm,在流速1 mL/min下,手动收集各活性峰并冷冻干燥,用少量20 mmol/L Tris-HCl复溶后,测定相应组分的ACE抑制活性[18]。
1.2.7 LC-MS/MS鉴定氨基酸序列 将上述复溶样品在13000 r/min下离心10 min,取7 μL样品进行LC-MS/MS分析。按照流速2 μL/min,将样液上样到C18预柱(100 μm×3 cm,3 μm,150 Å)上,保持2 μL/min冲洗脱盐10 min,液相为Eksigent nanoLCUltra™ 2D纳升系统(AB SCIEX)。样品脱盐后再经C18反相色谱柱(75 μm×15 cm,3 μm,120 Å,Chrom XP Eksigent)分离。质谱采用Triple TOF 5600系统结合纳升喷雾III离子源(AB SCIEX,USA),喷雾电压为2.3 kV,气帘气压为30 psi,雾化气压为5 psi,加热温度为150 ℃[21−22]。
1.2.8 ACE抑制活性的测定 ACE抑制活性测定参考Cushman等[23]方法,并略作修改。实验组将20 μL ACE酶液与20 μL待测样液充分混匀,37 ℃预热5 min,立即加入50 μL 6.5 mmol/L HHL溶液(溶剂为100 mmol/L的硼酸盐缓冲液,pH8.3,含0.3 mol/L NaCl),37 ℃反应60 min。加入50 μL 1 mol/L盐酸终止反应,再加入300 μL乙酸乙酯,混匀后室温下2553 r/min离心5 min。取上清液200 μL,真空浓缩除去乙酸乙酯后,加600 μL去离子水充分溶解,室温下3610 r/min离心3 min,测定上清液在波长228 nm处的吸光值。对照组用去离子水代替样液,空白组加入盐酸后再加底物,其它条件均与实验组一致。
酶活力单位(U)定义为每分钟内分解HHL底物释放出1 μmol马尿酸(Hippuric acid,HA)所需要的酶量。
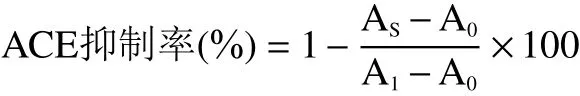
式中:A1为对照组的吸光值;As为实验组吸光值;A0为空白组吸光值。
1.3 数据处理
每组ACE抑制率测定均重复三次,采用Excel 2019对实验数据进行误差分析。
2 结果与分析
2.1 SDS-PAGE分析
图1为鲍鱼外套膜蛋白在丝氨酸蛋白酶作用下的分解过程。图中,泳道M为标准蛋白,泳道Con1为鲍鱼外套膜全蛋白,大部分蛋白的分子量在30 kDa以上,其中在高分子量(200 kDa)、95 kDa及42 kDa处存在明显的蛋白条带。泳道Con2无蛋白条带,说明所添加的丝氨酸蛋白酶比活力高,酶蛋白背景低,不影响SDS-PAGE分析。鲍鱼外套膜蛋白经对虾丝氨酸蛋白酶酶解4 h后,蛋白基本降解完全,只有34 kDa附近有少量降解产物残留,表明对虾丝氨酸蛋白酶可有效降解鲍鱼外套膜蛋白。

图1 虾丝氨酸蛋白酶水解鲍鱼外套膜全蛋白的SDS-PAGE分析Fig.1 SDS-PAGE analysis of whole proteins in abalone mantle hydrolyzed by shrimp serine proteinase
2.2 鲍鱼外套膜ACE抑制肽的分离纯化
一般地,蛋白水解产物中,低分子量的组分所含的活性多肽含量更高。Fan等[24]在研究废弃蛋鸡肌肉中ACE抑制肽和ACE2上调肽时,用超滤膜分离后发现,小于3 kDa的组分具有较高的生物活性。章禹航等[25]以鲅鱼加工副产物为原料制备ACE抑制肽时发现,超滤得到分子量小于3 kDa的组分具有最高的ACE抑制活性。
本研究利用丝氨酸蛋白酶酶解鲍鱼外套膜蛋白,将酶解液用截留分子量为3 kDa的超滤膜进行超滤分级,测定酶解液和分子量小于3 kDa组分的ACE抑制活性。结果如图2所示,相同浓度下,酶解液和分子量小于3 kDa组分的ACE抑制率分别为13.42%和53.25%。本研究结果表明,经过超滤膜处理后,分子量小于3 kDa的组分(UF-3)的ACE抑制活性明显高于处理前酶解液的抑制活性。
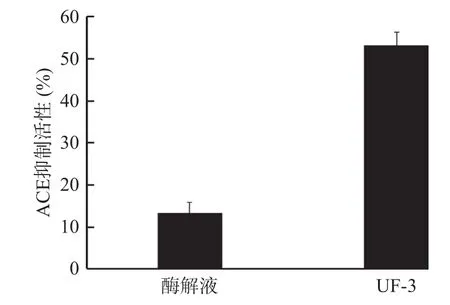
图2 酶解液和UF-3的ACE抑制活性Fig.2 ACE inhibitory activity of the hydrolysate and UF-3
将UF-3冷冻干燥后用Superdex peptide 10/300 GL凝胶柱分离,结果如图3所示。共得到3个峰,分别为F1(第8~25管)、F2(第26~28管)和F3(第29~35管),根据波峰分布情况,收集3个组分,真空冷冻干燥,复溶后测定相应的ACE抑制活性。其中,F2和F3活性较高,而F3生物活性较强且分子量较低,故将其作为重点研究组分。
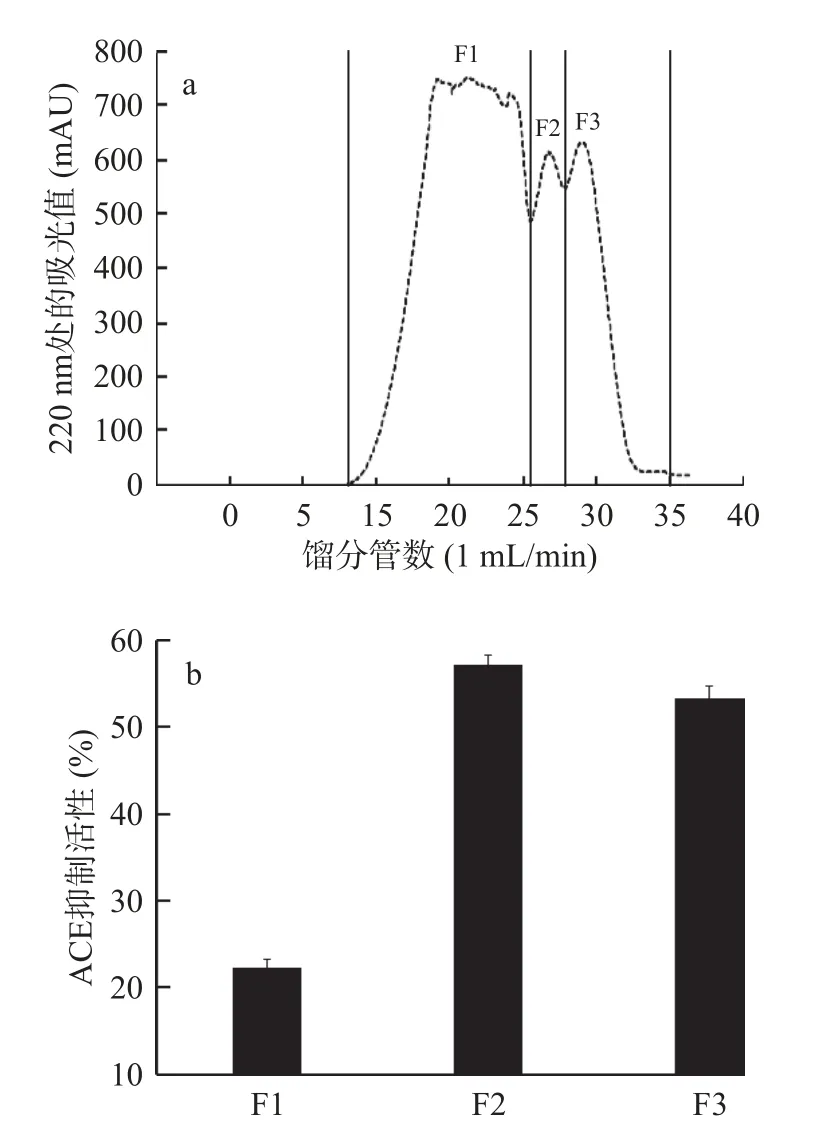
图3 UF-3生物活性肽的Superdex peptide10/300 GL凝胶过滤(a)及组分的ACE抑制活性(b)Fig.3 Superdex peptide 10/300 GL gel filtration of the bioactive peptides from UF-3 (a) and ACE inhibitory activity of the fractions (b)
大量的文献报道,蛋白酶解物中混合肽的分子量及结构对其活性有一定影响,而ACE抑制活性是由分子量较小的肽段所赋予的,因此低分子量(1~5 kDa)组分中通常包含更多的活性肽[26−27]。由于ACE是分子量为180 kDa的大分子,空间阻碍效应导致分子量较大的肽难于与ACE活性中心产生有效结合并抑制其活性。结晶学研究表明,低分子量肽更容易进入ACE的催化区域[28],改变其催化活性,特别是0.5~3 kDa的肽对于其活性影响更大[29]。Superdex peptide 10/300 GL凝胶柱在分离肽时,还受如吸附作用等因素的影响,不能完全按肽的相对分子质量大小实现分离。因此,采用RP-HPLC依据疏水性差异对F3继续分离。
研究发现,多肽的亲水-疏水性也是影响其ACE抑制活性的重要因素。因为亲水性多肽很难接近ACE活性中心的疏水“口袋”,所以亲水性多肽一般活性较低或无活性[30−32]。将分离得到的F3组分用RP-HPLC作进一步分离纯化,手动收集主峰后冷冻干燥,复溶后,测定比较相应的ACE抑制活性。结果如图4所示,F3组分经RP-HPLC分离,共收集获得9个峰,依次标记为a~i。结果发现,峰d(28.0 min)、e(29.25 min)、f(29.98 min)、g(33.58 min)和h(47.43 min)的ACE抑制活性较高,其中,峰h的ACE抑制活性最强,利用LC-MS技术对其进行氨基酸序列分析。
2.3 氨基酸序列分析
对图4a中ACE抑制活性最强的峰h进行质谱鉴定,结果如图5所示。共获得65个离子峰,得到5个肽段,序列依次为P1:LVNEVTEFAK,P2:VDE VGGEALGR,P3:MFLSFPTTK,P4:VATVSLPR,P5:LGDSFYYGK。它们的分子量分别为575.31、551.27、536.27、421.74和525.24 Da,说明峰h并不是由单一的肽所产生的,而是多个肽的混合物。将得到的五个肽段与NCBI蛋白数据库进行同源性分析得知,P1与血清白蛋白,P2与血红蛋白β链,P3与α珠蛋白,P4与肌浆钙结合蛋白,P5与丝氨酸蛋白酶均有100%的同源性。由于水解鲍鱼外套膜蛋白的丝氨酸蛋白酶是高度纯化的,因此,推测P1、P2、P3、P4均来源于鲍鱼,而P5则来自对虾丝氨酸蛋白酶。利用AHTPDB降压肽数据库(http://crdd.osdd.net/raghava/ahtpdb/pepsearch.php)检索发现,5个肽均为新型ACE抑制肽。
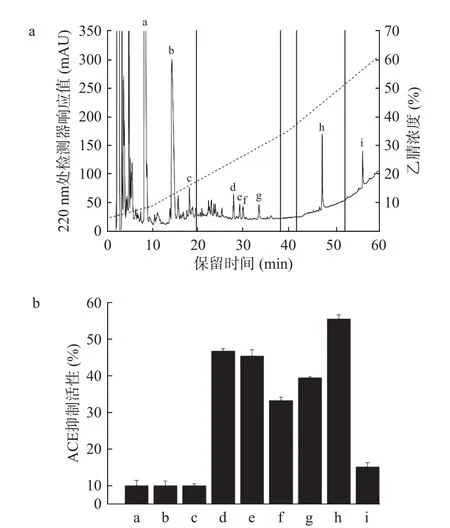
图4 F3生物活性肽的RP-HPLC分离纯化(a)及组分生物活性(b)Fig.4 Separation and purification of bioactive peptides from F3 by RP-HPLC (a) and bioactivity of the fractions (b)
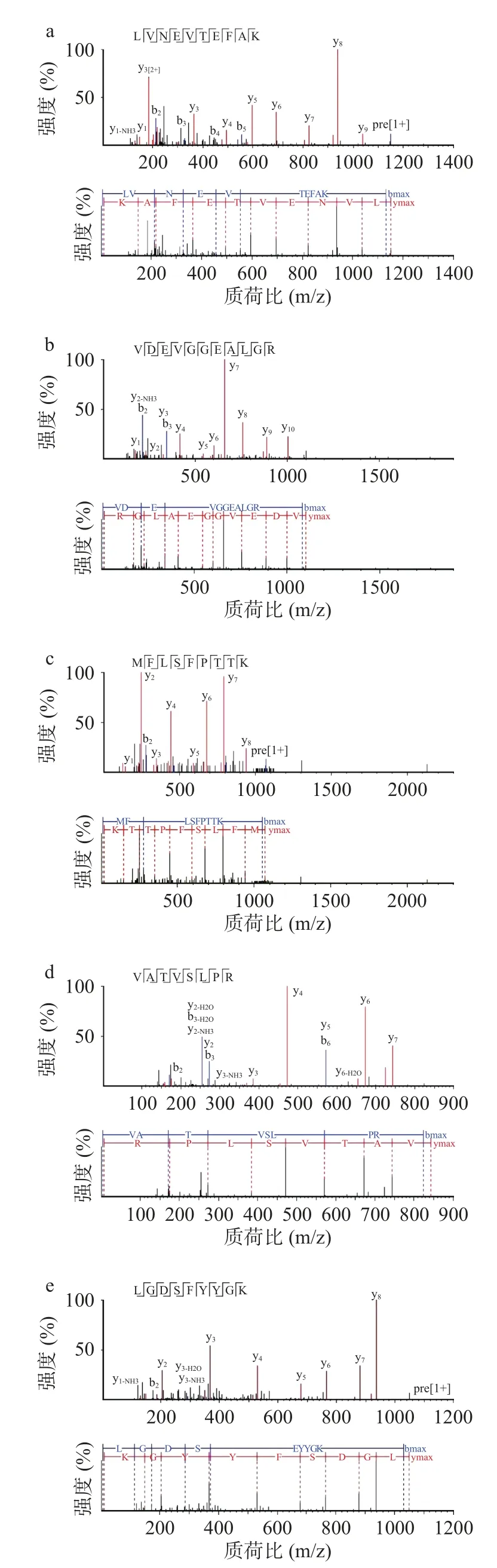
图5 峰h中生物活性肽的分子量鉴定及氨基酸序列分析Fig.5 Identification of molecular mass and amino acid sequences of peptides from peak h
Natesh等[33]通过晶体学研究证明,ACE的活性位点不能容纳分子量较大的多肽分子。因此,大多数ACE抑制肽长度较短,一般为2~12个氨基酸残基。但ACE抑制肽的活性不仅与分子量大小有关,还与氨基酸的组成和序列密切相关。如C端的3个氨基酸中如有一个是疏水性氨基酸,则该ACE抑制肽具有较高的活性;N端含侧链脂肪酸族氨基酸如Val和Ile等可以提高该肽的活性[30,34]。此外,带正电荷的Lys(ε-氨基)和Arg(胍基)作为C末端也有助于提高其ACE抑制活性[35]。本研究纯化获得的肽C端均为Lys或Arg,二者虽属于亲水性氨基酸,但均带正电荷,且肽N端均含脂肪族氨基酸,有助于提高ACE抑制活性。
综上,本文所得纯化肽符合ACE抑制肽的氨基酸组成特点,但其结构特性及其肽构效关系还需深入研究。接下来,拟通过合成上述ACE抑制肽,继续探究其消化吸收性能和降血压功效,并利用分子对接技术探讨这些肽段与ACE的可能结合位点与结合方式,以期为相关功能性食品的开发提供理论参考。
3 结论
本研究以水产品加工副产物虾头和鲍鱼外套膜为原料,提取虾头消化腺丝氨酸蛋白酶酶解鲍鱼外套膜蛋白制备ACE抑制肽。结果表明,虾头丝氨酸蛋白酶可有效降解鲍鱼外套膜蛋白,酶解液中分子量低于3 kDa的组分ACE抑制率为53.25%,利用Superdexpeptide 10/300 GL凝胶柱和RP-HPLC对该组分进一步纯化并经LC-MS/MS鉴定得到5个肽段,其中4个是来源于鲍鱼的新型ACE抑制肽。本研究利用水产品加工副产物,实现虾头消化腺蛋白酶一步酶解鲍鱼外套膜,再经超滤得到具有较高ACE抑制活性的组分,这不仅有利于扩大天然ACE抑制肽的来源,实现鲍鱼、对虾加工副产物的高值化利用,还可以降低相关功能性食品的生产成本。未来,将对利用鲍鱼外套膜酶解物开发功能性食品展开研究。

