改性红枣多糖的制备和结构表征
杨燕敏,郑振佳,李桂芹,张仁堂*
(1.山东农业大学食品科学与工程学院,山东省高校食品加工技术与质量控制重点实验室,山东 泰安 271018;2.滨州职业学院生物工程学院,山东 滨州 256603)
红枣又称大枣,原产于中国,是鼠李科植物枣的成熟果实[1]。红枣作为一种食药同源产品[2],含有多酚类物质、五环三萜类化合物、黄酮、活性多糖和环磷酸腺苷等多种生物活性物质。因此,具有免疫调节、护肝、补血、抗衰老和抗癌等功效,在人体保健和疾病防治方面发挥重要作用[3]。
多糖大量存在于动物、植物以及微生物中,由于其优良的生物活性,在食品和医药行业广泛应用。天然多糖的结构复杂,结构类型明显多于蛋白质,但是多糖复杂的结构和各种生物活性机制导致其在医药和食品添加剂领域的应用存在许多缺陷。当前,通过对多糖改性进行分子修饰的方法,不仅可以获得不同结构类型的多糖衍生物,而且有可能改变多糖的理化特性及生物功能,是发现和研制新型多糖类药物的重要途径[4]。目前已有报道的多糖改性化学方法有羧甲基化[5]、磷酸化[6]、硫酸酯化[7]、乙酰化[8]和硒化[9]等,通过对多糖进行分子修饰,不仅使多糖结构更加稳定,还可以增强功能活性。焦中髙[10]研究了红枣多糖的硫酸酯化修饰、羧甲基修饰、乙酰化修饰的理化特性以及抗氧化、降血糖等生物活性,结果表明改性修饰后的多糖均可改善其在水溶液中的分布状态,提高其溶解性。对红枣多糖适度硫酸酯化修饰可以增强其对超氧阴离子自由基的清除活性;对红枣多糖羧甲基化修饰和乙酰化修饰可显著提高其羟基自由基清除活性,不同取代基修饰均降低了红枣多糖对α淀粉酶的抑制活性,但可增强其对α葡萄糖苷酶的抑制活性,其中尤以羧甲基化修饰的效果最好。
本文通过对哈密大枣多糖进行硫酸改性、羧甲基改性和硒化改性,研究其改性前后结构变化,为进一步研究红枣多糖改性后功能活性和应用途径提供理论参考,为红枣多糖的产业化应用奠定基础。
1 材料与方法
1.1 材料与试剂
红枣:新疆哈密大枣,市售。
浓硫酸(优级纯)、苯酚、葡萄糖、无水乙醇、石油醚(均为分析纯):天津市凯通化学试剂有限公司;正丁醇(分析纯):天津市大茂化学试剂厂;牛血清白蛋白、考马斯亮蓝G-250(均为分析纯):上海奥博生物科技有限公司;单糖标准品阿拉伯糖、鼠李糖、葡萄糖、半乳糖、木糖、果糖、甘露糖、葡萄糖醛酸、半乳糖醛酸、Dextranstandards 1152标准品(均为色谱纯):上海源叶生物科技有限公司;多糖分子量测定标品(5 000、11 600、23 800、48 600、80 900、148 000、273 000、409 800、667 800 Da):美国西格玛奥德里奇公司。
1.2 仪器与设备
754N紫外可见分光光度计:上海奥普勒仪器有限公司;1836型乌氏黏度计:台州市椒江玻璃仪器厂;UV-2450紫外可见分光光度计、LC-10A高效液相色谱仪:日本岛津公司;KQ500DE型数控超声波清洗器:昆山市超声仪器有限公司;ThermoFisherICS-5000+高效阴离子交换色谱仪、Nicole iS10型红外光谱仪:美国Thermo Fisher科技公司;ZEISS-SUPRATM 55型扫描电子显微镜:德国卡尔蔡司公司;SCIENTZ-12N冷冻干燥机:宁波新芝生物科技股份有限公司。
1.3 方法
1.3.1 多糖的制备
1.3.1.1 红枣多糖的提取纯化
将红枣去核切片,置于60℃烘箱中干燥,粉碎后过40目筛网,加入蒸馏水使料液比为1∶10(g/mL)进行回流提取。100℃煮沸后浸提45 min,浸提2次,合并多糖提取液,浓缩后醇沉,冷冻干燥后备用[11]。用石油醚和粗多糖溶液按1∶1体积比充分混匀,用分液漏斗分离脱脂,重复3次。将粗多糖溶液和Sevag试剂(氯仿和正丁醇体积比4∶1)按4∶1体积比加入,强烈振荡,静置分层后离心弃去下清液及中间夹杂的变性蛋白[12],重复7次,通过透析去除小分子杂质,浓缩后冻干得纯化多糖,将其命名为红枣多糖,用于后续试验。
1.3.1.2 红枣多糖的羧甲基化改性
取1.0g多糖在剧烈搅拌下悬浮于40mL异丙醇中30min,再加入3 mol/L的NaOH 20 mL,20℃搅拌1 h,加入2.5 g氯乙酸在60℃下反应4 h,冷却至20℃,用3 mol/L HCl中和,透析醇沉冻干得羧甲基化红枣多糖[13]。采用酸碱滴定法测定羧甲基化多糖的取代度[14]。
1.3.1.3 红枣多糖的硫酸法改性
将30 mL浓硫酸和10 mL正丁醇按3∶1体积比在冰水浴下混合,加入 125 mg(NH4)SO4,使溶液冷却至0℃以下,加入1.0 g多糖,搅拌30 min,加入3 mol/L NaOH,调pH值为7,醇沉后透析,冻干得硫酸化红枣多糖[15]。采用硫酸钡浊度法测样品中硫的含量,在360nm波长下,用K2SO4建立标准曲线[16]。
1.3.1.4 红枣多糖的硒化改性
取1.0g多糖放入250mL三角烧瓶中,加入100mL 0.5%硝酸溶液,水浴加热到70℃,加入0.8 g Na2SeO3和1.44 g BaCl2,70℃水浴6 h,冷却至室温25℃,过滤去沉淀,用无水碳酸钠调pH值为7。加1.4 g Na2SO4,离心取上清后透析,取透析上清加抗坏血酸,若变红,则继续透析,颜色不变则透析结束,冻干得硒化红枣多糖[17]。用紫外分光光度法测定硒元素含量[18]。
1.3.2 多糖含量和蛋白质含量测定
以葡萄糖为标准品,采用苯酚硫酸法[19]测定多糖含量。以牛血清白蛋白为标准品,采用考马斯亮蓝法[20]测定多糖中蛋白质含量。
1.3.3 光谱分析
1.3.3.1 紫外光谱分析
配制浓度为1 mg/mL多糖溶液,置于石英比色皿,在190 nm~400 nm波段下进行扫描,观察在260 nm处有无核酸吸收峰和280 nm有无蛋白质吸收峰,以检测杂质是否去除干净[21]。
1.3.3.2 红外光谱分析
将多糖样品粉末均匀附着于样品台上,使用傅立叶红外光谱仪(Fourier transform infrared spectroscopy,FT-IR)在4 000 cm-1~400 cm-1范围内扫描,并使用OMNIC软件分析结果[22]。
1.3.4 单糖组成分析
通过高效阴离子交换色谱仪分析4个样品的单糖组成,准确称取10 mg的多糖,在80℃下用4 mL 2.0 mol/L三氟乙酸水解6 h,去除残留的三氯乙酸,用超纯水定容至10 mL,并通过Supelclean ENVI-18固相萃取管和0.22 μm超滤管澄清。在30℃下以NaOH(0.20 moL/L)溶液作为流动相以0.25 mL/min的流速分析样品。
1.3.5 分子量的测定
精密称取样品和标准品,样品配制成5 mg/mL溶液,12 000 r/min离心10 min,上清液用 0.22 μm的微孔滤膜过滤,然后将样品转置于1.8 mL进样小瓶中。色谱柱:BRT105-104-102串联凝胶柱(8 mm×300 mm);流动相:0.05 mol/LNaCl溶液;流速:0.6 mL/min,柱温:40℃;进样量:20 μL;检测器:示差检测器 RI-502。
1.3.6 多糖样品的表面特征分析
利用ZEISS-SUPRATM55型扫描电子显微镜观察多糖样品的表面形态。将多糖样品粉末均匀附着于样品台上,置于离子溅射仪中进行真空镀金,在高真空条件下扫描样品。
1.3.7 相对黏度测定
配制1 mg/mL多糖溶液,整个试验流程将乌氏黏度计放在(25±0.5)℃条件下,将多糖溶液倒入乌氏黏度计中恒温15 min,测定多糖溶液从乌氏黏度计上刻度线流到下刻度线所需时间T1,以去离子水做对照,相同条件下所需时间T,T1/T即为多糖溶液在25℃条件下为浓度1 mg/mL的相对黏度[18]。
1.3.8 统计学分析
所有试验均重复3次,数据以平均值±标准差表示,采用Origin2017进行绘图。
2 结果与分析
2.1 红枣多糖改性前后的理化性质分析
红枣多糖改性衍生物取代度、得率及化学成分见表1。

表1 红枣多糖改性衍生物取代度、得率及化学成分Table 1 Substitution degree,yield and chemical composition of jujube polysaccharide modified derivatives
由表1可知,硫酸化红枣多糖取代度较高,为1.65,但得率较低,为59.15%。羧甲基化红枣多糖取代度较低,为0.42,但是得率最高,为91.1%。硒化红枣多糖得率为 68.8%,硒元素含量为(580.15±11.96)μg/g。红枣多糖中蛋白质含量最高,为1.49%,多糖含量也最高,为49.96%。而羧甲基化红枣多糖、硫酸化红枣多糖和硒化红枣多糖的多糖含量和蛋白质含量均有所降低,这可能是由于改性时酸性环境引起多糖和蛋白质降解以及新官能团引入,与童微等[23]的研究结果一致。红枣多糖的分子量为136 413 Da,羧甲基化红枣多糖的重均分子量为46 637 Da,硒化红枣多糖的重均分子量为136 153 Da,而硫酸化红枣多糖为两个洗脱峰,重均分子量分别为9 970 Da和6 149 Da。改性后多糖分子量均有所减小,硒化红枣多糖改性后分子量和改性前相差不大,硫酸化红枣多糖改性后分子量和改性前相差最大,表明硫酸改性时多糖发生了强烈降解。
2.2 光谱分析
2.2.1 紫外全波长扫描
红枣多糖的紫外扫描图谱见图1。
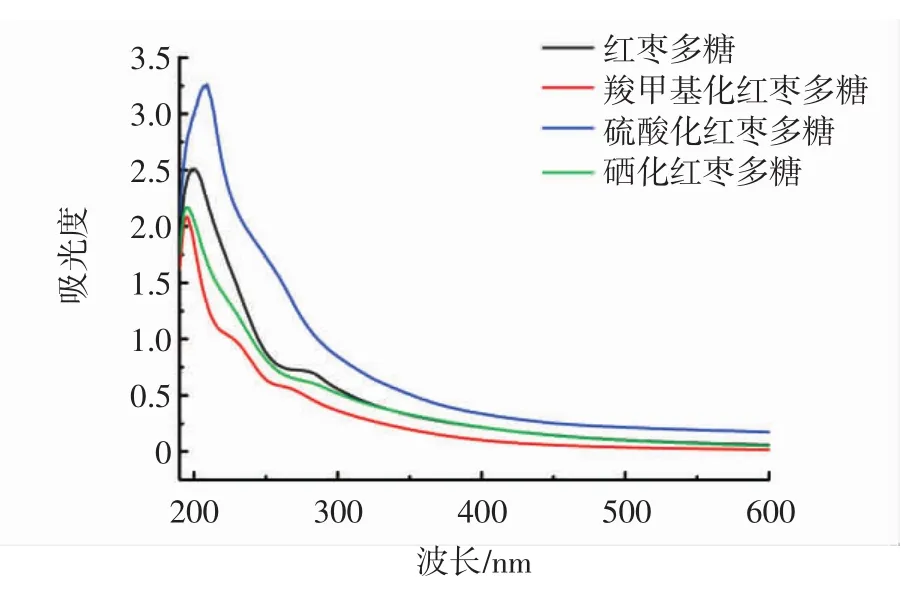
图1 红枣多糖的紫外扫描图谱Fig.1 UV spectrum of jujube polysaccharide
如图1所示,红枣多糖在280nm处有明显吸收峰,说明含有蛋白质杂质,其他多糖组分280 nm处没有明显多糖吸收峰,说明蛋白质含量少,结果和蛋白质含量测定结果一致。
2.2.2 红外光谱
红枣多糖的红外图谱见图2~图5。
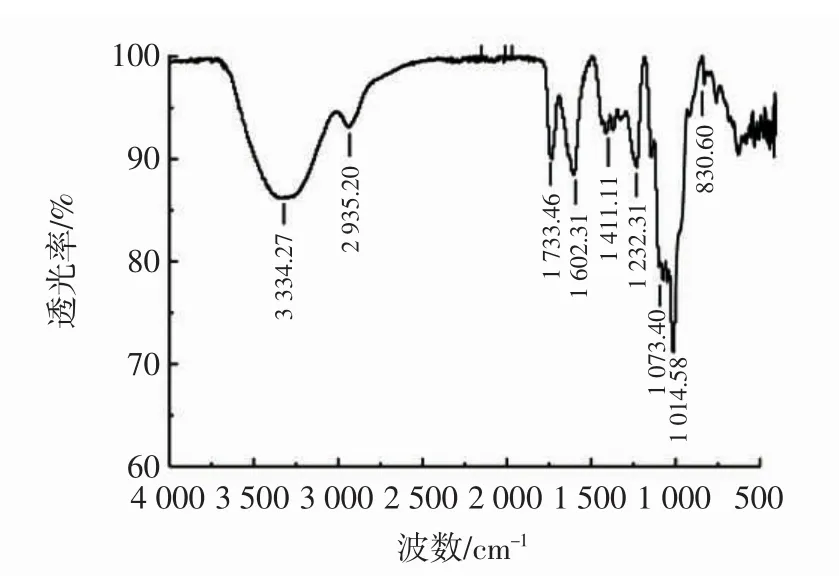
图2 红枣多糖的红外图谱Fig.2 FT-IR spectrum of jujube polysaccharide
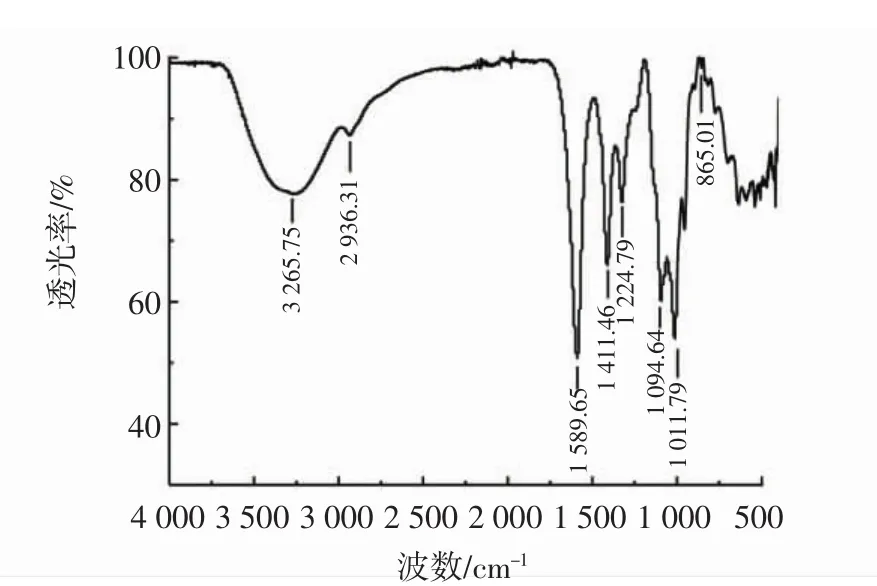
图3 羧甲基化红枣多糖的红外图谱Fig.3 FT-IR spectrum of carboxymethylated jujube polysaccharide
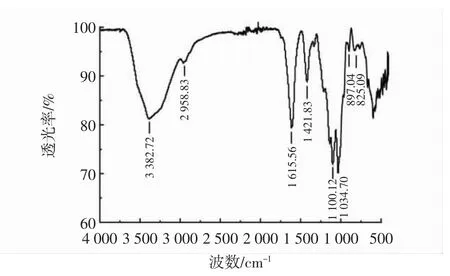
图4 硫酸化红枣多糖的红外图谱Fig.4 FT-IR spectrum of sulfated jujube polysaccharide
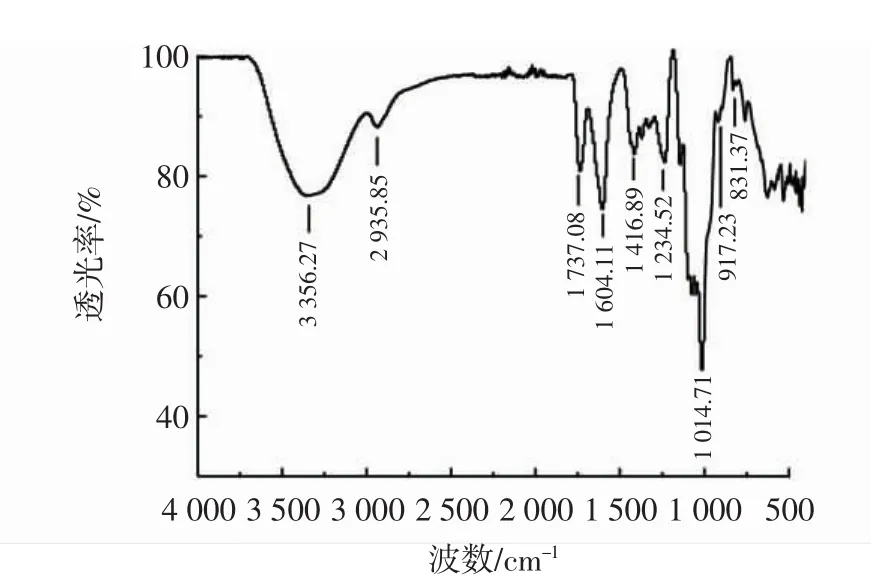
图5 硒化红枣多糖的红外图谱Fig.5 FT-IR spectrum of selenized jujube polysaccharide
由图2~图5可知,改性前后的多糖红外光谱在3 265.75 cm-1~3 382.72 cm-1范围内均有强吸收峰,是多糖分子间或分子内的O-H的伸缩振动引起的;在2 935.20 cm-1~2 958.83 cm-1均出现了弱吸收峰,是糖类不对称C-H伸缩振动。羧甲基化红枣多糖在1 640 cm-1处的信号为C=O的非对称伸缩振动,1 420 cm-1处的信号为次甲基的伸缩振动,这两个吸收峰附近是羧甲基的特征吸收峰,与红枣多糖红外光谱相比明显增强,说明发生了羧甲基化反应[24],各硫酸衍生物中均有硫酸根的特异吸收峰。硫酸化红枣多糖在1 212.46 cm-1处的信号为S=O的非对称伸缩振动,和红枣多糖红外光谱相比明显加宽,对应于酯硫酸盐基团,825.09 cm-1处的峰值,对应于C-O-S对称性拉伸振动[25]。将硒化红枣多糖与红枣多糖红外光谱进行比较,硒化红枣多糖在1 416.89 cm-1吸收峰增大,为糖环上与Se=O相邻的C-H特征吸收峰[26]。
2.3 单糖组成
单糖组成分析结果见表2。
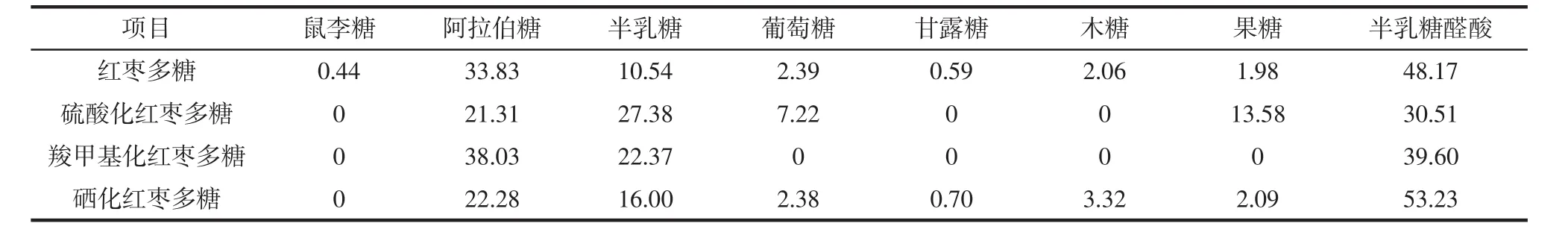
表2 单糖组成分析结果Table 2 Analysis results of monosaccharide composition%
由表2可知,红枣多糖主要由阿拉伯糖和半乳糖醛酸组成,其比例为33.83%和48.17%;硫酸化红枣多糖由阿拉伯糖、半乳糖、葡萄糖、果糖和半乳糖醛酸组成,其比例为21.31%、27.38%、7.22%、13.58和30.57%;羧甲基化红枣多糖由阿拉伯糖、半乳糖和半乳糖醛酸组成,其比例为38.03%、22.37%和39.60%;硒化红枣多糖主要由阿拉伯糖和半乳糖醛酸组成,其比例为22.28%和53.23%。
2.4 电镜结果
多糖扫描电镜见图6。

图6 多糖扫描电镜图片Fig.6 Scanning electron microphotograph of polysaccharide
由图6可知,红枣多糖呈不规则片状,表面相对平整光滑,结构致密。羧甲基化红枣多糖在100倍下的表面形态都呈分散、单片状分布,表明红枣多糖的规则纤维状结构被破坏,结构疏松,变为不规则的层状,在500倍和2 500倍下可看到其表面形状规则的圆形小孔[27]。硫酸化红枣多糖表面不平整,说明硫酸酯化修饰可以改变多糖的表面形态,使其颗粒变小,表面粗糙,形态更为复杂[28]。硒化红枣多糖有许多条形宽度不一的条形弯曲,放大后表面光滑,观察到圆形空洞[29]。
2.5 多糖的黏度
采用乌氏黏度计测量多糖的相对黏度,结果显示,在多糖浓度为10 mg/mL且温度为25℃条件下,红枣多糖的相对黏度最高,达到3.29,硒化红枣多糖的相对黏度为2.83,羧甲基化红枣多糖的相对黏度为1.57,硫酸化红枣多糖的相对黏度为1.04。
3 结论
本研究采用硫酸改性、羧甲基改性以及硒化改性方法对红枣多糖进行改性,硫酸改性和羧甲基改性的多糖含量显著降低。硫酸化红枣多糖的取代度为1.65,羧甲基化红枣多糖的取代度为0.42。硒化红枣多糖多糖中硒元素含量为(580.15±11.96)μg/g。高效凝胶渗透色谱法分析表明硫酸化红枣多糖的分子量变化最显著,其次是羧甲基化红枣多糖。多糖改性后仍具有多糖特征吸收峰,综合多糖取代度、红外光谱、分子量、单糖组成以及扫描电镜等多方面的结果分析,表明这3种改性方法对红枣多糖理化性质和结构有较大影响,可以得出多糖改性成功的结论。本研究为红枣多糖今后的衍生化修饰提供了一定的理论参考,但是多糖改性的最优工艺参数以及改后的生物活性有待于进一步研究。

