利格列汀对2 型糖尿病大鼠肾组织纤维化过程中骨膜蛋白及转化生长因子-β1的影响
弓慧杰, 张光明
(1.四川省成都市新都区人民医院内分泌肾病血液内科, 成都 610500; 2.西南医科大学病理生理研究室, 泸州 646000)
糖尿病肾病(diabetic nephropathy,DN)是糖尿病最常见、最严重的微血管并发症,其主要表现为肾脏纤维化,最终发展为终末期肾病,是导致慢性肾功能衰竭的主要原因之一[1]。肾脏纤维化的病理生理变化是肾脏固有细胞被大量细胞外基质取代,分泌大量炎性介质及细胞因子,从而破坏肾脏正常结构[1]。骨膜蛋白(periostin)是一种细胞外基质蛋白,研究发现在侵袭、迁移及黏附能力明显提高的细胞内其表达水平明显升高[2]。另外在以机体组织纤维化及迁移为特点的病理生理过程中,骨膜蛋白通过对胶原蛋白的调节,参与肾脏纤维化[3]。转化生长因子-β1(transforming growth factor-β1,TGF-β1)是引起肾脏损伤的重要炎性因子之一,也是单核巨噬细胞等分泌的具有多种生物学功能的细胞因子,在肾脏纤维化进展过程中发挥重要的促进作用。利格列汀(Inagliptin)是一种二肽基肽酶4(dipeptidyl peptidase-4,DPP-4)抑制剂,通过高效地选择性抑制DPP-4 来调节血糖,具有一定的肾脏保护作用[4]。本实验以2 型糖尿病大鼠为研究对象,观察肾组织纤维化过程中骨膜蛋白和TGF-β1 的表达变化,以及利格列汀是否会影响这两个指标的表达水平,为治疗糖尿病肾病提供新的实验依据。
1 材料与方法
1.1 实验材料
1.1.1 实验动物
雄性SD大鼠36只,体质量为230~250 g,由西南医科大学实验动物中心[SCXK(川)2018-17]提供,动物质量合格证号为川医动字第2401115,饲养于西南医科大学实验动物中心[SYXK(川)2018-065]的屏障环境。动物实验经西南大学动物福利伦理委员会审查批准(文号:IACUC2018001592)。
1.1.2 实验仪器
微型凝胶电泳仪(日本Mupid公司),全光谱酶标读数仪(10-240 VAC,美国Thermo 公司),紫外分光光度计(JC-UT2000型,成都光学仪器厂),凝胶图像扫描系统(Tannon 2500 型,美国BioRad 公司),光学显微镜(AX-72型,日本Olympus光学仪器公司)。
1.1.3 主要试剂
利格列汀片(欧唐宁®,批号H20130865,美国Eli Lilly and Company 公司),TRIzol 试剂盒及RT-PCR试剂盒(成都市博瑞克生物技术有限公司),链脲佐菌素(streptozotocin,STZ)(美国Sigma公司),ELISA试剂盒(上海西唐生物科技有限公司),SP 免疫组化检测试剂盒(泉州市睿信生物科技有限公司)。
1.2 实验方法
1.2.1 糖尿病大鼠模型建立及分组
24 只大鼠禁食不禁水12 h 后,称其体质量并腹腔注射60 mg/kg 的STZ,建立糖尿病模型。另外12 只SD大鼠注射等剂量的柠檬酸缓冲液,作为对照组。注射STZ 的大鼠48 h 后尾静脉取血,测空腹血糖水平,血糖浓度≥16.7 mmol/L 的大鼠确定为造模成功。24 只大鼠均造模成功。将造模成功的大鼠随机分为糖尿病模型组及治疗组,每组各12只。治疗组大鼠予以利格列汀(10 mg·kg-1·d-1)持续灌胃12周,模型组及对照组予以等剂量的生理盐水(即0.9%NaCl溶液)灌胃相同时间。实验期间各组大鼠均给予普通饲料喂养,12 周后3组大鼠腹腔注射戊巴比妥钠50 mg/kg麻醉,开腹取肾脏备用。
1.2.2 肾脏切片HE染色观察
将大鼠肾脏组织用4%甲醛溶液固定2~3 h后包埋并切片;切片置入苏木精染液中5 min,自来水充分清洗后置于1%的盐酸乙醇溶液中分化数秒,用自来水冲洗;再次将切片置入伊红染液中染色5 min,充分清洗;再次将切片置于梯度乙醇溶液及无水乙醇中脱水5 min,放入二甲苯中透明5 min 后,用树胶封固。光学显微镜(100倍、200倍)下观察,拍照。
1.2.3 RT-PCR检测肾脏组织中骨膜蛋白和TGF-β1 mRNA转录水平
依据TRIzol 试剂盒说明书提取各组大鼠肾脏组织中RNA,琼脂糖凝胶电泳检测RNA完整性,然后采用紫外分光光度法测定RNA的纯度和浓度。采用反转录试剂盒将总RNA 进行反转录,分别得到模板单链cDNA 后进行PCR 反应。骨膜蛋白上游引物序列为5′-GCTGGCACCTGTGAATA-3′,下 游 引 物 序 列 为5′-TCTCCCTTGCTTACTCC-3′,目标产物长度为252 bp;TGF-β1 基 因 上 游 引 物 序 列 为5′-TGGAAACGACC TTCTATGACGATG -3′,下游引物序列为5′-TGATGT GCCCGTTGCTGGAC-3′,目标产物长度为195 bp。GAPDH上游引物序列为5′-CAACTCCCTCAAGATTGT CAGCAA-3′,下游引物序列为5′-GGCATGGACTGTG GTCATGA-3′,目标产物长度为207 bp。PCR 反应体系:dNTP原料混合液10 μL,转录酶0.5 μL,RT-PCR增强剂0.25 μL,模板cDNA 5 μL,上下游引物各1 μL,无核酸酶水2.25 μL。反应条件:94 ℃30 s 变性,50 ℃10 s 退火,70 ℃30 s延伸,35个循环。反应后的产物经琼脂糖凝胶电泳,分离目的条带,拍照。最终结果以目的基因与内参GAPDH光密度的比值表示骨膜蛋白、TGF-β1的mRNA转录情况。
1.2.4 免疫组织化学法检测肾脏组织中骨膜蛋白和TGF-β1蛋白表达
将大鼠肾脏组织制作切片标本,然后用磷酸缓冲盐溶液清洗,冷丙酮4 ℃固定15 min 后,再次磷酸缓冲盐溶液漂洗;3%去离子水室温孵育15 min后血清封闭,37 ℃孵育15 min,加入兔抗鼠骨膜蛋白一抗或马抗鼠TGF-β1 一抗(工作液体积稀释比例分别为1∶200、1∶100),37 ℃孵育2 h;磷酸缓冲盐溶液漂洗,加入山羊抗兔二抗或兔抗马二抗(工作液体积稀释比例分别为1∶50、1∶100),37 ℃孵育1 h;磷酸缓冲盐溶液漂洗,加DAB显色剂显色。光学显微镜(400倍)下选取30 个随机视野,摄影,然后使用IPP 软件分析平均积分光密度(integral optical density,IOD),以此反映骨膜蛋白和TGF-β1蛋白的含量。
1.3 统计方法
采用统计软件SPSS 22.0进行结果分析。各实验的检测结果数据均用-x±s表示。多组间比较采用单因素方差分析,组内两两比较采用LSD-t检验。以P<0.05表示差异有统计学意义。
2 结果
2.1 利格列汀抑制糖尿病模型大鼠的肾组织纤维化
HE 染色后光学显微镜下观察结果(图1)显示,对照组大鼠的肾小球分布相对密集,大部分呈椭圆形,外周光滑;血管球内毛细血管分布也密集;肾小管的管腔光滑、规整。与对照组比较,糖尿病模型组大鼠的肾皮质内小叶间动脉、入球小动脉、弓形动脉的管壁明显增厚,管腔明显变小;细胞外基质增多;有大量染色较深且核质比例相对较大的炎性细胞浸润,肾小管明显扩展;肾小球出现萎缩,纤维化明显。治疗组较模型组的纤维化病变明显减轻。
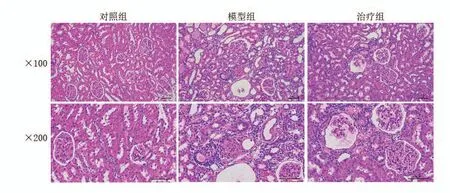
图1 HE染色显示各组大鼠肾脏组织病理学特征(×100,×200)Figure 1 The pathological characteristics in renal interstitium of rats detected by HE staining(×100,×200)
2.2 利格列汀抑制糖尿病模型大鼠的肾小管间质病变
Masson 染色结果显示,肾脏胶原着色主要位于Bowman囊、肾小球基底膜和肾小管微小血管周围。与对照组相比,糖尿病模型组大鼠的肾间质宽度增加,系膜基质增生,肾小管管腔扩张,肾间质深蓝色胶原沉积显著。治疗组大鼠的肾小管间质病变明显轻于模型组(图2)。

图2 Masson染色显示各组大鼠肾组织(×100,×200)Figure 2 The pathological characteristics in renal interstitium of rats detected by Masson staining(×100,×200)
2.3 利格列汀下调糖尿病模型大鼠肾脏组织中骨膜蛋白和TGF-β1 mRNA转录
RT-PCR 检测结果显示,与对照组相比,糖尿病模型组大鼠肾脏组织中骨膜蛋白和TGF-β1 mRNA表达水平显著升高,差异有统计学意义(P=0.031 5);与糖尿病模型组比较,治疗组糖尿病大鼠肾脏组织中骨膜蛋白和TGF-β1 mRNA表达水平明显下降,差异有显著的统计学意义(P=0.007 2)(图3)。

图3 RT-PCR法检测各组大鼠肾脏组织中骨膜蛋白和TGF-β1 mRNA表达Figure 3 The expressions of periostin and TGF-β1 mRNA of in renal renal interstitium of rats detected by RT-PCR
2.4 利格列汀下调糖尿病模型大鼠肾脏组织中骨膜蛋白和TGF-β1蛋白表达
免疫组织化学法检测结果(图4)显示,与对照组相比,糖尿病模型组大鼠肾脏组织中骨膜蛋白和TGFβ1 表达水平偏高,差异有统计学意义(P=0.003 8);与糖尿病模型组相比,治疗组糖尿病大鼠肾脏组织中骨膜蛋白和TGF-β1 表达水平明显下调,差异有统计学意义(P=0.037 0)。

图4 免疫组织化学法检测各组大鼠肾组织骨膜蛋白和TGF-β1的表达变化(DAB染色,×400)Figure 4 The expressions of periostin and TGF-β1 protein in renal renal interstitium of rats detected by immunohistochemistry(DAB,×400)
3 讨论
糖尿病肾病是糖尿病晚期出现的一种严重的微血管并发症,是临床上糖尿病患者主要的死亡原因之一,患者死亡率远大于其他慢性肾脏病患者。肾脏纤维化是糖尿病肾病进展的主要特征,其表现为肾脏本身实质细胞合成细胞外基质增多。研究发现,肾脏纤维化进展与肾素-血管紧张素-醛固酮系统、炎性反应及氧化应激密切相关,其中TFG-β1 对信号转导发挥着重要作用[5]。因此,TGF-β1 及其下游的调节因子作为抗纤维化治疗的有效靶标,受到越来越多的关注[6]。TGF-β1 是一种具有多项调节功能的纤维形成生长因子,可诱导肾脏血管内皮细胞向肌成纤维细胞转分化,在肾脏纤维化过程中起到关键决定性作用[7]。推测TGF-β1是糖尿病肾病纤维化过程中的核心因子,可通过促进肾脏实质细胞外基质蛋白的分泌合成并抑制降解,诱导肾脏实质细胞发生炎性反应,加速糖尿病肾病的发展。因此,研究糖尿病肾病纤维化进展机制并开发有效的阻断药物,成为了目前迫切需要探讨的研究内容之一。
骨膜蛋白作为一种细胞外基质蛋白,可以通过整联蛋白受体产生粘附作用,并与多种胶原蛋白结合,促进Ⅰ型胶原蛋白、Ⅴ型胶原蛋白、肝素黏连蛋白等的分泌及成熟,参与糖尿病肾病纤维化[8]。骨膜蛋白是早期肾病肾小管损伤的敏感性生物标志物,并且与糖尿病肾病的并发症关系密切[9]。有文献报告,受到损伤的急性肾小管上皮细胞中骨膜蛋白处于高表达状态,Ⅰ型、Ⅲ胶原蛋白表达增加,推测骨膜蛋白可能通过某种途径参与了Ⅲ胶原蛋白形成[11];然而这一结论还需要通过后续的体内外实验进行验证,例如将骨膜蛋白基因沉默质粒转染至糖尿病肾病大鼠肾小管上皮细胞,探讨骨膜蛋白调控Ⅲ胶原蛋白的病理生理学机制。另外,推测TGF-β1 作为糖尿病肾病纤维化过程中的核心因子,可能通过正相关调控骨膜蛋白的表达水平,加速糖尿病肾病进展。本实验结果证实,在糖尿病模型组中TGF-β1和骨膜蛋白及其mRNA表达水平均明显升高(P<0.05),提示两个指标之间有一定的相关性。
利格列汀是一种治疗2型糖尿病的药物,其作用模式是抑制胰高血糖素样肽1(glucagon-like peptide-1,GLP-1)代谢。GLP-1 是一种肠促胰素,具有葡萄糖浓度依赖性。利格列汀还可以抑制胰高血糖素的释放[11]。另外,利格列汀是一种DPP-4抑制剂,可能是治疗2型糖尿病肾病的一种潜在的新型药物[12]。有文献报告,在糖尿病小鼠动物实验中,DPP-4 治疗后TGF-β1水平较对照组明显下降,说明在2型糖尿病大鼠实验中利格列汀不仅可以改善早期糖尿病肾病的血糖水平,而且还有保护肾脏功能及调节机体炎性状态的作用,在早期糖尿病肾病的病情控制中发挥着重要作用[13]。本实验结果表明,糖尿病肾病大鼠经利格列汀干预后骨膜蛋白及TGF-β1 表达均明显下调,对肾脏纤维化有一定保护作用,这与文献[13]的研究结果一致。
综上所述,本实验中糖尿病模型组大鼠骨膜蛋白及TGF-β1均处于高表达状态,而经利格列汀治疗后,骨膜蛋白和TGF-β1蛋白表达及mRNA转录水平均明显下降。结合本实验结果推断,腹腔注射利格列汀可下调糖尿病小鼠肾脏中TGF-β1 水平,从而促进骨膜蛋白降解,延缓糖尿病肾脏纤维化的发生与发展。本研究结果提示,TGF-β1可能是一个重要的调控因子,可能成为治疗糖尿病肾病进展的作用靶点,为糖尿病肾病纤维化的预防和治疗提供了新的思路。

