2014~2019年小清河春季水生生物群落结构变化
郭钰伦,殷旭旺,王 韬,祝孔豪,徐 军
(1.大连海洋大学 水产与生命学院,辽宁 大连 116023;2.中国科学院水生生物研究所,湖北 武汉 116023)
1 引言
河流生态系统是典型的空间异质性生态系统,具有积蓄水分、输送泥沙、维持生物多样性等生态功能,是水生态与陆地生态系统间物质、能量与信息的纽带,其生物因子与环境间的多维交互能够体现河流生态系统的结构和功能[1]。此前,基于河流的生物多样性研究多专注于单一功能群的群落结构变化,缺乏对多功能群群落结构特征在时间尺度下的监测与比较。了解这一变化规律将有利于生物多样性-生态系统功能的研究。
浮游植物、浮游植物和底栖动物是河流生态系统的重要组成部分。其中,浮游生物能够针对水体动态进行复杂而快速的响应[2],其群落结构可作为水质监测的良好指标[3]。底栖动物具有栖息形式多样、食性关系复杂等特点,其群落组成能够准确反映栖息地的变化情况,被广泛应用于生态评价当中[4]。浮游植物的群落稳定性受水体理化性质影响,其对环境的适应性差异会增加单一蓝藻爆发的风险[5],同时形成上行效应,对捕食者摄食、繁殖等行为造成影响,从而影响生态系统的稳定性。近年来,随着人类活动干扰强度逐渐加强,河流生态系统功能严重退化,生物多样性急剧丧失[6]。
济南作为环渤海地区南翼的中心城市,拥有“山、泉、湖、河、城”的独特风貌,近年来不断加强生态环境管控力度,取得了全市国控断面100%达标、水质类别全部提升,Ⅰ类-Ⅲ类水体比例达90%的成效,其相应生境和生物多样性恢复情况亟待探究。本文以山东小清河济南段为研究对象,对流域中浮游植物、浮游动物及底栖动物进行调查,分析小清河水环境特征及水生生物群落动态,通过历史同期数据对比,讨论水生生物群落结构的变化规律,总结分析不同功能群变化与水环境的关系,探究人类活动及生境改变对河流生态系统的影响,以期为流域水环境保护及生态规划提供资料。
2 材料与方法
2.1 样点设置与样品采集
于2014~2019年春季在小清河流域进行采样调查。样点分布见图1。于水面下0.5 m处采集混合水样2 L,滴加鲁戈氏液(15 mL)后静置浓缩;另取100 L混合水样,使用25#浮游生物网浓缩至50 mL后滴加甲醛固定,底栖动物根据河流底质使用索伯网、D形网组合采集,样品使用95%酒精保存,于光学显微镜下进行浮游生物及底栖动物的计数与鉴定(Olympus-CKX41SF);水温、pH值、DO及电导率使用YSI采集(YSI-HQ40d)、总氮总磷使用分光光度法(UV3300)测定。
图1 小清河(济南段)点位分布
2.2 统计分析
Rubin 等认为,群落丰度、密度、物种丰富度、多样性指数及群落组成是最常用于评价河流恢复成功与否的指标[7]。本次调查采用方差分析对比了水体理化指标、浮游生物和底栖动物生物量及相关指数的差异性,并使用自然对数变换对数据进行处理,提高了分布的正态性。通过标绘模型残差与拟合值和模型残差对偶的分位数数量标绘,直观地评估了因变量的范围和方差。所有统计均通过R4.04 (Team 2021)完成。
浮游生物优势种使用优势度指数计算,Y>0.02为优势种,底栖生物根据生物量是否大于30%判断其优势。
(1)
式(1)中:ni为i种浮游生物数量;N为总数量;fi为该种的出现频率。
Shannon-Wiener 多样性指数、Pielou均匀性指数及Simpson多样性指数对浮游生物与底栖动物的群落结构特征进行分析。水生生物生物量及相关指数均为自变量。
(2)
(3)
(4)
式(2)~(4)中:Pi代表某水生生物个体在所有物种个体总数中的比例,S为物种数,Ni为i种水生生物的个体数,N为所有水生生物的个体总数。
3 调查结果
3.1 小清河春季水质变化
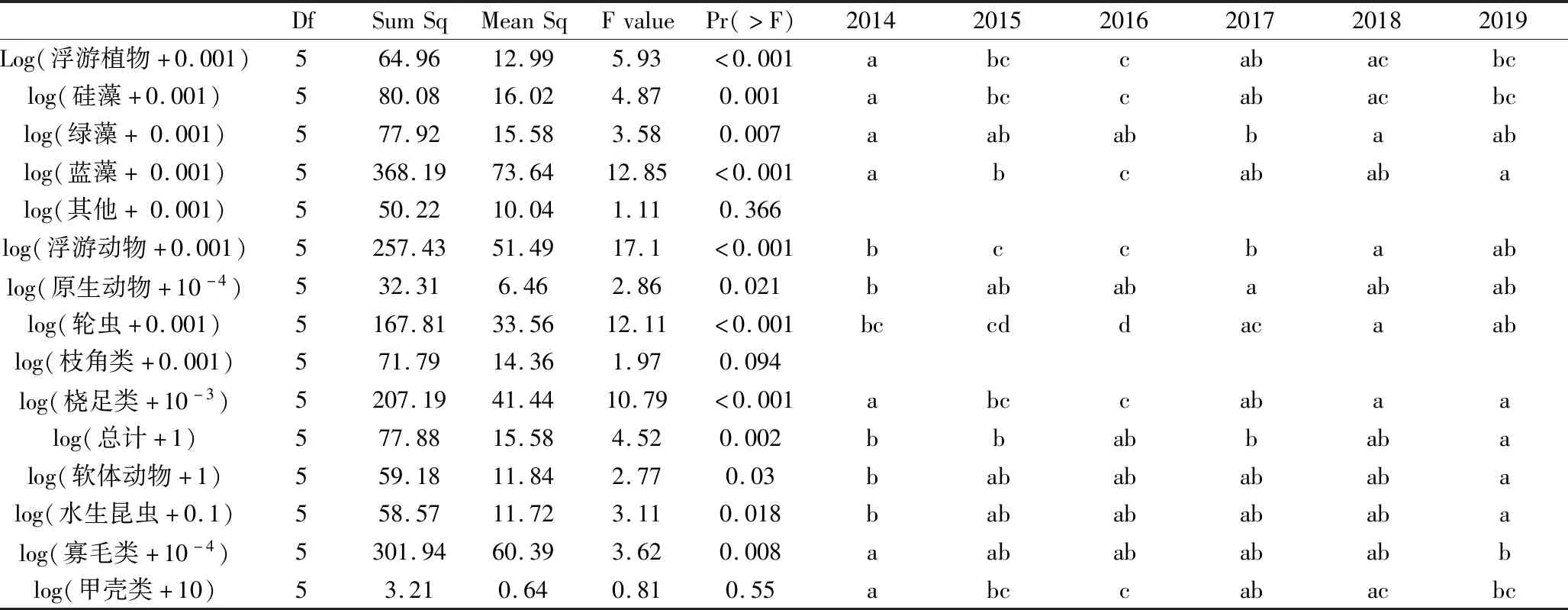
2014~2019年小清河流域(济南段)春季平均水温为24.10±1.38 ℃,pH平均值为7.96±0.28,浊度均值为43.64±47.52,电导率平均值为1303.56 ± 151.94 mS/m,溶氧为6.54 ± 1.83 mg/L,总氮、总磷分别为8.89±1.63 mg/L和0.59±0.18 mg/L,COD为5.51±0.10 mg/L总硬度为469.48±168.06 mg/L(图2)。其中,2019年水体pH值、溶氧和浊度相较之前明显提高、年纪变化差异显著(P<0.05,附表2)。
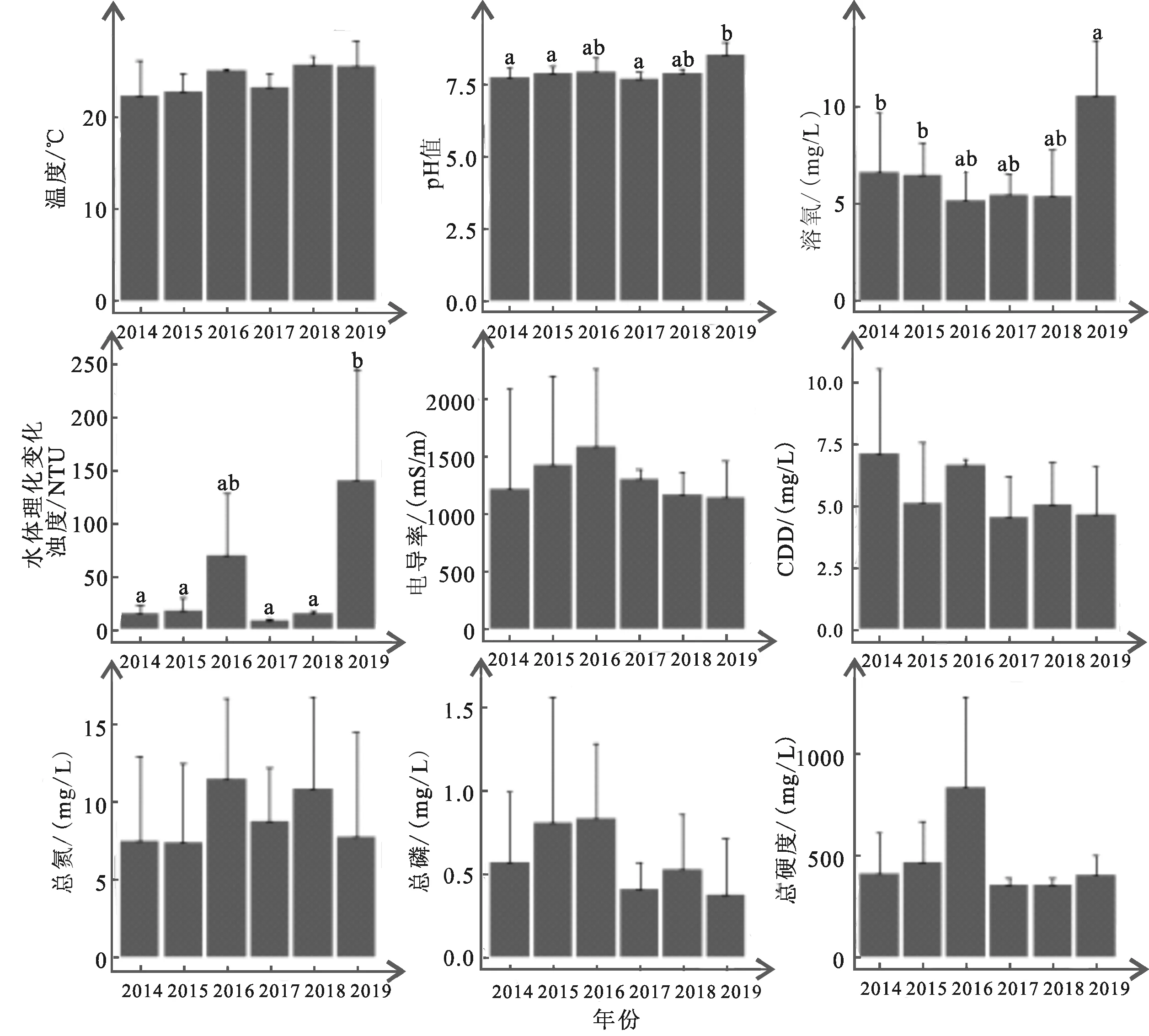
图2 小清河流域(济南段)春季水体理化性质年度变化
3.2 密度及优势种年际变化规律
水生生物群落丰度统计见表1。2014~2019年,浮游植物平均密度为3.17×107ind/L,浮游动物平均密度为49.79 ind/L,底栖动物平均密度为533.70 g/m2。2014年,浮游植物中小片菱形藻(Nitzschiafrustulum)及针形菱形藻(Nitzschiaacicularis)优势度最高,2015年为优势种小席藻(Phormidiumtenue)和小环藻;2016年为小席藻和细小平裂藻(Merismopediatenuissima),2017年为简单衣藻(Chlamydomonassimplex)和细小平裂藻,2018年为尖针杆藻(Synedraacus)和小球藻(Chlorellavulgaris)(Y=0.12);2019年为科曼小环藻(CyclotellacomensisGrun.)及平片针杆藻(Synedratabulata)。

表1 小清河(济南段)春季水生生物密度年际变化
在浮游动物中,2014年曲腿龟甲轮虫(Keratellavalga)、萼花臂尾轮虫(Brachionuscalyciflorus)及角突臂尾轮虫(Brachionusangularis)优势度最高,2015~2016年优势种为桡足幼体(Copepodid)及萼花臂尾轮虫,2017年为矩形龟甲轮虫(Keratellaquadrata)、无节幼体(Nauplii)及桡足幼体;2018年为裂足臂尾轮虫(Brachionusdiversicornis)及椎尾水轮虫(Epiphanessenta),2019年为普通表壳虫(Arcellavulgaris)、前节晶囊轮虫(Asplanchnapriodonta)及刺簇多肢轮虫(Polyarthratrigla)。底栖动物优势种详见表3。
3.3 生物量及群落组成变化
水生生物调查结果见图3。其中其他藻类包括裸藻、隐藻、甲藻、金藻和黄藻,软体动物包括瓣鳃纲及腹足纲,寡毛类为寡毛纲及蛭纲。浮游植物主要涉及硅藻门、蓝藻门、绿藻门等共计233种,年际变化差异显著(附表2)。2014、2015年主要贡献藻类为硅藻(59.04%,77.98%),2016年为硅藻(46.41%)和蓝藻(35.90%);2017年藻为硅藻(60.72%)和绿藻(36.44%);2018、2019年以硅藻为主(78.40%,87.65%)。
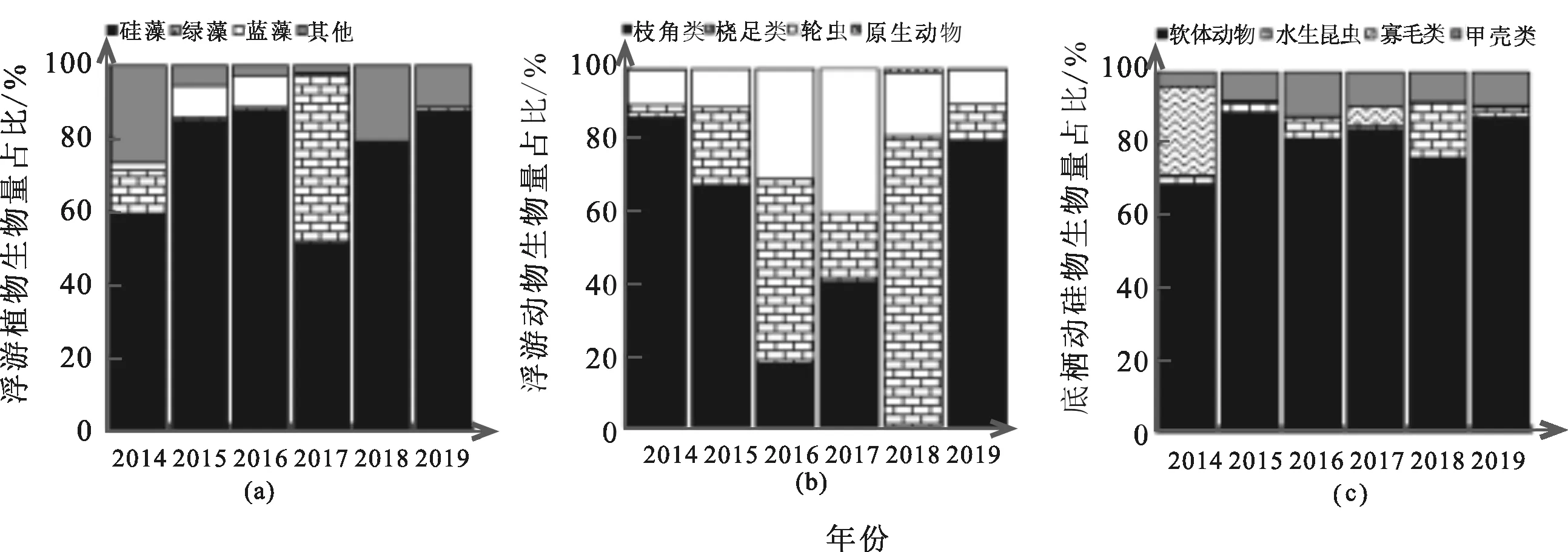
图3 小清河流域(济南段)水生生物生物量年际变化
共鉴定到原生动物24种、轮虫42种、枝角类12种,桡足类10种,除枝角类外年际变化显著(附表2)。2014~2015年,小清河流域的浮游动物以枝角类(86.38%,67.50%)为主;2016年,主要贡献种类为桡足类(51.34%)及轮虫(30.60%),2017变更为枝角类(40.63%)和轮虫(40.30%),2018年主要贡献种类为桡足类(81.32%),2019年以枝角类(79.73%)为主。
2014~2019年春季共鉴定底栖动物6类48种。2014年底栖动物主要为软体动物(68.87%)及寡毛类(24.62%),2015~2019年以均腹足纲为主(88.87%,81.38%,76.18%,66.75%和87.31%,除甲壳类以外年际变化明显,主要差异体现在2014与2019年间,底栖动物生物量显著减少。
3.4 水生生物群落结构变化
水生生物群落结构变化见图4,浮游植物及底栖动物群落结构变化无明显差异。浮游动物香农威纳指数及Simpson指数变化波动明显,2018年Simpson指数继2014年显著升高后再次提升,显著高于其余年份(P<0.01,附表2),同年香农维纳指数相较其他年份显著降低(P<0.01,附表2)。所有功能组Pielou均匀度指数差异均不明显。由于底栖动物并未统计物种数量,故并未进行底栖动物Simpson指数的计算。
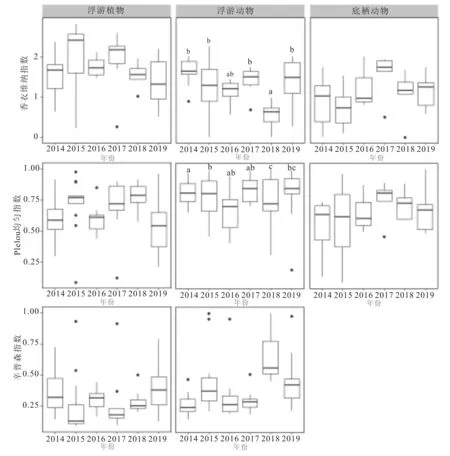
图4 小清河流域(济南段)春季水生生物群落结构变化
4 讨论
4.1 浮游植物年际变化
小清河发源于济南市南部山区,经滨州流向淄博、东营,于寿光市羊口镇汇入渤海,是莱州湾无机氮和污染物的主要来源[8],近年有关于其区段水体营养超标、浮游植物群落结构单一的报道[9]。2014~2019年间,小清河浮游植物生物量年际变化差异显著(附表2),浮游植物以硅藻为绝对优势,2017年前后平均密度差异较大,蓝绿藻比例增加,其原因可能流域内部分地区水体氮磷充足,且较高的水体透明度为光合藻类提供了优势,增强了蓝、绿藻的竞争力,这与附近海湾外源氮促进浮游植物生长的结果类似[10,11],2019年群落组成再次变更为以硅藻为主。有研究认为,浮游植物的Shannon-Wiener指数可作为河流生态系统污染程度的评价依据[12],在此次调查中,浮游植物Shannon-Wiener均值为1.70±0.61,均匀度指数均值为0.65±0.20,Simpson指数均值为0.21±0.20,年际变化无明显差异,河流水质总体属于中度污染。
附表2 水生生物群落结构参数方差分析结果
4.2 浮游动物年际变化
浮游动物因其独特的生存方式,及对周围变化反应迅速的特征被应用于水域生态系统的健康评价当中。通常来说,富营养化水体中轮虫比例更高,而中、贫营养水体中枝角类生物量更为丰富[13],河流浮游动物的生物量以体型较大的桡足类和枝角类为主[14],本次调查结果基本符合此类特征。调查显示,2014~2019年小清河济南段浮游动物平均密度为49.79 ind./L,密度远小于西藏尼洋河流域[15],但高于渭河[16],萼花臂尾轮虫为浮游动物中的稳定优势种。与浮游植物表现出的年际变化类似,2017年前后浮游动物生物量及密度整体降低,轮虫占比增加。Yang等研究表明,水体营养是驱动浮游动物群落结构改变的重要因素,富营养水体会降低浮游动物群落的稳定性,往往使提升其单一种类的丰度[17]。调查结果显示,小清河济南段浮游动物种类组成较为单一,生物量年际变化差异显著,生物多样性存在明显波动,不利于该区域的生态系统稳定性。
4.3 底栖动物年际变化
山东省于近年开展了小清河污染专项治理,对小清河进行了清淤疏浚。有研究显示,河床扰动及水体污染会驱动底栖动物的空间分布,其消失或出现可作为生态系统发生间歇或持久影响的表征[18,19],2014~2019年间,小清河流域(济南段)春季底栖动物除甲壳动物生物量均显著减少,其中,软体动物(螺类)占据生物量绝对优势,群落结构无明显变化。其原因可能是由于生态系统中硅藻含量较高,“刮食者”更具竞争力。由于甲壳类更喜爱相对“柔软”的食物,2017年前后绿藻增加可能是其生物量变化的影响因素。同时,底栖动物群落结构与水体氮磷含量息息相关,吴东浩等研究得出,当水体氮磷越过其安全阈值,底栖动物群落结果将会严重退化[20]。另外,浊度是螺类等刮食者的重要影响因素[21],水体浑浊也可能是螺类占据优势的原因。在调查期间,底栖动物的香农维纳指数一直处于较低水平,表示其群落多样性较低,区域生态系统健康状况不佳,生态系统结构及功能亟需修复。
5 结论及展望
小清河流域(济南段)春季水生生物类群群落结构近年波动较大,主要体现在生物量减少、多样性降低等方面,2017年前后出现蓝、绿藻优势种,浮游动物生物量大幅降低,轮虫占比增加,2019年浮游生物生物量有所上升,底栖动物生物量进一步减少。目前,基于水生生物的环境评价方法逐渐被国内外关注,并已在多地开始应用,但事实上,河流生态系统中水生生物的群落结构变化往往受制于单因子或多因子引发的综合效应,此类效应往往复杂且持久,需要对环境及水生生物群落结构的长久监测,因此,诸多环境因子与多类群群落结构、乃至生态系统的结构与功能变化关系在很长一段时间里仍将是需要完善和探索的内容。应着重研究和了解水生生物类群功能与环境稳态之间关系,探索总结生态修复和治理的妙药良方。

附表1 小清河(济南段)春季水生生物优势种年际变化

续附表1

