aMn-bCu/Y催化剂协同臭氧催化氧化降解甲苯
叶丽萍,夏克,黄金花
(1.聚烯烃催化技术与高性能材料国家重点实验室,上海 200062;2.上海化工研究院有限公司,上海 200062;3.上海市聚烯烃催化技术重点实验室,上海 200062)
低温臭氧催化氧化以其低温反应、产物清洁等优势被认为是有前景的VOCs绿色治理技术[1-3],但其很大程度依赖催化剂。近年来研究主要致力于负载型金属催化剂[4],代表性的有Mn、Co、Fe、Cu,这种氧化物具有高密度供电子中心,吸附氧后易形成O-和O2-,对VOCs降解起主导作用[5]。此外,载体类型对催化剂物化性能影响显著[6-8]。SiO2、Al2O3、TiO2等为常用载体,而沸石类Y型分子筛比表面积大、微孔孔径适中,是较理想的VOCs吸附剂,但在该领域鲜有报道。
本文以Y分子筛为载体,等体积浸渍法制备aMn-bCu/Y催化剂,常温下研究其臭氧催化氧化性能,并结合多种表征阐明Mn/Cu负载量、催化剂性质与甲苯降解性能间的构效关系。
1 实验部分
1.1 试剂与仪器
条型Y分子筛,氢型,由天津南化催化剂有限公司提供;Mn(NO3)2、Cu(NO3)2均为分析纯;实验用水均为自制去离子水。
D/max-RA型X射线衍射仪(XRD);ASAP-2020M型物理吸附仪(BET);FineSorb-3010型程序升温化学吸附仪(NH3-TPD,H2-TPR);PHI 5300型X射线光电子能谱分析仪(XPS);JZCF-G-3-5 g型臭氧发生器;固定床反应器,由北京拓川石化评价装置有限公司提供;FD-PG型VOCs发生器;GC 2060型气相色谱仪;D07-19B质量流量计;PGM-7340便携式气体分析仪。
1.2 催化剂制备
将条形Y分子筛破碎、研磨、过筛。称取4 g Y分子筛(40~60目)置于坩埚底部铺平。将一定量的50%Mn(NO3)2和Cu(NO3)2·6H2O加入带刻度的离心管中(依据m(Mn)/m(Y)=a%,m(Cu)/m(Y)=b%,a/b=3),加入去离子水,稀释至4 mL,混合均匀。将混合金属盐溶液逐滴、均匀滴加到坩埚中的Y载体上,超声15 min,静置、充分浸渍过夜。烘箱110 ℃干燥10 h,再在马弗炉中550 ℃焙烧4 h,得催化剂,标记为aMn-bCu/Y。
作为对比,以同样的方法制备了单金属催化剂aMn-0Cu/Y(依据m(Mn)/m(Y)=a%,m(Cu)/m(Y)=0)和0Mn-bCu(依据m(Mn)/m(Y)=0,m(Cu)/m(Y)=b%)。
其中,m(Mn)为按照添加的50% Mn(NO3)2质量计算得出的催化剂中理论上Mn的质量;m(Cu)为按照添加的Cu(NO3)2·6H2O质量计算得出的催化剂中理论上Cu的质量;m(Y)为Y分子筛载体的质量。
1.3 催化剂表征
X射线衍射(XRD)在X射线衍射仪上采集,使用Cu Kα射线,扫描范围20~80°,管压40 kV,管流100 mA,连续扫描速率4(°)/min(2θ)。比表面积和孔径分布采用物理吸附仪测试。NH3-TPD在化学吸附仪上进行,0.1 g样品先在氦气氛下400 ℃预处理1 h,冷却至100 ℃后吸附氨气至饱和,并经氦吹扫除去吸附过量的氨气,最后以10 ℃/min的速率从100 ℃升温至700 ℃,进行程序升温脱附。H2-TPR 在化学吸附仪上进行,0.05 g样品先在Ar气氛下300 ℃预处理1 h,冷却至室温,通入10% H2/Ar混合气,以10 ℃/min的速率升温至600 ℃,进行程序升温还原。XPS表征在X射线光电子能谱分析仪上进行,仪器采用Mg靶,管电压14 kV,功率0.25 kV,所测元素的键合能以C 1s=284.6 eV为标准进行校正。
1.4 催化剂协同臭氧处理甲苯
催化剂协同臭氧处理甲苯性能评价装置流程见图1。

气体流量由质量流量计调控。通过VOCs发生器产生定量甲苯,与臭氧发生器产生的臭氧在混合器混合,再经装填有催化剂的固定床反应器(Ф16 mm × 4 mm ×800 mm,不锈钢)床层进行催化臭氧氧化甲苯反应。反应尾气进入气相色谱仪(配有火焰离子化检测器(FID)和热导检测器(TCD)和便携式气体分析仪进行定性和定量分析。其中,定义甲苯转化率98%及以上的反应时间记为t98;定义臭氧保持完全转化的持续时间(即尾气中无臭氧残留可维持的时间)记为T100。
2 结果与讨论
2.1 Mn、Cu负载量对催化剂物化结构影响
2.1.1 BET结果 aMn-bCu/Y催化剂BET分析结果列于表1。
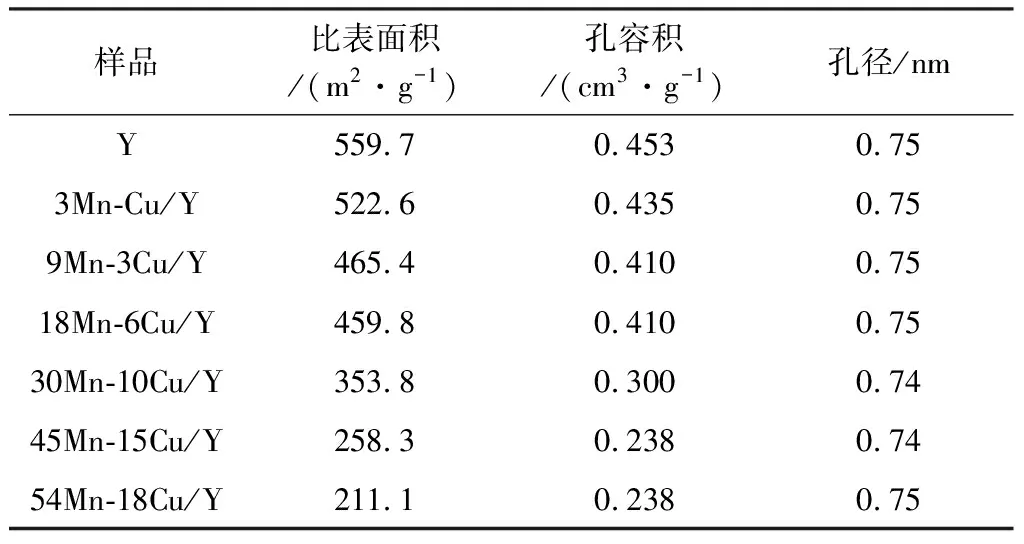
表1 aMn-bCu/Y催化剂物化性质Table 1 Physicochemical properties of various aMn-bCu/Y catalysts
由表1可知,随着Mn、Cu含量的增加,催化剂的比表面积、孔容积呈现下降趋势。孔径变化不大,这可能归因于 Mn、Cu含量变化导致的孔结构的差异。
2.1.2 XRD分析 图2是aMn-bCu/Y催化剂的XRD图。
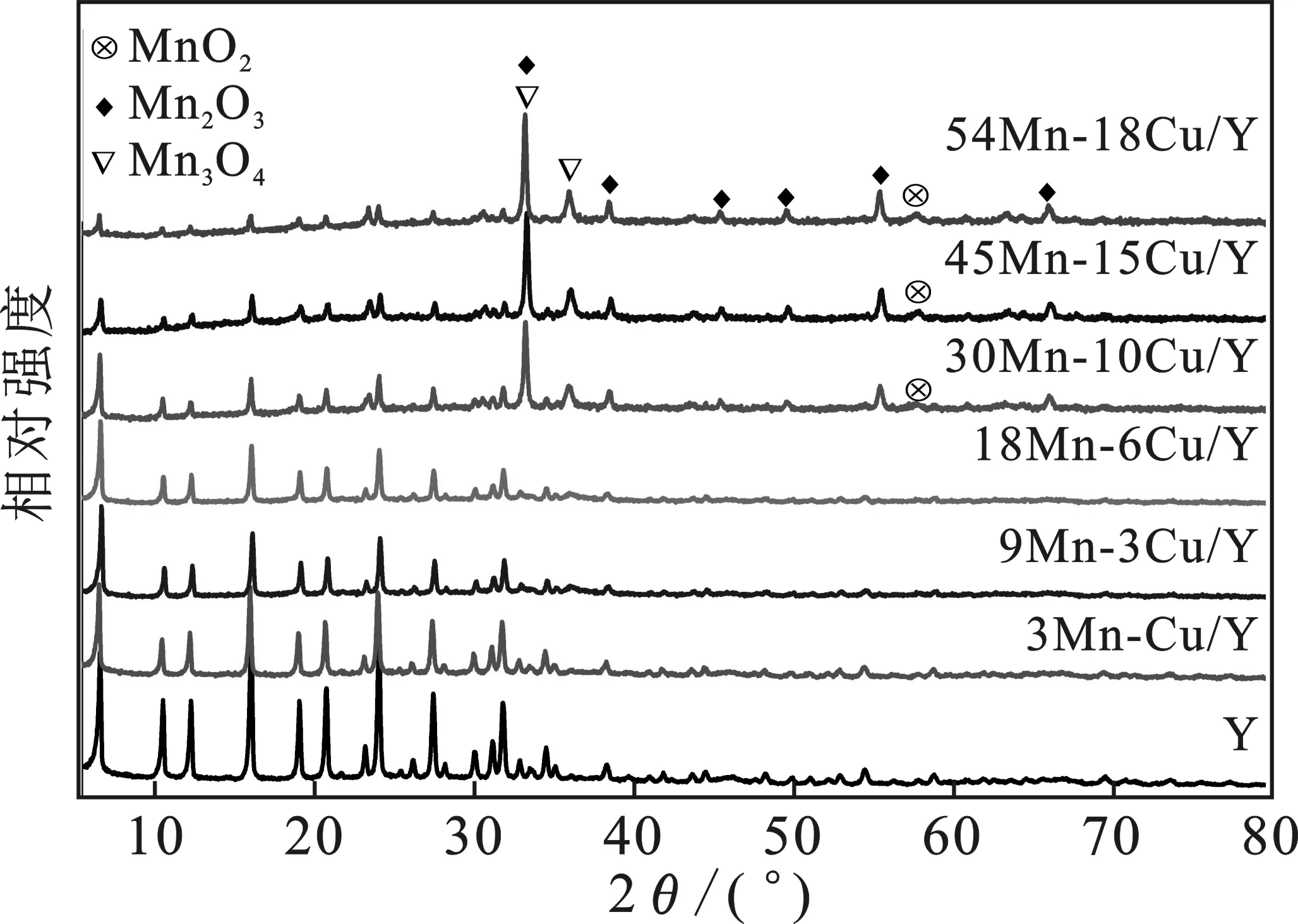
图2 aMn-bCu/Y催化剂的XRD图Fig.2 XRD patterns of aMn-bCu/Y catalysts
由图2可知,所有样品均能观察到位于2θ=6.2,10.2,11.9,15.7,18.7,20.4,23.7,27.1,31.4°的多重峰(依据JCPDs),这些是典型的Y分子筛的衍射峰[9]。随着Mn、Cu含量的增加,Y分子筛特征峰的强度逐渐减弱。值得注意的是,当Mn、Cu含量分别增加到30%和10%时,30Mn-10Cu/Y催化剂的谱图上开始出现明显的Mn3O4(JCPD No.24-0734)、Mn2O3(JCPD No.41-1442)和MnO2(JCPD No.24-0735)的特征峰[10],表明Mn3O4、Mn2O3和MnO2的结晶相开始形成。继续增加Mn、Cu含量,45Mn-15Cu/Y和54Mn-18Cu/Y催化剂谱图上三种Mn氧化物的衍射峰强度继续增高,表明有更多的结晶相形成。相比之下,当Mn、Cu含量分别低于18%和6%时,未观察到任何Mn氧化物的特征衍射峰,表明MnOx物种在催化剂表面高度分散[11]。此外,所有的样品都没有检测出Cu物种的衍射峰,这是由于它们较小的颗粒尺寸或者较低的浓度未达到XRD的检测范围。
2.1.3 NH3-TPD分析 众所周知,酸性位对催化氧化反应的活性有很大影响[12],催化剂的酸性质可以通过NH3-TPD的方法进行探测。图3呈现的是aMn-bCu/Y催化剂的NH3-TPD图。

图3 aMn-bCu/Y催化剂的NH3-TPD图Fig.3 NH3-TPD of aMn-bCu/Y catalysts
由图3可知,Y分子筛的脱附曲线包含中心在200~210 ℃和350~370 ℃的两个脱附峰,分别对应弱酸(或中强酸)和强酸位点,这归因于Y分子筛中的L酸(路易斯酸)和B酸(布朗特斯酸)中心[13]。在引入Mn、Cu组分后,催化剂的NH3脱附曲线形状发生明显变化。这些曲线包含一个中心在180~200 ℃的宽脱附峰,同时携带一个肩峰(260~300 ℃),另外还有一个高温峰(>350 ℃),分别对应催化剂表面的弱酸、中强酸和强酸位点[14]。有关酸强度分布的半定量比较概括在表2中,这些结果是通过高斯函数拟合 NH3-TPD 曲线所获得。
表2 NH3-TPD测试的半定量结果Table 2 Half-quantitative analysis of NH3-TPD

2.1.4 H2-TPR分析 H2-TPR测试结果见图4。
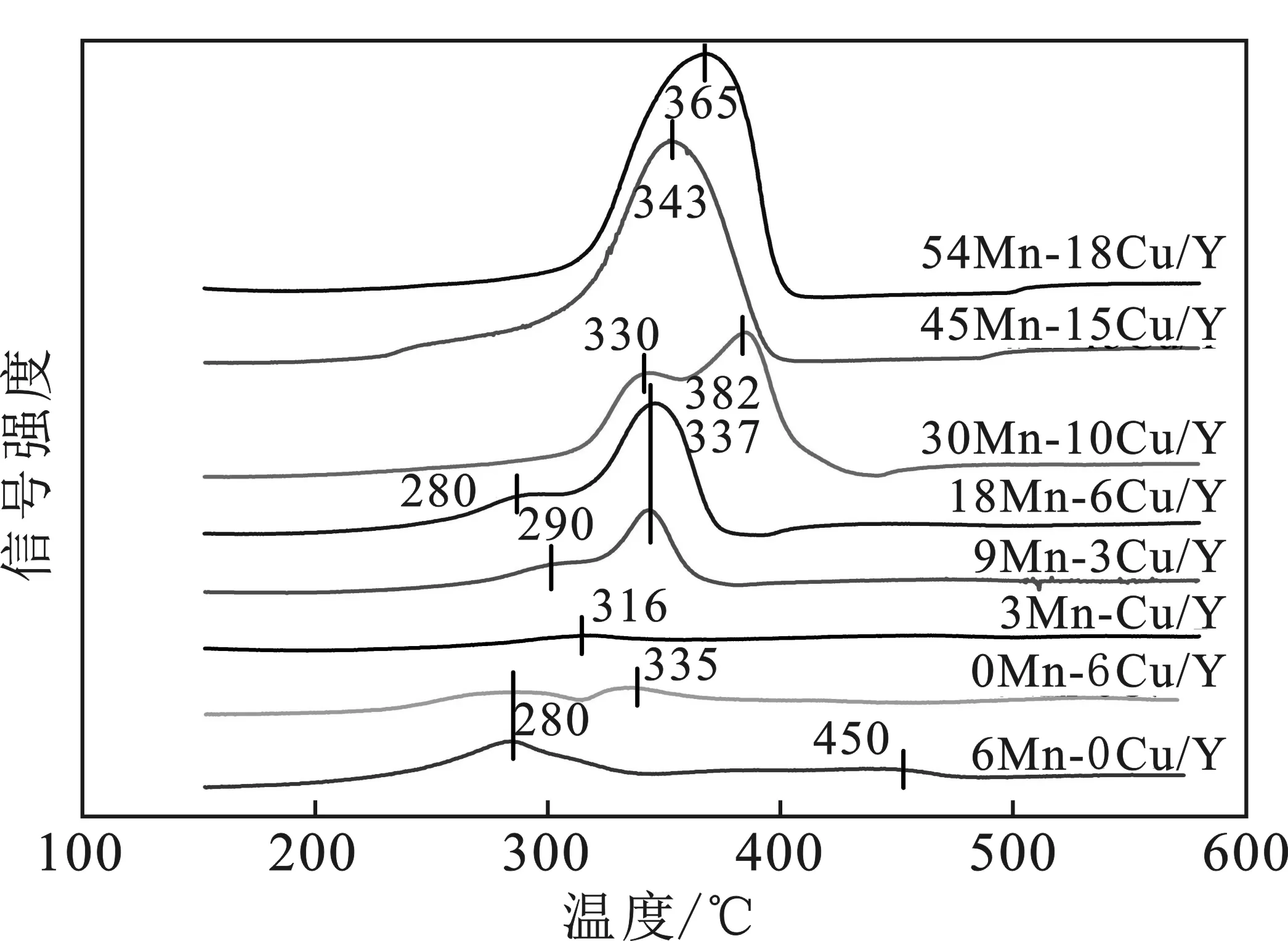
图4 aMn-bCu催化剂的H2-TPR图Fig.4 H2-TPR of aMn-bCu/Y catalysts
由图4可知,引入单一Mn组分的6Mn-0Cu催化剂在~280 ℃和~450 ℃的位置出现了两个宽的还原峰,分别对应MnO2→Mn2O3→Mn3O4和Mn3O4→MnO的还原[14]。引入单一Cu组分的0Mn-6Cu/Y催化剂,呈现两个不明显的还原峰在~280 ℃和 ~335 ℃,低温峰归因于高度分散的表面Cu氧化物种的还原,而高温峰则是较难还原的团聚的CuO块还原所致[16]。引入Mn、Cu双组分后,随着含量的增加(Mn 3%→54%,Cu 1%→18%),H2消耗峰的面积显著升高。3Mn-Cu/Y催化剂上未观察到明显的H2消耗峰,这是Mn、Cu组分负载量过低所致。继续增加Mn、Cu含量(Mn质量含量≤18%、Cu质量含量≤6%),9Mn-3Cu/Y和18Mn-6Cu/Y催化剂都呈现两个明显的还原峰,主要归属于MnOx的还原,而Cu氧化物(Cu质量含量≤6%)的还原对峰的贡献很小。值得注意的是,相比于6Mn-0Cu/Y催化剂,上述两催化剂的还原峰整体向低温方向移动,其中18Mn-6Cu/Y催化剂拥有最低的还原温度,这说明Cu的加入,一方面促进了MnOx颗粒的高度分散,这与XRD分析结果一致;另一方面提高了Cu、Mn氧化物种的还原能力,从而催化剂的氧化还原能力得以提升,这对催化氧化反应是有利的[17]。进一步增加Mn、Cu含量,还原峰开始向高温方向移动,这归因于含量升高带来金属氧化物发生的团聚,致使氧化物种分散度下降。当Mn质量含量 ≥45%、Cu质量含量≥15%时,Cu、Mn氧化物共还原发生,所有还原峰发生重叠,同时向相对高的温度方向移动,这意味着催化剂上晶格氧的流动性变差,会导致催化活性的下降[18-19]。此外,所有双组分催化剂中,18Mn-6Cu/Y和9Mn-3Cu/Y催化剂拥有相对较强的两个低温峰,这说明催化剂上更多的MnO2被还原。
2.1.5 XPS分析 为了得到aMn-bCu/Y催化剂表面的元素信息和Mn的氧化价态,对四个典型催化剂的Mn 2p3/2进行XPS光谱分析,结果见图5,XPS结果列于表3。
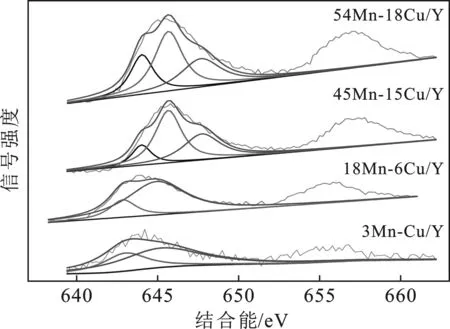
图5 aMn-bCu/Y催化剂的Mn 2p3/2 XPS光谱图Fig.5 Mn 2p3/2 XPS spectra of aMn-bCu/Y catalysts
由图5可知,就3Mn-Cu/Y而言,有两个峰位于643.3 eV和646.1 eV,分别代表Mn3+和Mn4+[20]。相比之下,18Mn-6Cu/Y催化剂也呈现相似的光谱形状,但Mn 2p3/2结合能变小,这意味着该含量的催化剂拥有更强的Mn-Cu相互作用,催化剂稳定性更好[21]。当Mn、Cu含量继续增加,45Mn-15Cu/Y和54Mn-18Cu/Y催化剂的XPS光谱均呈现三个峰,结合能在~643.5 eV、646.2 eV和647.5 eV,分别归属于Mn2+、Mn3+和Mn4+物种[22]。相比于低Mn、Cu含量的催化剂,45Mn-15Cu/Y和54Mn-18Cu/Y催化剂上Mn 2p3/2结合能显著增大,同时新增Mn2+物种,证明了MnO的存在,这与XRD分析中出现MnO结晶相的结果一致。研究表明,MnO2是储存和释放O的“蓄氧池”,Mn2O3调节着催化剂和甲苯之间的O转移[23],MnO2和Mn2O3中的O相比于MnO更容易被氧化成氧自由基(晶格氧O2-),从而在VOCs和氧自由基之间提供更高的反应活性,致使氧化反应中VOCs去除率提高[24-25]。

表3 aMn-bCu/Y催化剂的XPS结果Table 3 XPS results of aMn-bCu/Y catalysts
由表3可知,所有催化剂中,18Mn-6Cu/Y催化剂表面呈现最高的Mn4+比例(Mn4+/( Mn4++Mn3++Mn2+)=79.8%),对应TPR结果中相对较强的MnO2还原峰。低含量催化剂表面Mn全部以Mn4+和Mn3+存在,不存在Mn2+形式。
2.2 常温甲苯脱除性能评价
反应条件:常温,气相空速GHSV=10 000 h-1,甲苯500 mg/L,O3/甲苯摩尔比=10时,aMn-bCu/Y催化剂协同臭氧处理甲苯的性能见图6和表4。
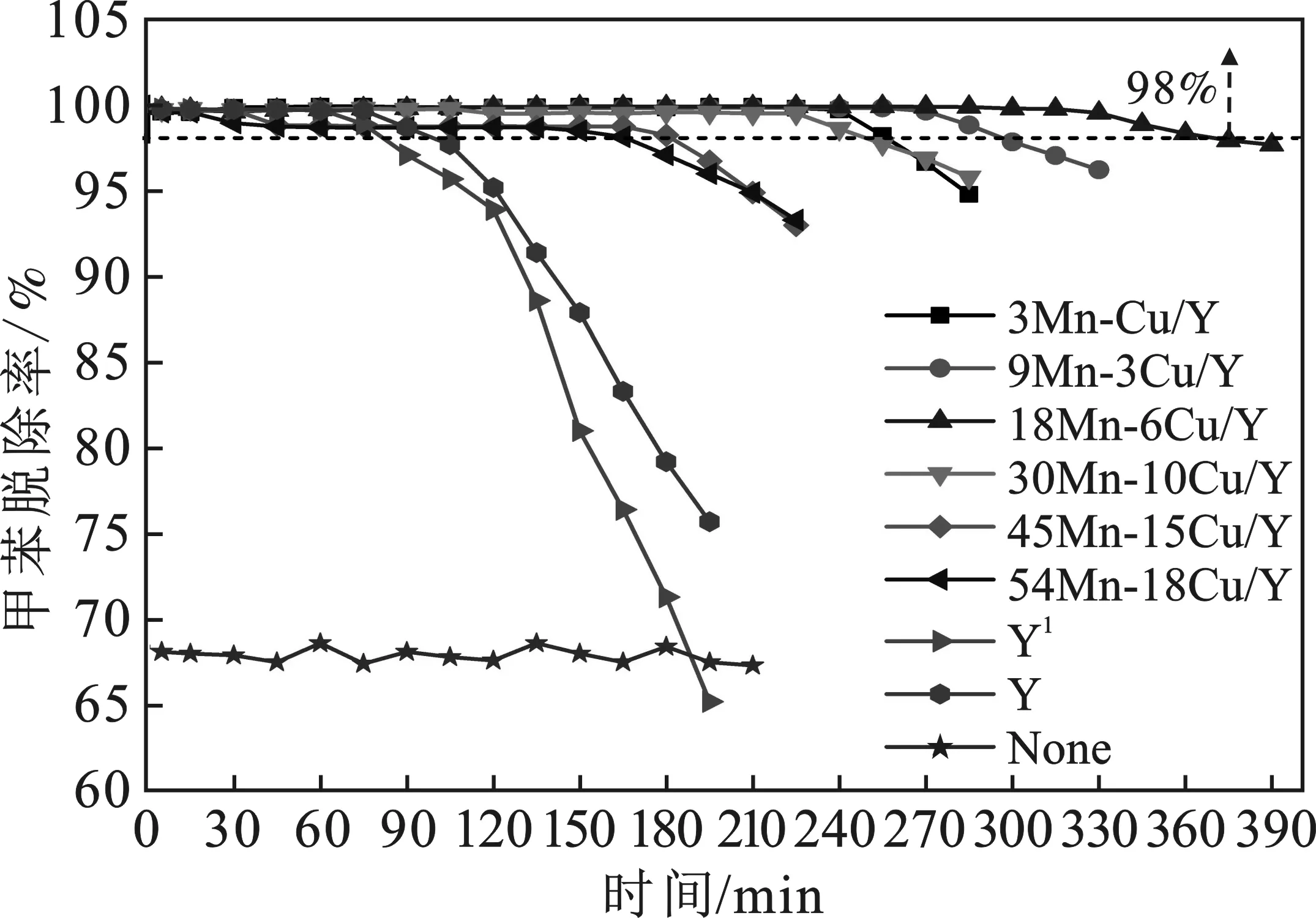
图6 aMn-bCu/Y催化剂协同臭氧处理甲苯转化率Fig.6 Removal efficiency of toluene with ozone catalytic oxidation of various aMn-bCu/Y catalysts

表4 aMn-bCu/Y催化剂协同臭氧处理甲苯性能Table 4 Removal properties of toluene of various aMn-bCu/Y catalysts
由表4可知,单独O3作用,甲苯转化率可维持在68%左右,但CO2选择性极低,仅达11.6%,说明单独臭氧作用下部分甲苯可发生断键,转化为非甲苯类物质,但断键后仅有极少部分可彻底降解为CO2。单独Y作用下,初始阶段可实现对甲苯完全脱除,t98达65 min,但其CO2选择性为0,说明其对甲苯无任何催化作用,甲苯脱除性能归因于其吸附能力。在臭氧作用的基础上,再引入Y共同作用,甲苯脱除性能提升不大,t98为70 min,而CO2选择性几乎未发生变化。纯Y分子筛对臭氧氧化甲苯无任何催化促进作用。
臭氧存在下,aMn-bCu/Y体系对甲苯均具有较好的降解能力。由图6可知,所有催化剂中,18Mn-6Cu/Y拥有最高且最稳定的催化活性,反应初始阶段一直维持较高的甲苯转化率(>99.5%),在反应315 min之后,活性开始下降。在协同臭氧常温处理甲苯反应中,催化活性仅次于18Mn-6Cu/Y的是9Mn-3Cu/Y催化剂。而45Mn-15Cu/Y和54Mn-18Cu/Y催化剂则呈现最低的催化活性,参与反应30 min后,活性便有所下降,甲苯转化率降至 98.5%,随后在反应165 min后出现快速失活。由表4可知,aMn-bCu/Y催化剂上,甲苯脱除性能t98从高到低依次为:18Mn-6Cu/Y(370 min)>9Mn-3Cu/Y (300 min)>3Mn-Cu/Y(255 min)>30Mn-10Cu/Y(250 min)>45Mn-15Cu/Y(185 min)>54Mn-18Cu/Y(170 min)。随着Mn、Cu含量的增加,催化剂处理甲苯反应6 h后,CO2选择性的高低变化规律与t98变化规律一致,18Mn-6Cu/Y催化剂拥有最高的CO2选择性(82.1%)。此外,T100与t98也呈现相似的高低变化规律,表明催化剂的臭氧分解活性与其催化甲苯降解能力存在一定的相关性,这与文献[7]报道的一致。
2.3 催化剂结构与性能之间的关系
aMn-bCu/Y催化剂上甲苯脱除性能的差异可以这样解释:首先,根据表1中的物理结构参数,随着Mn、Cu含量的增加,催化剂的比表面积和孔容积均逐渐减小,45Mn-15Cu/Y和54Mn-18Cu/Y催化剂呈现相对最小的比表面积和孔容积,导致其吸附甲苯能力较差,而aMn-bCu/Y催化剂催化氧化甲苯反应初期吸附能力是决定催化活性高低的重要因素。其次,XRD分析表明,Mn、Cu质量含量分别增加到30%和10%以上时,催化剂上可以观察到明显的MnOx结晶相,而低含量(Mn质量含量≤18%,Cu质量含量≤6%时)的催化剂则只呈现Y分子筛的衍射峰,说明Mn氧化物种高度分散,从而可以形成更多的反应活性位。再者,催化剂的酸性质分析显示,18Mn-6Cu/Y催化剂样品拥有最高的弱酸和中强酸比例,可以提供最多的催化氧化反应活性位。此外,H2-TPR分析表明,18Mn-6Cu/Y和9Mn-3Cu/Y催化剂拥有相对好的氧化还原反应能力,此两种催化剂上晶格氧流动性好。同时,还揭示了18Mn-6Cu/Y催化剂上有更多的MnO2物种形成,与XPS分析中催化剂表面最高的Mn4+比例这一结果相一致。所有表征结果充分说明了18Mn-6Cu/Y催化剂拥有最好的甲苯脱除性能的原因。
3 结论
本文以Y分子筛为载体,通过浸渍法制备了不同活性组分含量的aMn-bCu/Y催化剂,经过一系列表征及其协同臭氧处理甲苯反应测试,得出如下结论:
(1)活性组分含量可以显著影响aMn-bCu/Y催化剂的结构性质及其协同臭氧处理甲苯的催化氧化性能。
(2)18Mn-6Cu/Y催化剂(Mn、Cu质量含量分别为18%,6%)拥有高度分散的MnOx物种、最高的弱酸和中强酸比例(84.7%)、最佳的氧化还原反应能力、良好的晶格氧流动性和最高的Mn4+比例。
(3)18Mn-6Cu/Y催化剂呈现最好的催化性能,协同臭氧处理甲苯反应6 h后,拥有最高的甲苯转化率(98%)和CO2选择性(82.1%);过高或过低的Mn、Cu质量含量,均会导致催化剂催化氧化性能的下降。

