转Cry1Ab-ma基因玉米对大鼠的亚慢性毒性研究
王瑶 卢佳希 胡贻椿 王睿 吴文璇 毛德倩 陈竞 李卫东 杨丽琛 李敏

摘 要:目的:研究转Cry1Ab-ma基因玉米对大鼠的亚慢性毒性。方法:初断乳Wistar大鼠140只,随机分为7组:转基因玉米高中低3个剂量组(60%、30%、15%)、亲本玉米高中低3个剂量组(60%、30%、15%)以及1个常规基础饲料对照组,每组20只,雌雄各半。动物2只1笼喂养,自由进食饮水,连续观察90 d。每周称量饲料量及大鼠体重,在试验中、末期采集大鼠尿液和血液进行尿常规、血常规和血生化分析。实验末期称重脏器并计算脏器体重比,最后对大鼠脏器进行病理组织学检查。实验末期称重脏器并计算脏器体重比,最后对大鼠脏器进行病理组织学检查。结果:90 d的实验期内,各组大鼠均未发现中毒死亡情况。转基因玉米组个别评价指标虽与亲本玉米对照组或常规基础饲料对照组存在统计学差异,但指标水平在文献报道正常范围和历史对照范围内,且均未发现有生物学意义的改变。各受检脏器未见与受试物相关的病理改变。结论:现有实验结果不能证实转Cry1Ab-ma基因玉米对大鼠有亚慢性毒性作用。
关键词:转基因玉米;Cry1Ab-ma;亚慢性毒性
玉米螟是玉米等作物的主要世界性害虫。中国是亚洲玉米螟的多发区和重发区,玉米螟除直接造成玉米产量损失外,其造成的伤口危害是玉米穗腐病等病原菌入侵的途径,并且害虫本身常携带病原菌,从而诱发和加重玉米穗腐病的发生。籽粒中产生的真菌毒素,使玉米品质下降。苏云金芽孢杆菌(简称Bt)的杀虫晶体蛋白对不同昆虫(如鳞翅目、鞘翅目、双翅目等)和无脊椎动物(如寄生线虫、原生动物等)有特异毒杀作用。针对玉米螟虫危害,将抗虫基因导入玉米品种中,进而提高转基因玉米的抗虫性,可显著降低玉米螟防治成本,节省人力、物力及社会资源。CM8101转基因玉米是将防治鳞翅目玉米螟虫的Cry1Ab-ma基因(编码Bt杀虫蛋白的一種基因)插入亲本玉米郑58后培育的一种抗虫转基因玉米。本实验依据转基因产品食用安全性评价中的“实质等同性”原则[1],按照中华人民共和国农业行业标准(NY/T1102-2006)《转基因植物及其产品食用安全检测大鼠90 d喂养实验》[2]进行剂量组设计及实验中期指标测定,依据新修订的(农业农村部公告第323号-27-2020)《转基因植物及其产品食用安全检测大鼠90 d喂养实验》[3]进行实验末期指标检测,对转CM8101基因玉米开展大鼠90 d喂养实验,评价该转基因玉米是否会对大鼠产生亚慢性毒性作用,为该转基因玉米的食用和饲用安全性提供科学依据。
1 材料与方法
1.1 材料
转Cry1Ab-ma基因玉米(以下简称转基因玉米)和亲本对照玉米郑58(以下简称非转基因玉米),黄色籽粒,由中国农业科学院作物科学研究所提供,于-20℃保存。对转基因玉米身份验证后开展本次实验。
1.2 实验动物和饲养条件
140只断乳SPF级Wistar大鼠购自斯贝福(北京)生物技术有限公司,生产许可证号:SCXK(京)2019-0010。雌雄各半,体重60~80 g。在中国疾病预防控制中心屏障级动物房中进行,许可证号:SCXK(京)2019-0050。环境温度20~23℃,相对湿度40%~70%,12 h人工照明/黑暗循环,换气次数≥15次/h。大鼠2只1笼饲养,自由饮食饮水,动物饲养管理和动物实验操作符合《北京市实验动物管理条例》。
1.3 饲料配制
根据玉米营养成分结果,将转基因玉米与非转基玉米分别按照60%、30%、15%的比例添加到饲料中,高剂量组按照玉米最大量掺入饲料为原则,生长饲料以AIN-93G饲料配方为参照,供大鼠第1个月食用;第2个月和第3个月的维持饲料以AIN-93M配方为参照,饲料达到实验动物营养标准。饲料加工成颗粒状,经60Co辐射灭菌,达到清洁级水平。
1.4 方法
选用断乳Wistar大鼠140只,随机分为7组:转基因玉米高、中、低剂量组(以下简称A1、A2、A3),非转基因玉米高、中、低剂量组(以下简称B1、B2、B3)和AIN常规基础饲料对照组(以下简称E),每组20只,雌雄各半。每周记录1次给食量和剩食量,连续观察90 d。各组于实验中期和实验结束分别采血测定血常规、血生化指标;实验结束前进行尿常规检查;动物宰杀后进行大体解剖和脏器称重,并摘取动物脏器进行病理组织学检查。
1.5 观察指标
1.5.1 一般临床观察 实验期间每天至少进行1次动物临床表现的一般观察,观察内容包括被毛、皮肤、眼、粘膜、分泌物、排泄物、呼吸系统、神经系统、自主活动及行为表现。实验前与实验结束时对转基因玉米和非转基因玉米高剂量组以及常规基础饲料对照组大鼠进行眼部(角膜、晶状体、球结膜、虹膜)检查。
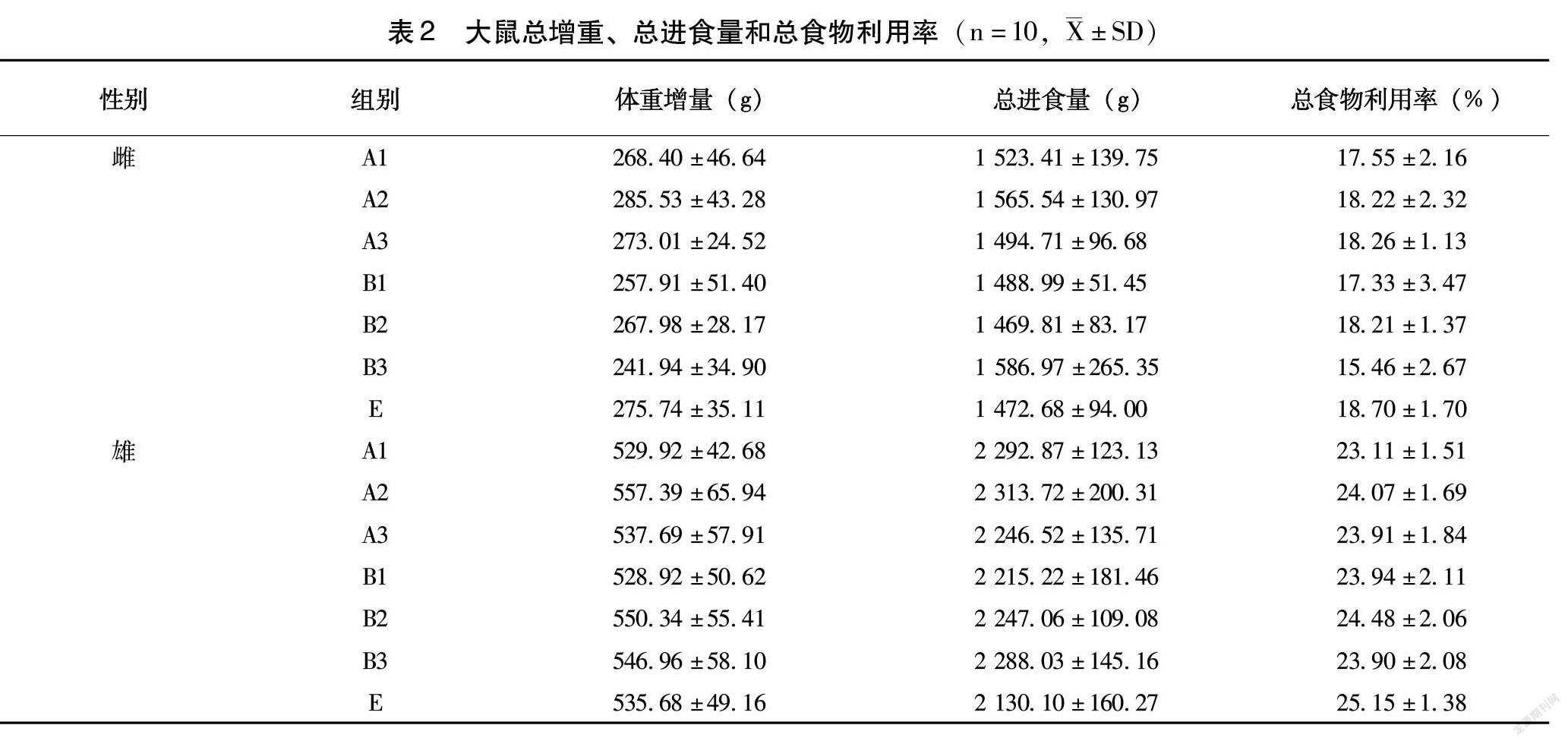
1.5.2 体重和摄食量 每周记录体重、摄食量,计算食物利用率;实验结束时,计算动物体重总增长量、总摄食量和总食物利用率。
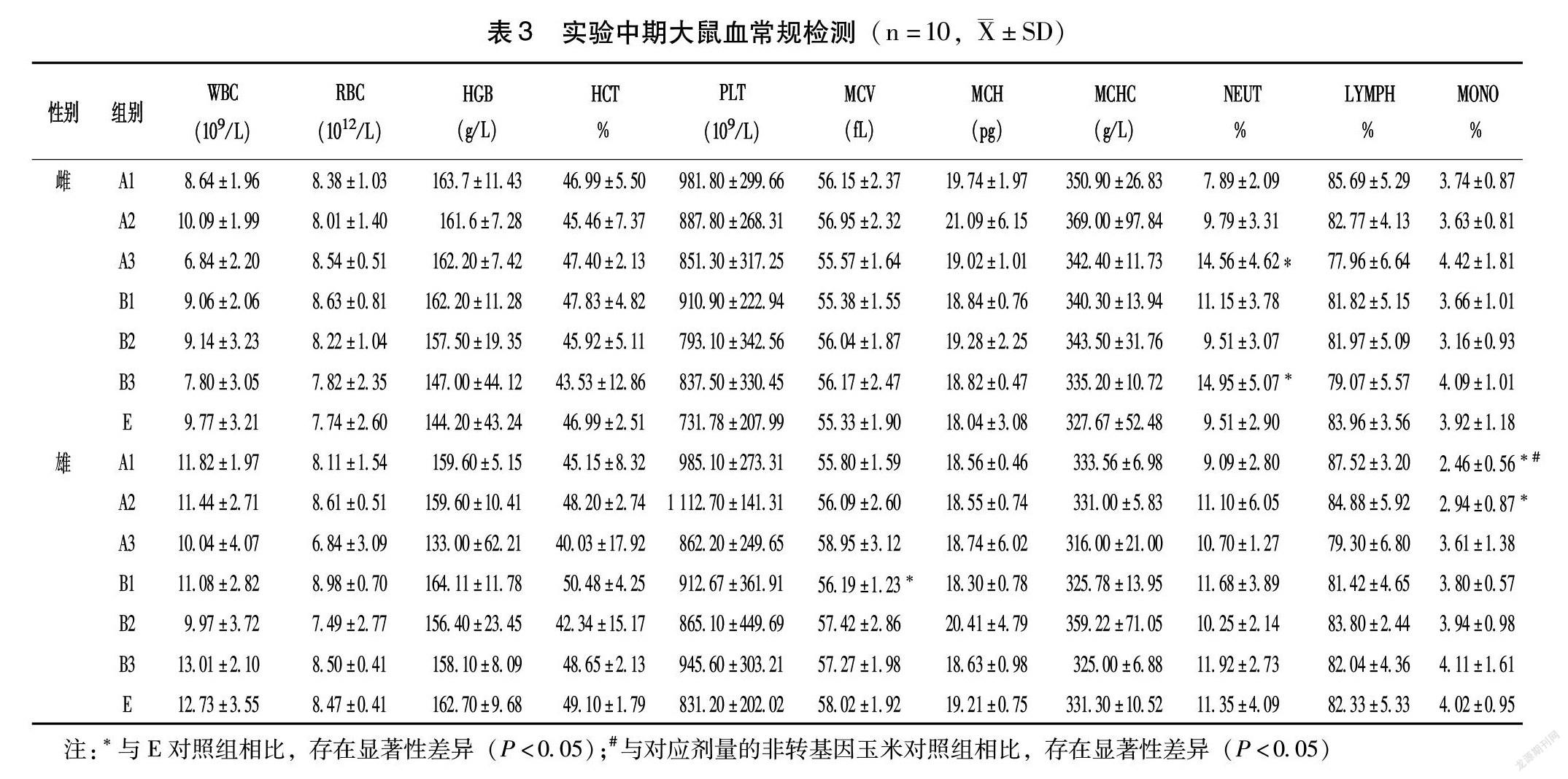
1.5.3 血常规 实验中期和实验结束时进行血液学指标测定,测定指标为白细胞计数(WBC)、红细胞计数(RBC)、血红蛋白浓度(HGB)、红细胞压积(HCT)、血小板计数(PLT)、平均红细胞容积(MCV)、平均红细胞血红蛋白含量(MCH)、平均红细胞血红蛋白浓度(MCHC)、中性粒细胞比例(NEUT%)、淋巴细胞比例(LYMPH%)和单核细胞比例(MONO%)。实验末期增加凝血指标凝血酶原时间(PT)和活化部分凝血活酶时间(APTT)的测定。实验中期大鼠眼内眦取血,实验末期大鼠腹主动脉采血。
1.5.4 血生化 实验中期和实验结束时进行血液生化指标测定,空腹采血,测定指标为丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)、碱性磷酸酶(ALP)、尿素氮(BUN)、肌酐(CRE)、血糖(GLU)、总蛋白(TP)、白蛋白(ALB)、总胆固醇(TC)、甘油三酯(TG);中期增加乳酸脱氢酶(LDH)指标的测定;末期增加氯(Cl)、钾(K)、钠(Na)指标的测定。90D8E3CE-2707-447F-888A-3C208D158891
1.5.5 尿液检查 实验动物在实验结束时进行尿液常规检查,包括外观、尿蛋白、尿比重、pH、酮体、葡萄糖和潜血。
1.5.6 大体解剖和脏器称重 实验结束,对所有动物进行大体检查,包括体表、颅腔、胸腔、腹腔及其脏器,并称量脑、心脏、胸腺、肾上腺、肝、肾、脾、睾丸、附睾、子宫和卵巢的绝对重量,计算脏器与体重的相对重量(脏/体比值)。
1.5.7 组织病理学 实验结束时,对转基因玉米高剂量组(A1)、非转基因玉米高剂量对照组(B1)、常规基础饲料对照组(E)进行脏器组织病理学检查,若发现与受试物相关病变,再对中低剂量组相应器官及组织进行检查。检查脏器包括脑、垂体、甲状腺、胸腺、肺、心脏、肝、脾、肾、肾上腺、胃、十二指肠、空肠、回肠、结肠、盲肠、直肠、胰、肠系膜淋巴结、卵巢、子宫、睾丸、附睾、前列腺、膀胱等。
1.6 统计方法
数据以平均值±标准差的形式表示。多组间比较采用方差齐性检验,如果方差齐,进行单因素方差分析;如果方差不齐,进行非参数检验。各剂量转基因玉米组分别与对应剂量的非转基因玉米组、常规基础饲料对照组进行比较,以P<0.05判定为存在显著性差异。
2 结果与分析
2.1 临床观察结果
在90 d的实验期内,各组大鼠均未发现中毒死亡情况。大鼠状态正常,无异常状况发生。实验前与实验结束时,对转基因玉米和非转基因玉米高剂量组以及常规基础饲料对照组大鼠进行眼部检查,未发现异常变化。
2.2 生长状况及食物利用率
雌雄各组大鼠体重均呈现稳定增长趋势,个别时间点转基因玉米组大鼠体重与对应剂量的非转基因玉米对照组或常规基础饲料对照组存在显著差异(表1)。但转基因玉米组大鼠总增重、总进食量和总食物利用率与常规基础饲料对照组和对应剂量的非转基因玉米对照组相比,均不存在显著性差异(表2)。
2.3 血常规和血生化指标
实验中期与实验末期大鼠转基因玉米组血常规和血生化个别指标,与对应剂量非转基因玉米组或常规基础饲料对照组有显著统计学差异,但指标水平在文献报道的正常范围[4-9]和历史对照范围内,因此饲喂大鼠含有抗虫转基因玉米饲料90 d后,未发现对大鼠血常规和血生化指标产生不良影响(表3~6)。
2.4 尿液指标
尿液指标中外观颜色正常且各组酮体指标均为阴性,其余指标见表7。与E对照组相比,雄性大鼠转基因玉米A1、A2和A3组尿蛋白和潜血指标有显著差异,雌性大鼠A2组和A3组尿潜血也有显著差异,上述指标均与对应剂量的非转基因玉米对照组无显著差异。与对应剂量的非转基因玉米对照组相比,雄性大鼠转基因玉米A2組尿pH值有显著差异,与E对照组没有显著差异。其他指标各组之间均无显著差异。
综上所述,饲喂大鼠含有转基因玉米的饲料后,未发现对大鼠尿液产生不良影响。
2.5 大鼠脏器比
实验末期对各组大鼠的脏器重量称重,并计算脏体比,结果表明,各组之间脏体比均不存在显著差异(P>0.05)(表8)。
2.6 大体病理及组织学检查
对转基因玉米高剂量组(A1)、非转基因玉米高剂量对照组(B1)、常规基础饲料对照组(E)采集的大鼠脏器组织进行病理学检查,结果表明,大鼠各组动物均出现肝脏脂肪变性,A1组大鼠肝脏脂肪变性程度低于E对照组,高于B1对照组。其余各受检脏器未见与受试物相关的病理改变。
3 讨论
自1996年第一个转基因玉米在美国获得商业化许可种植以来,转基因玉米育种从基因转化、基因整合、标记筛选、产品检测到害虫抗性管理等已建立了比较完整的理论和技术体系。转基因食品安全性评价主要遵循“实质等同性”原则和“个案分析”原则,在原有食品安全评价基础之上,近年来制订或修订了一些法规和标准,针对转基因产品的安全性进行评价,以进一步发展和完善评价相关标准。本研究依据现行的转基因产品安全评价标准,采用实验动物模型,从毒理学方面对抗虫转基因玉米CM8101开展亚慢性毒性评价,研究结果表明,在各项检测指标中,存在转基因玉米组个别评价指标与对应剂量的非转基因玉米组或常规基础饲料对照组有显著差异的情况,但大部分差异指标仅仅与其中一个对照组存在差异,即使与对应剂量的非转基因玉米组和常规基础饲料对照组同时存在差异,其指标检测值也在文献报道范围和历史对照范围内,且未出现剂量-反应关系,这一现象普遍存在于转基因产品亚慢性毒性评价实验中[10-12]。因此认为,这些差异在实验大鼠中存在自发现象,可能与大鼠个体差异和动物实验中的一些不确定因素有关,不认为指标的改变是因饲喂转基因玉米饲料造成的。组织病理检查发现各组动物均出现肝脏脂肪变性,其中常规基础饲料对照组动物肝脏脂肪变性程度高于其他组,因此考虑各组出现的肝脏脂肪变性与动物体重普遍超重有关。其余受检脏器未见组间显著性差异。
综上所述,抗虫转基因玉米CM8101以60%、30%和15%的比例掺入饲料喂饲大鼠90 d,各组大鼠均未发现明显中毒症状,无中毒死亡情况发生。未观察到抗虫转基因玉米CM8101在实验期内对大鼠体重、进食量、食物利用率、血常规、凝血、血生化、尿常规、脏器重量、脏体比和组织病理学检查结果有不良影响。对该转基因玉米的食用和饲用安全性评价尚需开展更多的实验进行全面评估。
参考文献
[1]WH0.Applicationof the principles of substantial equivalenceto the safety evaluation of food components from plants derived by modern biotechnology [R].Geneva:WH0,1995(11).90D8E3CE-2707-447F-888A-3C208D158891
[2]中華人民共和国农业行业标准.转基因植物及其产品食用安全检测—大鼠90 d喂养实验[S].北京:中华人民共和国农业农村部,2006.
[3]中华人民共和国国家标准.转基因植物及其产品食用安全检测—大鼠90 d喂养实验[S].北京:中华人民共和国农业农村部,2020.
[4]郭建生,胡还莆,郭璇.Wistar大鼠血液生化指标正常参考值范围的研究[J].中医药导报,2008,14(12):7-8.
[5]曹丽歌,蒋雪云,田蜜,等.不同取血方法和动静脉血对Wistar大鼠生化指标的影响[J].中国食品卫生杂志,2016,28(1):44-47.
[6]田辉,樊柏林,刘瑶,等.SPF级Wistar大鼠血液学及血生化指标正常值范围探讨[J].实验动物科学,2007,24(2):1-4.
[7]樊军,秦俊,刘春霞,等.建立Wistar大鼠血液及生化指标正常参考值范围的探讨[J].公共卫生与预防医学,2010,21(6):50-52.
[8]王燕,厉彦翔.Wistar大鼠血液生化指标、体重及主要脏器系数参考值的研究[J].中国民族民间医药,2011,20(23):9-10.
[9]钱江,黎福荣,唐彬,等.不同月龄SPF级Wistar大鼠血液学及生化学指标正常值范围探讨[J].动物医学进展,2018,39(2):79-83.
[10]王睿,张艳红,胡贻椿,等.转C0030.2.5 基因玉米对大鼠的亚慢性毒性研究[J].中国食物与营养,2019,25(8):38-43.
[11]王睿,胡贻椿,李敏,等.转DBN9978基因抗虫抗除草剂玉米对大鼠的亚慢性毒性研究[J].中国食物与营养,2017,23(6):12-17.
[12]刘英华,姜淑卿,张静,等.转cp4epsps基因抗除草剂玉米MON87427对Wistar大鼠亚慢性毒性[J].公共卫生与预防医学,2018,29(6):17-20.
Subchronic Toxicity Test of Genetically Modified Corn with Cry1Ab-ma Gene in Rats
WANG Yao,LU Jia-xi,HU Yi-chun,WANG Rui,WU Wen-xuan,MAO De-qian,CHEN Jing,LI Wei-dong,YANG Li-chen,LI Min
(National Institute of Nutrition and Health,Chinese Center for Disease Control and Prevention/ Key Laboratory of Trace Elements and Nutrition of National Health Commission,Beijing 100050,China)
Abstract:Objective To study the subchronic toxicity of genetically modified corn with Cry1Ab-ma gene in rats.Method A total of 140 first weaned Wistar rats were randomly divided into seven groups including high,medium and low doses of genetically modified corn groups(60%,30%,15%).High,medium and low doses of parental corn groups(60%,30%,15%)and a routine basal diet control group.Each group with 20 rats and half male and half female,two animals were fed in one cage,and they were free to eat and drink for 90 days of continuous observation.Food intake and body weight of each group were recorded every week.Blood and urine were collected at the middle and end of the experiment to determine hematology,blood biochemical index and routine urine index.At the end of the experiment,the organs were weighed,the organ/weight ratio was calculated,and the organs were analyzed histopathology.Result During the 90 day test period,no rat in each group died due to poisoning.Although only a few indicators of the genetically modified corn group were statistically different from the parental corn control group or the routine basal diet control group,the indicator levels were within the normal range that reported in the literature and the historical control range,and no biologically significant changes were found.There were no pathological changes related to the test substance in the examined organs.Conclusion The existing test results cannot confirm that genetically modified corn with Cry1Ab-ma gene has subchronic toxicity to rats.
Keywords:genetically modified corn; Cry1Ab-ma;subchronic toxicity90D8E3CE-2707-447F-888A-3C208D158891

