基于前列腺逐层切片病理PI-RADS v2.1与PI-RADS v2的评分比较
王慧慧,高歌,何群,沈棋,王鹤,王霄英*
作者单位:1.北京大学第一医院医学影像科,北京 100034;2.北京大学第一医院泌尿外科/北京大学泌尿外科研究所,北京 100034
前列腺癌居全球男性恶性肿瘤发病率的第二位,居男性癌症死亡原因的第五位。近年来我国前列腺癌的发病率和死亡率上升趋势明显,疾病负担日益加重[1-3]。多参数磁共振成像(multiparametric magnetic resonance imaging,mpMRI)作为无创性影像学检查方法,对前列腺癌的诊断、分期及随访有重要作用。前列腺影像报告和数据系统(prostate imaging reporting and data system,PI-RADS)作为前列腺MRI技术规范、诊断标准和结构式报告的重要指南,在日常临床工作中已广泛应用,且其临床价值已得到充分验证,但仍存在读片一致性中等的问题[4-5]。2019年发布的PI-RADS v2.1在既往PI-RADS v2的基础上进行了修改,在诊断方面主要的更新点是修改移行带整体评分标准及移行带T2加权成像(T2 weighted imaging,T2WI)1分和2分的诊断标准、变更扩散加权成像(diffusion weighted imaging,DWI) 2 分和3 分的诊断标准及动态对比增强(dynamic contrast enhanced,DCE)的阴性标准[6-8]。Linhares Moreira等[9]研究认为对比PI-RADS v2,PI-RADS v2.1的主要变化为移行带病灶评分由原来的2分降为1分,而最终的MRI阳性和阴性病灶数量并没有明显变化。Lee 等[10]研究认为PI-RADS v2.1 与PI-RADS v2的诊断效能差异无统计学意义。国内学者[11]以穿刺病理为金标准,认为PI-RADS v2.1对临床显著癌具有较高的诊断价值。PI-RADS v2.1在本单位的应用时间较短,对临床决策的影响尚不清晰,因此本研究旨在以前列腺逐层切片病理为金标准,分析PI-RADS v2.1与v2对前列腺临床显著癌的评分变化。
1 材料与方法
1.1 研究对象
本研究经北京大学第一医院临床研究伦理委员会批准(批准文号:2021 研060),免除受试者知情同意。回顾性分析2012 年11 月至2017 年7 月前列腺mpMRI 患者资料。纳入标准:(1)因前列腺特异抗原(prostate specific antigen,PSA)升高临床怀疑前列腺癌;(2) MRI 检查后6 个月内接受本院前列腺根治术;(3)病理标本取材方式为完整前列腺及精囊腺的逐层切片病理检查。排除标准:(1) mpMRI 图像质量不佳或图像资料不完整;(2)在手术之前进行任何相关治疗,包括放化疗、内分泌治疗。
1.2 mpMRI扫描方法
采用GE 3.0 T Signa TwinSpeed 和3.0 T Discovery HD 750 磁共振扫描仪、PHILIP Achieva 3.0 T TX 磁共振扫描仪进行图像采集。基本扫描序列包括T1 加权成像(T1 weighted imaging,T1WI)、T2WI、DWI 和动态对比增强DCE,具体参数如表1所示。
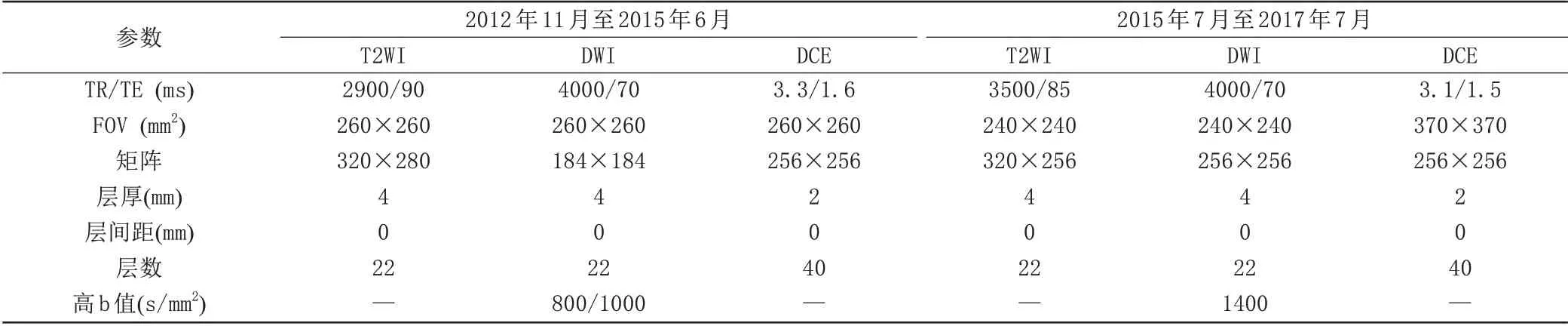
表1 前列腺多参数磁共振成像扫描参数
1.3 病理标准
以逐层切片病理为诊断金标准。将离体前列腺标本全部取材,沿背侧缘切线方向自尖部向底部以3~4 mm层厚依次切片,尽量保证切片角度与mpMRI轴位一致。由本院泌尿外科病理室一名主任医师对所有癌灶进行标记、边界勾画,并记录每个癌灶的位置和Gleason评分。使用Matlab软件逐层测量每个癌灶的面积,以所有层面面积之和×3 mm作为最终的病理体积。将Gleason评分≥3+4分和/或病理体积≥0.5 cm3和/或前列腺外侵犯的病灶定义为前列腺临床显著癌。
1.4 mpMRI图像分析
首先由一名影像科医师将mpMRI 图像与病理结果进行对照,标注癌灶所在位置及图像层面。然后由一名影像科主治医师、一名影像科主任医师同时阅片,共同对已标记图像按照PI-RADS v2.1和v2标准进行评分,两次读片时间间隔6周。
1.5 统计学分析
采用SPSS 19.0 和MedCalc 15.8 软件进行统计分析。以PI-RADS≥3 分为MRI 阳性表现,使用配对卡方检验(McNemar′s test)比较PI-RADS v2.1 和v2 评分变化的差异。绘制受试者工作特征曲线(receiver operating characteristic curves,ROC 曲线),并计算ROC 曲线下面积(area under the curve,AUC),使用Z检验比较AUC 的差异。P<0.05 为差异有统计学意义。
2 结果
2.1 入组病例资料
本研究最终入组病例53例,年龄49~76 (65.8±6.9)岁,PSA 范围4.3~50.5 ng/mL,MRI 检查与前列腺根治术间隔21~145 (66±29)天。逐层切片病理检查共检出89 个癌灶(包括70个临床显著癌):39个位于移行带、50个位于外周带。
2.2 PI-RADS v2.1与PI-RADS v2评分比较
PI-RADS v2.1与v2最终评分发生变化的癌灶共10例(11.2%,10/89),8例(20.5%,8/39)位于移行带、2例(4%,2/50)位于外周带。PI-RADS 1分比例从0%增加至4.5%,PI-RADS 2分比例从29.2%降低至22.5%,PI-RADS 3分比例从5.6%增加至6.7%,差异均无统计学意义(P分别为0.125、0.109、1.000)。PI-RADS≥3分病灶比例从70.8%增加至73.0%,差异无统计学意义(P=0.5)。具体PI-RADS 评分变化如下(表2):4 个(25%,4/16)移行带癌灶由PI-RADS 2分降为PI-RADS 1分(图1),2个(50%,2/4)移行带癌灶由PI-RADS 3分降为PI-RADS 2分,2个(12.5%,2/16)移行带癌灶由PI-RADS 2分升为PI-RADS 3分(图2),1个(10%,1/10)外周带癌灶由PI-RADS 2分升为PI-RADS 3分,1个(10%,1/10)外周带癌灶由PI-RADS 2 分升为PI-RADS 4 分。1 例移行带癌灶PI-RADS v2.1评分2+1分、PI-RADS v2评分3分,最终评分3分保持不变,Gleason评分3+4,病理体积0.87 cm3。
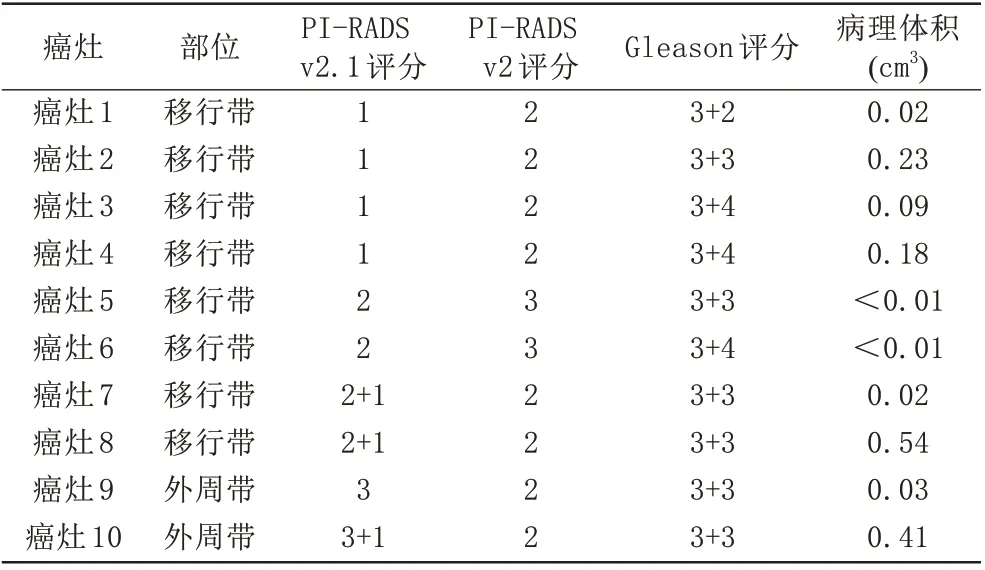
表2 PI‑RADS最终评分变化癌灶的Gleason评分和体积
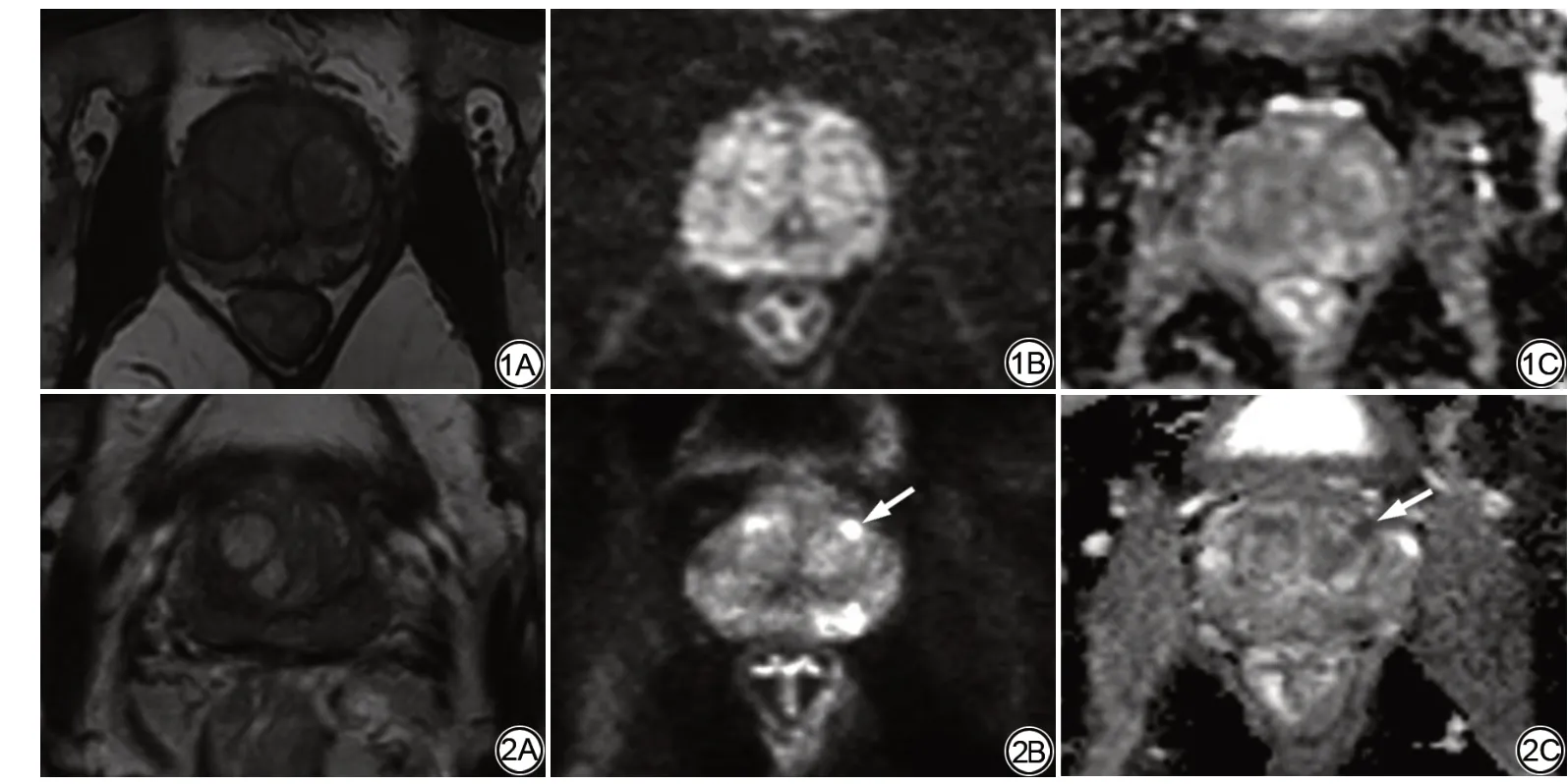
图1 男,76岁,MRI检查前总前列腺特异抗原(tPSA)13.02 ng/mL,游离前列腺特异抗原(fPSA)1.48 ng/mL,逐层切片病理证实体部左侧移行带前列腺癌,Gleason评分3+2分,体积0.02 cm3。1A:轴位T2WI示移行带典型增生结节;1B、1C:轴位DWI(b值=1000 s/mm2)、轴位ADC图未见显著信号改变。此种表现根据PI‑RADS v2标准T2WI评分2分则最终评分2分;而PI‑RADS v2.1标准T2WI评分1 分则最终评分1 分。 图2 男,61岁,MRI检查前总前列腺特异抗原(tPSA)8.98 ng/mL,游离前列腺特异抗原(fPSA)1.14 ng/mL,逐层切片病理证实体部左侧移行带前列腺癌,Gleason评分3+3,体积0.54 cm3。2A:轴位T2WI示包膜内不均匀信号;2B:轴位DWI(b值=1000 s/mm2)示局灶性显著高信号(箭);2C:轴位ADC图示显著低信号(箭)。此种表现根据PI‑RADS v2标准T2WI评分2分则最终评分2分;根据PI‑RADS v2.1标准T2WI评分2分同时结合DWI评分4分,最终评分3分。
2.3 PI-RADS v2.1与PI-RADS v2诊断效能
PI-RADS v2.1 检出所有、移行带和外周带临床显著癌的AUC 分别为0.873 (95%CI:0.799~0.947)、0.867 (95%CI:0.755~0.979)和0.841 (95%CI:0.715~0.966),PI-RADS v2 检出所有、移行带和外周带临床显著癌的AUC 分别为0.895 (95%CI:0.828~0.963)、0.878 (95%CI:0.772~0.984)和0.884 (95%CI:0.773~0.995),且差异均无统计学意义(Z=1.098,P=0.272;Z=0.301,P=0.763;Z=1.231,P=0.218)。
PI-RADS v2.1与v2详细评分如表3所示。PI-RADS v2.1评分1~2分的24例癌灶中,10例为临床显著癌(Gleason评分3+4、体积0.002~0.18 cm3),余均为非临床显著癌(Gleason评分3+3、体积0.02~0.03 cm3)。PI-RADS v2.1评分3分的6例癌灶中,2例非临床显著癌,余均为临床显著癌。PI-RADS v2评分2分的26 例癌灶中,9 例为临床显著癌,余均为非临床显著癌。PI-RADS v2评分3分的5例癌灶中,1例非临床显著癌,余均为临床显著癌。PI-RADS v2.1评分4~5分的59例癌灶中有3例非临床显著癌(Gleason 评分3+3、体积0.029~0.41 cm3),PI-RADS v2 评分4~5 分的58 例癌灶中有2 例非临床显著癌(Gleason评分3+3、体积0.029~0.4 cm3),余均为临床显著癌。
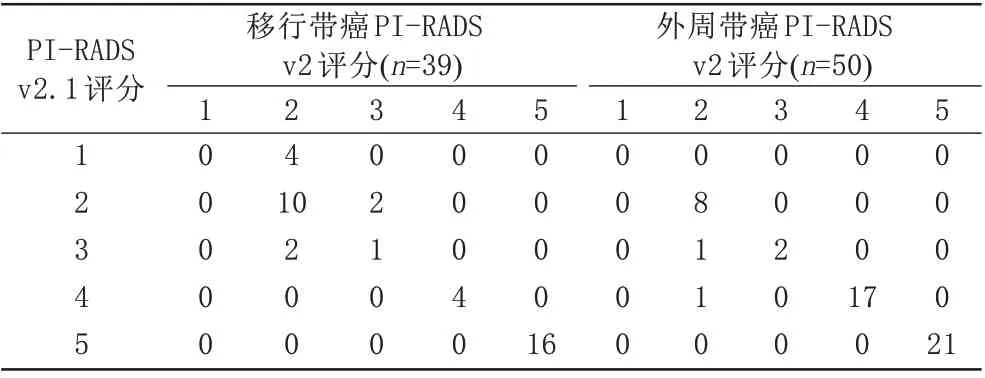
表3 移行带癌和外周带癌PI‑RADS v2.1和v2评分分布
3 讨论
3.1 本研究的主要优势
本研究的主要优势是以逐层切片病理为诊断金标准。与前列腺穿刺病理或普通的根治病理相较,逐层切片病理可以与mpMRI 图像进行一一对比,针对每一个病理发现的癌灶在MRI图像上定义出具体层面和位置,通过详细定义每一个癌灶的Gleason 评分和病理体积,将病理与MRI 对照完成到极致。由于前列腺癌具有多灶性特点,因此本研究中包含的癌灶数量要多于入组病例数量,除了责任病灶(index lesion)外还包括一些其他体积小、Gleason分级较低的癌灶。
3.2 PI-RADS v2.1移行带的评分变化
通过逐个癌灶的对比发现,PI-RADS v2.1 与v2 最终评分发生变化多位于移行带(80%,8/10),主要是因为PI-RADS v2.1 诊断标准在评价移行带病灶的变化更显著。对比PI-RADS v2,PI-RADS v2.1 最重要的变化是修改移行带1 分和2 分的诊断标准。PI-RADS v2.1 将典型的增生结节定义为1 分,非典型结节定义为2 分,而在PI-RASD v2 中增生结节均属于2 分。Linhares Moreira 等[9]研究发现PI-RADS 评分变化主要发生在移行带、且以PI-RADS 2分降为1分为主,56.8%典型增结节PI-RADS 评分由2 分降为1 分,其中包含极低概率的临床显著癌[6]。本研究中有4 例(25%,4/10)移行带2 分病灶降级为1 分,包含2 例临床显著癌,但是体积非常小,难以在MRI图像上识别[12]。
PI-RADS v2.1 中增加了移行带2+1 分病灶,即当T2WI 评分2分时,如果高b值DWI表现为显著高信号、ADC图显著高信号(DWI≥4 分),则最终评分升级为3 分。本研究中PI-RADS v2.1 评分2+1 分的移行带病灶有3 例(7.7%,3/39),其中2 例(66.7%,2/3)为临床显著癌。Costa等[13]研究发现6% (69/1238)移行带病灶被评分PI-RADS 2+1分,最终获得病理结果并证实为临床显著癌的概率仅6% (3/49)。而Byun等[14]研究发现50%(4/8) PI-RADS v2.1分移行带病灶证实为临床显著癌。
3.3 PI-RASD v2.1外周带的评分变化
目前国内外针对PI-RADS v2.1诊断效能的研究焦点多集中于移行带病灶,尤其2+1分病灶[15-18],少数研究对象是整个前列腺腺体,这与PI-RADS v2.1诊断标准的主要变化发生在移行带有关。Linhares Moreira等[9]研究发现只有少数外周带病灶评分发生变化:7% (22/319)由2分降为3分,15% (9/60)由3分降为2分,0.3% (1/319)由2分升为3分。PI-RADS v2.1中DWI 2分是根据病灶形态学特点而不考虑信号强度改变,表现为ADC图线状或楔形低信号和/或高b值DWI线状或楔形高信号,与PI-RADS v2中DWI 2分标准明显不同(ADC图模糊不清的轻度低信号)。本研究中2例外周带癌灶评分由PI-RADS 2分升为3分,表现为ADC图局灶性低信号,而其中1例评分由于DCE早期强化再升为3+1分。而本研究中未发现评分降级的病例,可能与入组病例数量有限、且入组病例均为前列腺癌而无阴性病例有关。
3.4 PI-RADS v2.1的诊断效能分析
国内研究[19-20]认为PI-RADS v2.1 较v2 具有更高的诊断效能且差异有统计学意义,尤其在移行带临床显著癌的检出具有更高的价值。Tamada等[21]研究认为PI-RADS v2.1 比PI-RADS v2 在评价移行带病灶方面更有优势,诊断临床显著癌的曲线下面积有所提高但差异无统计学意义。Lee等[10]Meta分析认为PI-RADS v2.1 诊断临床显著癌的曲线下面积高于PI-RADS v2,诊断敏感度、阳性预测值与阴性预测值差异无统计学意义(0.90 vs. 0.87,P=0.17;0.53 vs. 0.55,P=0.31;0.93 vs. 0.92,P=0.41),但PI-RADS v2.1诊断特异性显著降低(0.62 vs. 0.66,P=0.02),可能会增加不必要的穿刺。Linhares Moreira 等[9]研究认为PI-RADS v2.1 与v2 相比,由于PI-RADS≥3 分的病例数量没有发生明显变化(38.8% vs.39.4%),因此对临床决策几乎不产生影响。本研究中,虽然PI-RADS v2.1 的诊断效能稍低于PI-RADS v2,但是二者对前列腺临床显著癌的检出率与AUC 值均较高且差异无统计学意义;PI-RADS v2.1 与v2 相比,PI-RADS≥3 分的比例分别为73.0% vs. 70.8%,差异无统计学意义。
3.5 本研究的局限性
本研究具有一定的局限性。由于入组癌灶数量有限,因此PI-RADS v2.1 与v2 评分变化的癌灶数量较少。本研究中入组病例均为病理证实的癌灶,尽管有些癌灶Gleason 评分≥3+4,但由于病理体积很小、MRI 图像难以识别,因此会整体降低PI-RADS 诊断效能。尽管真正影响患者预后的是责任病灶,但以癌灶而不以患者为研究对象时,才能最大限度了解MRI 在诊断不同Gleason 评分、不同体积癌灶的能力。另外,本研究缺少读片一致性分析,而已有研究证明PI-RADS v2.1的读片一致性要优于PI-RADS v2[15,22]。
综上所述,PI-RADS v2.1 与v2 均具有较高的诊断效能,最终评分变化主要发生在移行带。PI-RADS≥3分病例数量无明显变化,对临床决策影响不大。
作者利益冲突声明:全部作者均声明无利益冲突。

