“电解原理的应用”项目式教学
莫小静 丁伟
摘要:围绕真实问题情境“电解法处理船舶压载水原理”开展电解原理应用的项目式学习,通过组装简易电解池、建构模型推理演绎电解饱和氯化钠溶液的原理、借助利用pH和氧化还原电位传感器可视化反应微观过程、间接碘量法定量测定电解液有效氯浓度、了解实际处理压裁水的工艺流程多个项目活动,学生在亲身参与活动过程中,层层突破抽象知识,体会知识的应用价值。
关键词:电解饱和氯化钠溶液;pH传感器;ORP传感器;压载水处理
文章编号:1008-0546(2022)12x-0006-06
中图分类号:G632.41
文献标识码:B
doi: 10.3969/j .issn.1008-0546.2022.12x.002
一、项目主题分析
实验“电解饱和食盐水”选自人教版高中化学选择性必修1第四章第二节,用作电解原理的应用的例子。该内容在中学教学中的重点往往放在了电解过程中阴、阳极的离子放电顺序的机械记忆上,使该部分内容过于晦涩、抽象,造成学生学习分化。学生对该部分内容存在电解池中能量转化、离子移动方向、电解池应用等方面的学習困难。…本研究选取“船舶压载水处理”真实情境,设计项目式学习,让学生在真实问题情境中,以实验室活动为载体,突破学生在“电解原理”学习中的障碍。
二、项目教学目标
能从化学反应本质、电极、物质转化、现象、电极反应等角度建构电解池原理的认知模型,并演绎推理预测电解饱和食盐水的原理;
通过数字化pH传感器和ORP传感器,收集微观反应数据,合理解释微观进程,实现“四重表征”深入剖析反应原理;
通过电解结束后电解液有效氯浓度测定的实验设计、数据采集、数据表征、数据分析的探究过程,亲身参与用间接碘量法测量溶液的有效氯浓度,实现计算思维的提升;
从多角度了解工业中处理压载水的工艺,形成效率意识、环境保护意识,体会化学的学科价值。
三、教学流程
“电解原理的应用”教学设计了五个项目任务(如图1)。任务1-3解决了核心内容1中的电解法处理压载水的原理问题,证实电解法可以用于船舶压载水的杀菌,但是工业化的应用还要考虑到电解效率,从而过渡到任务4、任务5解决核心内容2中电解法处理压载水的效率、工艺问题。任务从生活中感受化学,到应用化学知识进行科学探究、解释,最后再将知识应用到社会中,符合学生的认知逻辑。
四、教学过程
任务1:搭建微型家庭实验装置
[情境故事]大型的船舶在海上为保持良好的稳性航行,需要加载压载物。船舶压入和排出压载水需要在港口水域或者近海水域进行,会带来海洋微生物和动植物的全球流动。这些物种排放到新的海域后,可能会建立起新的种群,对原有地区海洋生态产生威胁。船舶压载水带来的危害被列为全球海洋的“四大危险”之一。[2]处理压载水的方法之一为电解海水法。这一过程能否在实验室进行模拟?
[驱动问题1]请利用生活中常见的物品组装一个电解饱和NaCl溶液的微型装置。思考电解氯化钠溶液过程发生了怎样的变化?
[探究活动1]
提供的用品:5 mL西林瓶、饱和食盐水、铅笔芯、9V电池。
实验装置:按图2的装置示意图,组装出如图3装置实物图。
实验现象:两个电极上都有气泡生成,且伴有刺激性气味。
[任务总结]电解池的构成要素为:电解质溶液、电极、外接电源;电解饱和食盐水过程中阴极、阳极都有气泡生成。
任务2:建构电解池的认知模型
[驱动问题2]电解压载水的过程中发生了什么变化?类比学习过的电解CuCl2溶液,从电解池的本质、电极、物质转化、电极反应等角度思考分析电解池有哪些步骤?
[讨论活动2]
学生1:从反应原理上看,属于氧化还原反应;
学生2:电解CuCl2溶液中,电极材料都是石墨电极;通电后,外电路中的电子首先从电源的负极流出到阴极,再从阳极流回正极;为了形成闭合回路,内电路中的阳离子向阴极移动,阴离子向阳极移动。在阴极上生成Cu;在阳极上生成Cl2。
提炼模型
电解池分析方法模型(图4):判变化→定电极→析成分→排次序→定反应。
[驱动问题3]电解法处理压载水主要是利用电解后的溶液具有强氧化性而杀灭细菌。从微观看电解饱和NaCl溶液过程是怎么样的?
[讨论活动3]
应用模型分析电解饱和NaCl的过程如图5。
[归纳总结]应用模型演绎推理电解饱和NaCl溶液的原理,但这只是理论的推理,若要证实,还需要收集实验证据。
任务3:可视化反应过程
[驱动问题4]从理论推理中得到了电解饱和NaCl溶液会生成H2、Cl2、NaOH,但是根据已有的知识,消毒液的主要成分是NaClO,这个过程如何实现?
[讨论活动4]
学生提出假设:可能是产物Cl2和NaOH进一步反应生成的。
教师引导:这个过程中有哪些微粒发生了反应?这些微粒能否借助一定的仪器检测到?
学生:在这个过程中本质上就是H+和Cl放电而产生了一系列的变化,H+可以通过测量溶液的pH变化进行检测。
[讨论总结]借助pH传感器可以收集反应过程中体系的pH随时间变化的数据;而Cl2或NaClO的检测,可以利用他们的共同点——氧化性而进行检测。氧化性的检测方法如图6所示。
[驱动问题5]借助pH、ORP传感器可以采集反应过程中体系的pH、ORP值随时间的变化数据,将pH和ORP值数据综合分析,思考在电解饱和NaCl溶液时,微粒发生怎样的反应?
[探究活动5]
按如图7装置示意图搭建如图8所示实验实物图。
数据采集
打开数据采集器,连接pH传感器与ORP传感器。向烧瓶中加入饱和NaCl溶液100 mL,设置数据采集频率为2样本/秒,点击“采集”按钮,待pH与ORP值稳定后(30 s),接通电源,电流为1.OA,电解3 min后关闭电源,待pH和ORP值稳定后(5min)停止采集数据,得到如图9图像,将数据保存并导出。
数据表征
将127s ORP值异常数据剔除,导人到Origin数据处理软件,绘制出如图10“时间-pH”和“时间-ORP值”图像。
资料卡片
pH与次氯酸钠溶液平衡关系如下图11所示:当溶液的pH<2,溶液中主要成分为Cl:;当溶液48,溶液中的主要成分为ClO。Cl2/Cl的标准电极电势为1.36 V,HClO/Cl2的标准电极电势为1.61 V,HClO/Cl的标准电极电势为1.48 V,ClO-/Cl的标准电极电势为0.89 Vn
次氯酸钠溶液即使在常温下也会发生自然分解释放出新生态原子氧:NaClO=NaCl+[O],而新生態原子氧具有强烈的氧化作用,能进一步引起一系列的反应:
NaClO+H2O=NaOH +HClO
NaClO+ 2HClO=NaClO3+ 2HCl
HCl+ NaOH =NaCl+ H20
3NaClO =NaClO3+ 2NaCl
小组讨论
分析曲线特征,解释曲线含义。
[教师曲线解释]
在反应开始前,测得饱和食盐水的pH约为6.30,可能的原因有:a.配制饱和食盐水的溶剂去离子水呈弱酸性;b.在配制饱和食盐水后,溶液静置了一段时间,可能溶解了空气中的少量CO2。
第一阶段:AB、A'B段(30 s-34 s)和BC、B'C段(34 s-39 s),溶液的pH和ORP值都呈现出先上升后下降趋势,这个阶段中,阴极附近发生电极反应:2H2O+2e-=H2↑+2OH-,阳极附近发生电极反应:2Cl-- 2e=Cl2↑,阳极附近生成的Cl:很快和阴极附近生成的OH发生反应:Cl2+OH=HClO+Cl。阴极生成了OH,同时由于Cl2和OH发生反应消耗了OH-,因此溶液的pH先上升后下降;溶液中存在的氧化还原电对有φ(H2O/H:)=-0.83 V,φe(CUCl-)=1.36 V,φ0(HClO/Cl-)=1.61 V,此时溶液中Cl2、ClO-的浓度都比较小,溶液的ORP值先上升再下降可能是由于φ0 (H2O/H2)、φo(Cl2/Cl-)、φo(HClO/Cl-)三电对综合作用的结果。
第二阶段:CD和C'D段(39 s-56 s),溶液的pH和ORP值都急剧上升。在外加电压的作用下,Cl2不断生成,由于Cl:的溶解度不大,生成的Cl:-部分溶解在溶液中,一部分逸散出体系,溶解在体系中的部分Cl:与OH发生反应,n(0H)牛成>n(0H)消耗,溶液的pH不断上升;溶液的pH约为6-8,此时溶液中有不断电解生成的Cl2、Cl2和OH反应生成的HClO、HClO和OH-反应生成的ClO-,溶液中存在Cl2/Cl-、HClO/Cl2、HClO/Cl-、cio-icr多种氧化还原电对,氧化态氯元素主要以HClO和ClO-的形式存在,因此在该阶段溶液的ORP值急剧上升。
第三阶段:DE和D'E段(56 s-95 s),该阶段中,pH持续增大,ORP值处于动态平衡。电解持续发生,Cl:仍有大部分逸散到溶液体系外,溶解在体系中的部分Cl2与OH发生反应,n(OH-)生成>n(OH-)消耗,溶液的pH不断上升;此时溶液的pH约为8-10,此时溶液的碱性较强,因此溶液中主要存在不断电解生成的Cl2,溶液中的Cl2迅速和OH-发生反应生成ClO-,中间状态的HClO含量较低,因此溶液中主要存在cio-/cr氧化还原电对,而该电对的电位较小,会导致溶液的ORP值有所降低,但同时由于电解持续进行,不断有Cl-)和ClO生成,又会使ORP值增大,此溶液的ORP值处于一个动态平衡。
第四阶段:EF和E'F段(95 s-210 s),该阶段中pH趋于稳定,ORP值处于一个动态平衡,随着Cl2的不断生成,溶液和气体环境中Cl已经处于一个稳定的状态,因此生成的Cl2主要存在于溶液体系中,可以认为电极反应生成的Cl2和OH-恰好反应生成了ClO-,因此n(OH一)生成=n(OH-)消耗,溶液的pH也达到了相对稳定的状态。
第五阶段,FG、F'G段(210 s-213 s)和GH、G'H段(210 s-510 s),该阶段停止了通电,溶液的pH不断下降,在停电后瞬间溶液的ORP值急剧下降,而后不断上升。逸散在容器内的Cl2溶解在溶液中,且部分与溶液中的OH一反应:Cl2+2OH-=ClO-+Cl-+H2O,消耗了OH-,生成了ClO-,因此溶液的pH下降;在停电后瞬间溶液的ORP值急剧下降可能是由于停电瞬间,阳极附近生成Cl的电极反应停止了,后ORP值不断上升也可能是溶液中的NaClO受光照、温度的影响,发生了自分解,产生了氧化性极强新生态原子氧,随着Na-ClO的不断分解,溶液的ORP值不断上升。
[任务总结]借助pH传感器、ORP传感器,证实了电解饱和氯化钠溶液能够产生具有一定氧化性的电解液,具有消毒能力。
任务4:定量化反应结果
[驱动问题6]通过理论分析与实验证据证实电解饱和NaCl溶液可以制备具有杀菌功能的消毒液。但工业化的应用还要考虑到电解效率的问题,电解得到的电解液中发挥消毒作用的有效氯浓度是多少呢?
[探究活动6]
资料卡片
有效氯是指与每升产生的次氯酸钠溶液所具有的氧化能力相当的氯气的质量,用于定量表示消毒效果。有效氯浓度采取碘量法'3'测定,原理如下:
在酸性介质中,次氯酸根与碘化钾反应,析出碘,以淀粉为指示液,用硫代硫酸钠标准滴定溶液滴定,至蓝色消失为终点,反应式如下:
小组讨论制定实验方案并进行实验
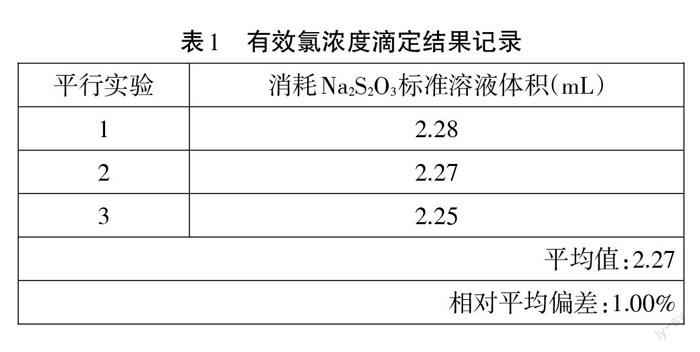
移取10.00 mL电解后的溶液置于100 mL碘量瓶中,加入10 mL碘化钾(100g/L)溶液和10 mL硫酸( 3+100)溶液,迅速盖紧瓶塞后用水封,在暗处静置5 min。用硫代硫酸钠标准溶液(0.1105 mol/L)滴定至浅黄色,实验装置如图12,加2 mL淀粉指示液,滴定至蓝色消失为终点,实验数据如下表1。
实验结论
电解后的溶液有效氯浓度为889.2 mg/L。
[任务总结]借助间接碘量法,测定了在1.OA电流下电解100 mL饱和NaCl溶液3 min制得的漂白剂的有效氯浓度889.2 mg/L。已知原生动物在溶液中能承受的有效氯浓度为5 mg/L;海藻能承受的有效氯浓度为5-10 mg/L,几乎所有藻类都无法在超过20 mg/L海水中生长;在有效氯浓度为20 mg/L处理海水中基本无细菌存活。在实际工业中,海水的浓度要低于饱和食盐水,处理的时间也会比实验时间要长,但通过实验可以发现在短时间内可以得到有效氯浓度可观的电解液。
任务5:了解电解处理压载水工艺
[驱动性问题7]基于理论依据和实验证据的分析,理清了电解池的工作原理,体会到电解饱和NaCl溶液的工业生产价值,也尝试在实验室还原了该过程。但是工业生产的过程往往需要考虑到更多因素,工业中应用电解法处理压载水都需要经历哪些流程?
[探究活动7]从设备的组成、生产效率、环境保护等角度进行分析处理压载水工艺的优缺点,形成报告。
学生汇报
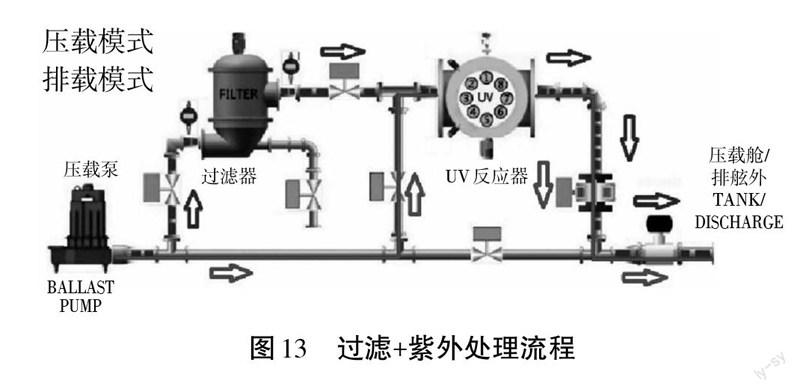
(1)生產工艺1:过滤+紫外(UV)技术[4]
从压载水处理的收益与成本的比率评估,过滤法和紫外法的优势明显,并且处理过程较为环保,但是这种方法处理的效果欠佳,对藻类的灭活效果较差(如图13)。
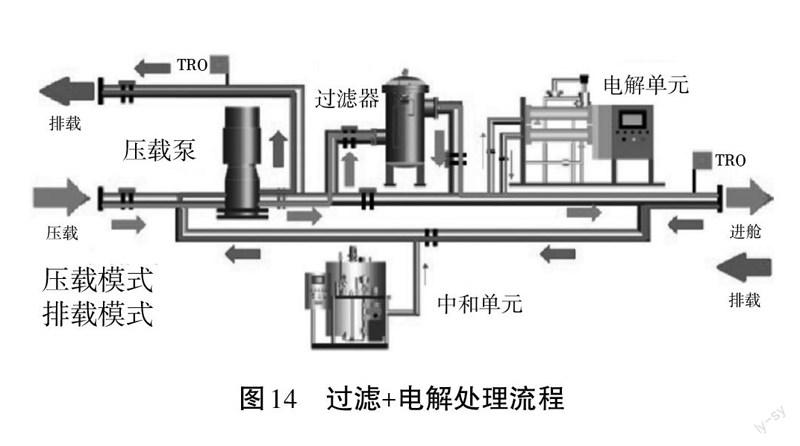
(2)生产工艺2:过滤+电解技术[4]
电解单元是从船上取少量过滤后的海水进行电解,电解产生以次氯酸钠为主要成分的高浓度、强氧化性的溶液注入到压载总管中,混合进仓的压载水在压载舱内闷舱24 h以达到杀菌灭活的要求(如图14)。
(3)生产工艺3:紫外+臭氧复合处理[5]
该系统(如图15)能够兼具03处理法和紫外处理法的优点,有利于降低能耗,提高系统的效能。
[任务总结]通过查阅文献资料了解真实生产的过程,了解化学成果是如何应用于生产的,体会化学对解决工业生产问题的重要作用。同时,在优化生产工艺中,体会工业中的节约成本、提高效率、环境保护的意识。
五、教学价值
本项目围绕“电解法处理压载水”的实验室复原、原理进行探究,学生具身解决真实情境问题,凸显以下教育教学价值:
(1)教学内容嵌入真实问题情境
情境素材的选取不仅与教学情境的创设有关系,也是发展学生的科学精神和人文精神的关键,“电化学”与化学生产、能源利用等领域密切相关,是化学学科与社会生活生产联系最密切的内容之一。[6]本研究选取“电解法处理压载水”真实情境开展教学,了解真实生产中的化学原理与过程。
(2)科学方法嵌入具身活动体验
学生作为项目执行者,通过微型装置搭建、可视化数据采集与表征、定量化结果滴定等项目活动,亲身经历实验设计、数据采集、数据表征、数据分析的过程,将定性的实验现象转化为可定量感知的数据,感受电解后溶液的消毒效果,在与实验室的互动中丰富了对电解池的认识。
(3)化学知识嵌入社会价值
围绕“电解法处理船舶压载水”开展学习,从原理、效率等角度了解真实生产的过程,了解化学成果是如何应用于生产的,体会化学对解决工业生产问题的重要作用,同时感受化学在工业中的价值及应用。
参考文献
[1] 陈晓娜,王婷婷,闫春更,周青,基于学生“电解池”学习困难的测查与教学建议[J].化学教与学,2017(07):2-6.
[2]
Nunes A L,Katsanevakis S,Zenetos A, et al.Cateways toalien invasions in the European seas[J].Aquatic Invasions,2014,9(2):133-144.
[3] 中华人民共和国国家质量监督检验检疫总局.次氯酸钠:GB 19106-2013[S].北京:中国标准出版社,2014.
[4]郑德康,张少华,李振伟.船舶压载水法规与处理技术现状分析[J].船舶工程,2021,43(SI):209-213.
[5]徐仲,陈国桢,苏婷,张思源,尤宏.紫外/臭氧复合压载水处理系统的建立与运行[J].哈尔滨工业大学学报,2018,50(02):100-103.
[6]许嘉铭,代榕,唐丽潇,陈新丽,周合兵.新旧人教版教材选修模块“电化学”内容的比较分析[J].化学教育(中英文),2021,42(17):32-37.

