对NaHCO3溶液中各离子浓度的探究
张贝贝
关键词:虚拟实验;碳酸氢钠溶液;离子浓度;定量研究
一、引言
电解质溶液中离子浓度大小排序是高中化学常考题型,其中碳酸氢钠溶液中各离子浓度排序尤为常见。在日常教学中,关于碳酸氢钠溶液中各离子浓度大小关系分析过程如下:
碳酸氢钠溶液中存在的电离平衡与水解平衡共有四个,分别为:
第一步中,由于HCO-3 水解,所以c(Na+)>c(HCO-3 ),又因为碳酸氢钠溶液显碱性,所以HCO-3 的水解能力大于电离能力,即c(OH-)>c(CO2-3 ),第三步中c(H+)=c(CO2-3 ),但由于第四步中水电离出少量c(H+),所以c(H+)>c(CO2-3 ),综上,c(Na+)>c(HCO-3 )>c(OH-)>c(H+)>c(CO2-3 )。
对此,有不少学者提出了质疑,孙丽梅[1]通过对1.0×10-4 mol/L和0.10 mol/L的NaHCO3溶液中c(H+)、c(OH-)、c(CO2-3 )以及c(H2CO3)进行的分析,发现两种浓度下粒子浓度不同;姜广勇[2]以及乔悦、赵广柱[3]等人也对某一具体浓度进行了分析,得出与日常教学中不同的结果;在此基础上,刘清华[4]通过公式计算,对浓度为1.0×10-6 mol/L~0.10 mol/L的碳酸氢钠溶液中各微粒浓度进行了探究,发现碳酸氢钠溶液浓度不同时,各微粒浓度大小关系有三种情况。
之所以有学者对此提出质疑,笔者分析主要有以下两个方面的原因:第一,日常教学中,教师只进行了定性分析,并没有对碳酸氢钠溶液中各离子浓度进行定量计算;第二,大部分学者忽略了在碳酸氢钠溶液中还存在HCO-3 的质子自递反应[5],即HCO-3 + HCO-3 H2CO3+ CO2-3 ,K=1.07×10- 4,我们发现HCO-3 的质子自递反应的平衡常数的数量级为10-4,这远远大于上述三个反应的平衡常数,而这一反应往往成为大多数学者计算出错的主要原因。
通过查阅文献,我们可以发现大多数学者并没有考虑温度对碳酸氢钠溶液中各离子浓度大小顺序的影响,也没有找出各种情况所对应的碳酸氢钠溶液的浓度范围。基于以上分析,笔者以“IrYdiumChemistry Lab”虚拟化学实验软件为载体,对碳酸氢钠溶液中各离子浓度大小进行探究。“IrYdium Chem?istry Lab”虚拟化学实验软件是一个内含多种标准试剂并可以进行多种操作的仿真实验室。其以传感技术为载体,计算结果准确。对于没有数字化实验设备的学校来说,具有较好的可视化教学效果。周昌林[6]对其下载方法以及简单应用已做了详细的介绍。
二、温度的影响
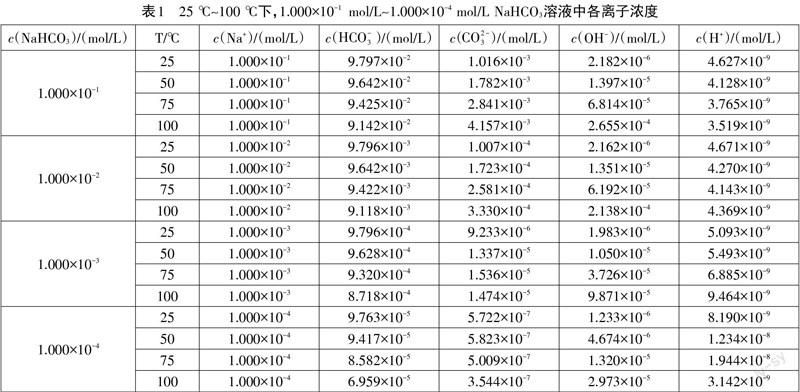
温度对电解质溶液中酸根离子的水解能力和电离能力有明显的影响,直接影响着水解方程式和电离方程式所对应的平衡常数。因此,笔者以1.000×10- 1 mol/L、1.000×10- 2 mol/L、1.000×10- 3 mol/L 以及1.000×10-4 mol/L的NaHCO3溶液为例,探究了温度为25 ℃、50 ℃、75 ℃以及100 ℃下,碳酸氢钠溶液中各离子浓度大小顺序,见表1。
通过对表1数据分析,我们可以得出以下三个结论:第一对同浓度的碳酸氢钠溶液而言,随着温度的升高,c(Na+)保持不变,c(HCO-3 )减小,c(CO2-3 )、c(OH-)以及c(H+)都有所升高。这是由于质子自递反应平衡常数的数量级较大,随着温度的升高,反应正向移动效果明显,HCO-3 逐渐转变为CO2-3 ;与此同时,温度的升高促进了碳酸氢根离子和水的电离,使得c(CO2-3 )、c(OH-)以及c(H+)都有所升高。
第二碳酸氢钠浓度为1.000×10-3 mol/L~1.000×10- 1 mol/L 时,溶液中各离子浓度大小顺序始终为c(Na+)>c(HCO-3 )>c(CO2-3 )>c(OH-)>c(H+),碳酸氢钠浓度为1.000×10-4 mol/L时,溶液中各离子浓度大小顺序始终为c(Na+)>c(HCO-3)>c(OH-)>c(CO2-3 )>c(H+)。
第三温度对碳酸氢钠溶液中各离子浓度大小顺序影响较小,浓度对碳酸氢钠溶液中各离子浓度大小顺序影响较大。
三、浓度的影响
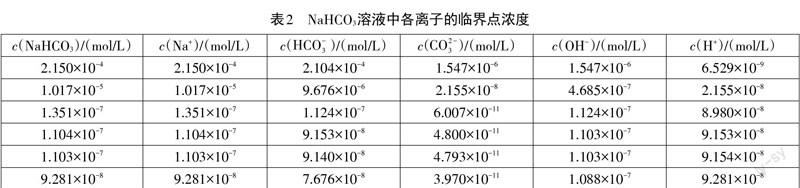
随着碳酸氢钠溶液浓度的稀释,酸根离子的水解能力和电离能力都会有所增强,正所谓越稀越电离,越稀越水解。当溶液浓度足够小时,溶液pH≈7,c(OH-)与c(H+)有可能比c(Na+)还要大,笔者以25℃下0.10 mol/L的NaHCO3溶液为起点,对碳酸氢钠溶液进行稀释,发现碳酸氢钠溶液中离子浓度大小顺序共有7种情况,各浓度临界点见表2。
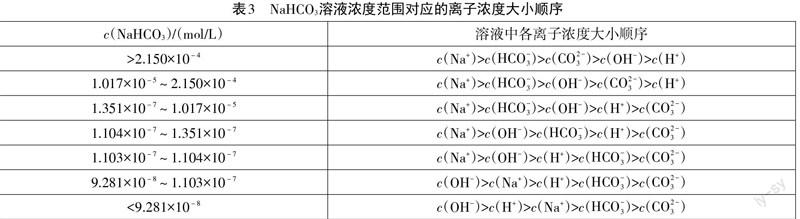
通过上表我们可以发现,随着碳酸氢钠溶液浓度的降低,c(CO2-3 )极速降低,当c(NaHCO3)=2.150×10-4 mol/L时,c(CO2-3 )=c(OH-),此时出现了第一臨界点,随着溶液的稀释,溶液中各离子浓度大小顺序变为c(Na+)>c(HCO-3 )>c(OH-)>c(CO2-3 )>c(H+)。随着溶液的稀释,水的电离对于溶液中各离子浓度大小顺序的影响越来越大,当c(NaHCO3)=1.017×10-5 mol/L时,c(CO2-3 )=c(H+),出现了第二个临界点,当溶液被稀释后,溶液中各离子浓度大小顺序变为c(Na+)>c(HCO-3 )>c(OH-)>c(H+)>c(CO2-3 )。当c(NaHCO3)=1.351×10-7 mol/L时,c(HCO-3 )=c(OH-),此时出现第三个临界点,在此基础上稀释,溶液中各离子浓度大小顺序变为c(Na+)>c(OH-)>c(HCO-3 )>c(H+)>c(CO2-3 )。此后c(OH-)与c(H+)的变化成为溶液中各离子浓度大小顺序变化的主要原因,第4、5、6个临界点分别为1.104×10-7 mol/L、1.103×10-7 mol/L和9.281×10-8 mol/L,溶液中各离子浓度大小顺序变分别为c(Na+)>c(OH-)>c(H+)>c(HCO-3 )>c(CO2-3 )、c(OH-)>c(Na+)>c(H+)>c(HCO-3 )>c(CO2-3 )和c(OH-)>c(H+)>c(Na+)>c(HCO-3 )>c(CO2-3 )。笔者对碳酸氢钠溶液进行了再稀释,发现当c(NaHCO3)<9.281×10-8 mol/L时,溶液中各离子浓度大小顺序不再变化。现将7种情况整理于表3。
四、研究价值
通过以上研究可以发现,碳酸氢钠溶液中各离子浓度大小顺序存在多种情况,在没有说明碳酸氢钠溶液浓度的情况下,各离子浓度大小顺序是无法确定的。同理NaHSO3、NaHS等酸式盐中各离子浓度大小顺序也存在多种情况。教师在日常教学中关于NaHCO3溶液中各离子浓度大小顺序的讲解以及我们日常所涉及的习题多有不严谨的情况出现,针对这种现象,笔者有以下两个建议:第一,我们在教学和命题中,要尽量避免出现类似知识点;第二,如果教师想要考查相关知识时,比如:c(Na +)>c(HCO-3 )>c(OH-)>c(H +)>c(CO2-3 )这种常考类型,一定要标注所对应的浓度值。

