绒毛白蜡松散型胚性愈伤组织的诱导
董洪雨 许丁帆 易元慧 何远秦 李得萍 刘艳军

摘 要:以绒毛白蜡组培苗茎段为外植体,建立绒毛白蜡松散型胚性愈伤组织诱导体系,为绒毛白蜡遗传转化与离体诱变等研究奠定基础。试验结果显示:幼嫩茎段在WPM+0.5 mg·L-1 2,4-D + 5 mg·L-1 GA3 + 30 g·L-1蔗糖的培养基上可诱导出理想的松散型愈伤组织;将松散型愈伤组织在MS + 0.5 mg·L-1 2,4-D + 1.0 mg·L-1 KT + 30 g·L-1蔗糖的培养基上继代培养,每15 d继代1次,继代时选择结构松散质地较硬的愈伤组织,3次继代培养后,可获得绒毛白蜡松散型胚性愈伤组织。
关键词:绒毛白蜡 ;松散型胚性愈伤组织;组织培养
中图分类号:S722.3+7 文献标识码:A DOI 编码:10.3969/j.issn.1006-6500.2022.05.002
Study on the Induction of Loose Embryogenic Callus from Fraxinus velutina Torr
DONG Hongyu, XU Dingfan, YI Yuanhui, HE Yuanqin, LI Deping, LIU Yanjun
(School of Horticulture and Landscape Architecture, Tianjin Agricultural University, Tianjin 300392, China)
Abstract: Using the stem segments of tissue cultured seedlings of Fraxinus velutina Torr, as explants, the loose embryogenic callus induction system of Fraxinus velutina was established, which laid a foundation for the study of genetic transformation and in vitro mutagenesis of Fraxinus velutina. The results showed that the young stem segments could induce ideal Loose callus on the medium of WPM+ 0.5 mg·L-1 2,4-D+5 mg·L-1 GA3+30 g·L-1 sucrose; The loose callus was subcultured on the medium of MS+0.5 mg·L-1 2,4-D+1.0 mg·L-1 KT+30 g·L-1 sucrose, and subcultured once every 15 days. The callus with loose structure and hard texture was selected during subculture. After subculture for 3 times, the loose embryogenic callus of Fraxinus velutina Torr could be obtained.
Key words: Fraxinus velutina; loose embryogenic callus; tissue culture
绒毛白蜡(Fraxinus velutina)为木犀科(Oleaceae)白蜡属(Fraxinus)落叶乔木,树体高大,枝节粗壮,抗逆性强,是防风固沙的重要树种[1]。目前,绒毛白蜡以种子繁殖、扦插繁殖为主要繁殖方式,受时间和环境条件的影响较大,繁殖效率较低。利用植物组织培养技术可以显著缩短繁殖周期,同时还能保持亲本的优良特性[2]。
植物组织培养技术与传统的植物繁殖技术相比,植物组织培养技术不仅节省繁殖材料,而且促进植株的生长发育、人为调控影响植株的因素使其植株处于最佳状态[3]。松散型胚性愈伤组织是经过人工诱导产生的一种特殊的植物组织类型,这种组织主要由彼此联系松散的愈伤组织细胞构成,而愈伤组织细胞的特点是其具有一定的胚性,即这些细胞可以在一定条件下经过分化与分裂,逐步发育成胚状体。这类细胞在组培快繁、体细胞诱变育种、遗传转化和植物组织脱毒培养方面都有良好的应用前景,并存在較强的技术优势,而且具有很强的体细胞胚发生和植株再生能力[4]。
关于白蜡属的研究,其他学者也有一定的进展。他们在白蜡属中成功诱导出愈伤组织的有美国白蜡[5],水曲柳[6-7],对节白蜡[8-9]等。在白蜡组织培养技术中,已见种子[10]、茎段[11-12]等作为外植体进行白蜡愈伤组织诱导的报道。在绒毛白蜡组织培养研究中,宁苓等[13]和许丁帆等[14]以幼嫩茎段为材料建立组织培养快速繁育体系;燕丽萍等[15]利用胚根诱导绒毛白蜡体细胞胚发生,建立再生体系。但至今没有人采用松散型愈伤组织培育绒毛白蜡完整植株。
本试验以绒毛白蜡组培苗茎段为外植体,在不同培养基上诱导愈伤和胚性愈伤组织,并结合显微镜观察及继代选择,最终建立其稳定的绒毛白蜡松散型胚性愈伤组织诱导体系。
1 材料和方法
1.1 试验材料
本试验所用的绒毛白蜡组培苗由天津农学院园林植物实验室提供。组培苗所用的继代培养基为MS培养基。
1.2 试验方法
1.2.1 绒毛白蜡松散型愈伤组织诱导 将绒毛白蜡组培苗剪成5~7 mm的幼嫩茎段,将其接种到事先配制的愈伤组织诱导培养基上,本试验采用不同基本培养基,同时附加不同的植物激素,配成诱导培养基,每个品种接种10块外植体,每个处理设置3次重复。将接种好的三角瓶放到培养室中进行培养,其培养的条件为:采用连续光照,光照强度为1 000 lx,培养温度为24±2 ℃。培养时间为40 d,最后统计每种处理的试验结果。
1.2.2 松散型胚性愈伤组织诱导 将上一步骤诱导出的白色、松散的愈伤组织从三角瓶中取出,在超净台中,用镊子分成大小约0.25 cm3的愈伤组织块,将愈伤组织团接种到事先配制的培养基上。试验用的基本培养基为MS培养基,并添加不同种类与浓度的激素。每个试验处理重复5次,每瓶接种8块外植体。培养条件与前面相同,温度改为22±2 ℃,经过10 d的培养,将每个处理的愈伤组织采用相同的培养基进行继代培养,最后把每个试验处理的愈伤组织的诱导结果进行统计记录。
1.3 统计分析
愈伤组织诱导率%=(诱导出愈伤组织的外植体数/接种外植体数)×100%;
试验数据采用Excel 2013和SPSS Statistic 17.0进行数据分析,Duncans新复极差法进行多重比较。
2 结果与分析
2.1 绒毛白蜡愈伤组织诱导结果
将绒毛白蜡茎段外植体接种到愈伤组织诱导培养基上后,每天观察愈伤组织诱导情况。随着时间的延长,在不同处理的外植体上出现明显的差异,具体结果见表1。
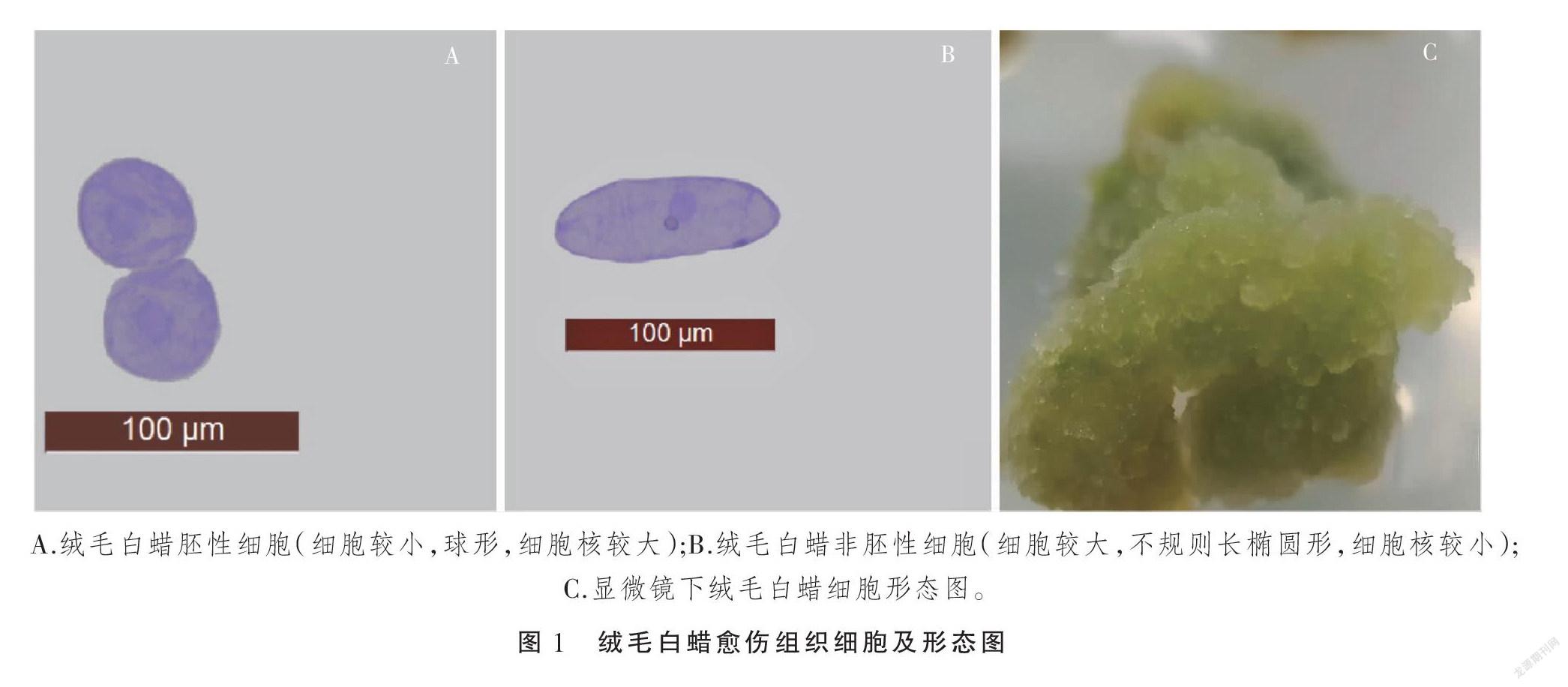
从表1可以看出,不同培养基上绒毛白蜡愈伤组织诱导的情况明显不同,首先从愈伤组织诱导率来看,采用MS和B5作为基本培养基,愈伤组织诱导率都不太高,说明这两种培养基都不适合愈伤组织的诱导。然而采用WPM作为基本培养基时,不论2,4-D的浓度是0.5 mg·L-1还是1.0 mg·L-1,这时愈伤组织的诱导率都可以达到100%,说明WPM适合白蜡愈伤组织的诱导,适合组培苗的生长;其次,从愈伤组织生长来看,不同基本培养基上愈伤组织生长情况也不同。当培养基中只加入2,4-D时,3种基本培养基上诱导出的愈伤组织都生长缓慢,只是在WPM和B5上愈伤组织是白色紧密型的类型,而MS上是白色半透明,并且随着2,4-D浓度增加,愈伤组织出现褐变现象,说明在MS中增加2,4-D浓度会对愈伤组织产生强烈的毒害作用。而白色紧密型愈伤组织对于胚性愈伤组织的诱导不利,一般很难从这种愈伤组织诱导出胚性愈伤(图1-A)。因此,本试验通过调整试验方案,在培养基中加入了GA3来增加外植体的生理活性,使得愈伤组织生长速度增快,从而在愈伤组织类型上有所改变。试验结果显示在WPM+0.5 mg·L-1 2,4-D+5 mg·L-1 GA3的培养基上愈伤组织生长速度明显增快,同时,松散型愈伤组织也可以诱导出来,这类组织进一步诱导很容易获得胚性愈伤组织。当采用更高浓度的GA3时,愈伤组织生长速度不但没有增快,相反出现褐变现象,这说明过高浓度对愈伤组织产生了毒害作用,因此综上试验结果,诱导白蜡愈伤组织的理想培养基配方为:WPM+0.5 mg·L-1 2,4-D+5 mg·L-1 GA3+30 g·L-1蔗糖。
2.2 绒毛白蜡胚性愈伤组织诱导的结果
从表2可以看出,在不同激素配比条件下,绒毛白蜡愈伤组织胚性化诱导结果不同。首先,单独使用2,4-D时,虽然愈伤组织可以生长,但速度较慢,而且愈伤组织逐渐变硬,结构也变得紧密,单独使用2,4-D不能诱导白蜡愈伤组织胚性化;当使用0.5 mg·L-1 2,4-D与0.5 mg·L-1 BA和KT配合使用时,愈伤组织生长速度还是较慢,愈伤组织硬并且结构紧密,愈伤组织很难胚性化;当采用 0.5 mg·L-1 2,4-D+1.0 mg·L-1 BA培养基时,愈伤组织生长较快,质地与结构也都与胚性愈伤组织相似,通过镜检发现,一部分愈伤组织细胞呈现球型、细胞质浓、细胞核明显,细胞分裂旺盛,属于胚性细胞(图1-B),但多数是一些具有较大液泡的薄壁细胞,这说明该配方可以诱导绒毛白蜡愈伤组织转变为胚性愈伤,只是效果较差;当采用0.5 mg·L-1 2,4-D+1.0 mg·L-1 KT时,愈伤组织结构松散、质地较硬,通过显微镜观察发现细胞大多呈球形,细胞核明显,属于胚性愈伤组织细胞(图1-C),说明该配方适合诱导绒毛白蜡愈伤组织往胚性愈伤组织转变;当提高2,4-D浓度并采用较低浓度的BA和KT时,愈伤组织生长速度较快,但质地较软,通过镜检发现只有少数细胞为胚性细胞;当采用1.0 mg·L-1 2,4-D+1.0 mg·L-1 KT和1.0 mg·L-1 2,4-D+1.0 mg·L-1 BA时,诱导效果并不理想,经过多次继代培养,愈伤组织仍然是非胚性状态,这说明较高浓度2,4-D抑制了愈伤组织向胚性化转变。为此,试验采用了较高浓度KT的配方:0.5 mg·L-1 2,4-D+1.0 mg·L-1 KT,经过2次继代培养后这时其诱导的愈伤组织,通过显微镜可以看到,愈伤组织细胞基本转变为胚性细胞,因此选用此培养基配方可以获得理想的绒毛白蜡胚性愈伤组织。
3 结论与讨论
培养基的组成对诱导绒毛白蜡胚性愈伤组织的影响较大。本试验3种基本培养基中,WPM培养基的愈伤组织诱导率最高。如本试验中选用的WPM培养基适合绒毛白蜡愈伤组織诱导和外植体生长,而MS培养基则表现出高盐的毒害作用。郭静等[16]发现WPM是适合植物组织培养的一种培养基,这与本试验研究一致。
其次,生长调节剂的种类和浓度也对愈伤组织胚性化有影响[17-19]。分裂素有利于愈伤组织胚性化,因此在诱导愈伤组织胚性化时,一般会使用细胞分裂素。本试验采用BA和KT这两种分裂素来诱导愈伤组织胚性化的发生。本试验中除了使用分裂素,还用到了2,4-D,一般说来,2,4-D会抑制愈伤组织胚性化,因为这种激素会抑制细胞分化,然而胚性化就是一种非常复杂的分化过程,如果没有2,4-D,愈伤组织首先会组织化,转变为一些成熟组织,如导管和木质部,因此为了抑制愈伤组织的分化,必须要使用2,4-D;为了获得胚性化的愈伤组织,就必须选择适宜的分裂素与2,4-D的比例,从本试验结果可以看出,较高的分裂素与2,4-D的比值会促进愈伤组织胚性化。在愈伤组织诱导的研究中,2,4-D浓度变为1 mol·L-1时,会出现褐变、对外植体产生毒害现象;GA3浓度变为1 mol·L-1时,也会对外植体产生严重的毒害现象。所以,选择适宜的生长调节剂浓度对胚性愈伤组织诱导很重要。
松散型胚性愈伤组织中处于胚性阶段的细胞显著多于紧密型愈伤组织;而且松散型胚性愈伤组织结构松散,使其每个细胞具有高度的同一性[20],可以提高遗传和转化效率,还易于再生;采用松散型胚性愈伤组织作为诱变材料可以获得更高的诱变率;采用松散型胚性愈伤组织相比普通胚性愈伤组织简化了脱毒步骤,节省了时间,提高了效率。
继代培养中不同培养基配比也起到了重要的作用。其中最适宜继代培养的培养基配方:2.0 mg·L-1 6,BA+0.1 mg·L-1 NAA。在继代培养中,部分愈伤组织出现褐化现象。相关研究表明,褐变主要由苯酚氧化形成,在多酚氧化酶作用下形成喹诺酮。褐变现象的出现与消毒剂和消毒时间、培养基组成和环境密切相关[21]。在后续试验中,可以去研究如何抑制在继代培养中愈伤组织褐化[22]。
由于本试验只研究到了诱导胚性愈伤组织,为绒毛白蜡的无性快速繁殖、体细胞诱变与遗传转化奠定基础,尚未对绒毛白蜡的再生进行讨论研究。因而,关于绒毛白蜡胚性愈伤组织的体细胞胚发生,有待进一步研究。
通过以上试验,笔者基本建立了绒毛白蜡胚性愈伤组织诱导的一般方法,现将具体试验步骤总结如下:先选择生长良好的绒毛白蜡组培苗,剪取细嫩的茎段,茎段不要木质化;将处理好的茎段外植体接种到WPM+0.5 mg·L-1 2,4-D+5 mg·L-1 GA3+30 g·L-1蔗糖的培养基上,在采用连续光照,光照强度为1 000 lx,培养温度为24 ℃的条件下进行愈伤组织初步诱导;经过大约40 d的诱导,就可以获得生长良好的绒毛白蜡愈伤组织,将愈伤组织团切成直径0.25 cm3大小的小块,接种到MS+0.5 mg·L-1 2,4-D+1.0 mg·L-1 KT+30 g·L-1蔗糖的培养基上,在采用连续光照,光照强度为1 000 lx,培养温度为22 ℃的条件下进行胚性愈伤组织诱导;经过3次继代培养,每次继代时间为10 d,并结合显微镜检,就可以获得理想的绒毛白蜡胚性愈伤组织。本试验结果可以为绒毛白蜡组织培养和遗传育种研究提供参考。该试验以绒毛白蜡茎段为外植体成功诱导出绒毛白蜡胚性愈伤组织,为之后的体胚诱导奠定了基础,为绒毛白蜡大规模无性繁殖和遗传转化提供了基础。
参考文献:
[1] 王因花, 燕丽萍, 孔雨光, 等. 绒毛白蜡组培快繁研究[J]. 中国农学通报, 2019, 35(14): 41-46.
[2] 王磊, 李淑娟, 徐云刚, 等. 绒毛白蜡成熟胚和茎段培养繁殖体系的建立[J]. 林业科技, 2008, 33(3): 1-3.
[3] 陈红. 植物组织培养技术的现状及发展趋势[J]. 生物化工, 2018, 4(5): 137-139.
[4] 许丁帆, 刘艳军, 陶则满, 等. 丝棉木松散型胚性愈伤组织的诱导与增殖[J]. 西部林业科学, 2021, 50(4): 74-79.
[5] PREECE J E, BATES S. In vitro studies with white ash (Fraxinus americana) nodules[M]//AHUJA M R. Woody Plant Biotechnology. New York: Plenum Press, 1991: 37-44.
[6] 張丽杰, 赵丽蒙, 陆秀君, 等. 水曲柳子叶和下胚轴愈伤组织和体胚的诱导[J]. 分子植物育种, 2015, 13(7): 1645-1652.
[7] 孔冬梅. 水曲柳体细胞胚胎发生及体细胞胚与合子胚的发育[D]. 哈尔滨: 东北林业大学, 2004.
[8] 董社琴, 李冰雯. 对节白蜡愈伤组织诱导的研究[J]. 安徽农业科学, 2008, 36(26): 11228-11229.
[9] 王彩云, 白吉刚, 杨玉萍. 对节白蜡的组织培养及植株再生[J]. 植物生理学通讯, 1999, 35(4): 299-300.
[10] 叶景丰, 马冬菁, 陈罡, 等. 美国白蜡组培快繁技术研究[J]. 林业实用技术, 2010(11): 30-31.
[11] 咸洋, 韩彪, 穆艳娟, 等. 绒毛白蜡组织培养研究[J]. 安徽农学通报, 2020, 26(8): 16-17, 32.
[12] 陈之群, 刘志敏. 绒毛白蜡茎段的组织培养及植株再生[J]. 安徽农业科学, 2006, 34(3): 472-473.
[13] 宁苓. 绒毛白蜡组培快繁技术研究[J]. 辽宁林业科技, 2018(4): 36-37.
[14] 许丁帆, 刘艳军, 王赵囡, 等. 绒毛白蜡组培快繁体系的建立[J]. 北方园艺, 2021(19): 78-83.
[15] 燕丽萍, 李丽, 刘翠兰, 等. 绒毛白蜡体胚诱导和植株再生[J]. 植物学报, 2016, 51(6): 807-816.
[16] 郭静, 柴慈江, 史燕山, 等. 苹果砧木G.11试管苗增殖与生根培养研究[J]. 天津农学院学报, 2019, 26(4): 38-42, 48.
[17] 孔祥生, 张妙霞, 陈明灿. 生长素类物质对甘薯茎尖分生组织培养成苗的影响[J]. 山地农业生物学报, 2003, 22(2): 114-116.
[18] 周索, 李景照. 不同类型生长素及浓度对翠菊叶片愈伤组织诱导的影响[J]. 郑州师范教育, 2012, 1(4): 52-53.
[19] 李琴, 江千涛, 魏育明, 等. 生长素对小麦幼胚组织培养的影响[J]. 西南农业学报, 2006, 19(5): 806-810.
[20] 苗博瑛, 刘艳军, 杨静慧. 黑莓松散型胚性愈伤组织的诱导[J]. 山西农业科学, 2014, 42(3): 209-212, 216.
[21] 吕国昊, 赵杰堂. 植物组织培养中褐化现象的控制措施[J]. 农村经济与科技, 2021, 32(13): 50-52.
[22] 亓峥, 庞志强, 蓝增全. 云南小叶种茶树叶片和茎段愈伤组织诱导及继代培养[J]. 科学技术与工程, 2020, 20(18): 7206-7212.

