猪妊娠:早期生命之路
周 琳,郭仕坤(编译)
(1.深圳比利美英伟营养饲料有限公司,广东 深圳 518103;2.定远县农业农村局三和集镇畜牧兽医站,安徽 滁州 233200)
在养猪生产中,繁殖效率是重要的经济指标,通常以PSY指数来评估。影响PSY指数的2个主要变量是每头母猪年分娩窝数与窝断奶仔猪数。其中,窝断奶仔猪数取决于窝产仔数与断奶前死亡率,而母猪年产窝数则取决于妊娠和哺乳周期以及非生产天数。反过来,窝产仔数也受到排卵率、受精率、精子特性和分娩前死亡率(如胚胎与胎儿死亡率)的影响。分娩前死亡率对于窝产仔猪数影响最大(占约40%)。胚胎死亡的影响因素非常复杂,可能的互作机制还需要持续进行研究。
在过去的20年中,母猪子宫容量成为窝产仔猪数的限制因素之一。高产母猪的选育,间接提高了排卵率、降低了分娩前损失率、促进了胚胎早期的生长发育。高产虽然为工业化养殖带来了窝产仔猪数和上市头数的高收益,但损失也在增加。例如,较低的仔猪初生重和窝内仔猪均匀度。低初生重意味着低初乳摄入量、断奶前高死亡率、后续生长性能受限和较差的肉质。
从繁殖效率来说,产前损失对于窝产仔数的影响巨大。因此,了解影响胚胎发育和胎儿生长的因素至关重要。文章主要综述三方面内容:首先,胚胎发育早期,包括定植前和定植阶段;其次,胎盘及其在胎儿发育中的作用;最后,宫内生产受限对养猪生产全链条产生的持续影响。
1 早期胚胎发育
繁殖功能正常的母猪会产生健康的雌配子,等待受精并发育成为胎儿。妊娠建立是一个极其复杂的生物过程,母猪妊娠后其黄体和子宫内膜会发生一系列改变,而这些改变取决于产前发育阶段:胚胎、定植前和胎儿阶段。早期胚胎发育非常关键,下面主要讨论影响胚胎存活的因素。
受精发生在输卵管的壶腹部连接处,如果卵细胞发育不成熟,在受精和胚胎发育早期会产生畸形。2细胞阶段会维持6~8 h,4细胞阶段持续20~24h。大多数胚胎在4细胞阶段进入子宫,即排卵后大约48~56 h。胚胎的RNA合成开始于4细胞阶段,因为此时胚胎基因组开始参与蛋白合成。这被看作是从母体到胚胎自身控制发育的转变与过渡。接下来的2~3 d,胚胎在整个子宫中均匀分布之前,胚胎存在于子宫角近端部分。在猪体中,囊胚阶段为第5~6天,此时每个猪胚胎由16~32个细胞组成(见图1)。胚胎由覆盖在其上的糖蛋白进行滋养,即配种后第6~7天形成的透明带。第12天胚胎进入两边子宫角并均匀分布。转移完成后,胚胎延长的同时滋养层黏附于子宫内膜表面,不与临近的胚胎有重叠。在胚胎阶段,大多数基因表达会丧失细胞分化多能性。现已研究证实,Oct4是细胞分化多能性的关键因子。它在胚胎细胞分化和早期发育中,与DNA结合作为基因激活子或者抑制子。猪体中,Oct4在滋养层和内细胞中表达,配种后第10天可以检测其存在。其他转录因 子,如NANOG、SOX2以 及GATA6也可以在猪胚胎的ICM中检测到,但上述因子的调节机制依然需要进一步研究。
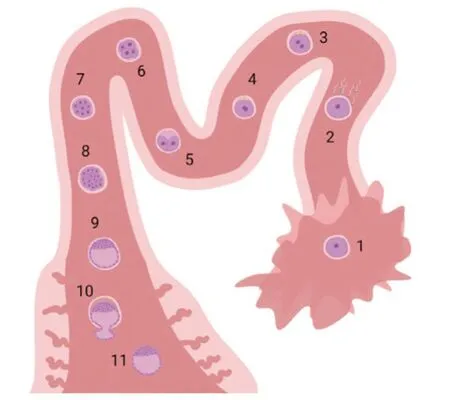
图1 围定植期胚胎发育
现已有研究证实,在猪体中,定植前胚胎损失是产前损失的最大部分。然而,在大多数现代母猪中,显著提高的排卵率会大幅提高定植前阶段胚胎存活率,通常很大程度上超出子宫容量。因此,在妊娠40~50 d存活胎儿数量会大幅下降。
环境因素也会影响定植前的胚胎存活率。Vinsky等人提供的一手证明材料显示,限饲会导致妊娠前期30 d胚胎损失率增加,尤其是雌性胎儿。以上研究表明,卵细胞的表观遗传学缺陷中,限饲的时间正好与卵细胞成熟的最后阶段重合,是产前选择性损失雌性胎儿的原因。
卵细胞发育竞争的易变性,既与胚胎异步发育有关,也是决定胚胎存活的关键因素。实际上,哺乳动物的子宫在繁殖生物学中起着重要作用。其为胚胎和胎儿发育提供场所与优良的生长环境。子宫内膜会合成并分泌特定产物,如蛋白(子宫运铁蛋白、视黄醇结合蛋白、生长因子、血浆素/胰蛋白酶抑制剂、吗啡样肽)和前列腺素。这些子宫内膜分泌的蛋白等营养物质用于胎儿发育。因此,调控内膜分泌上述蛋白和其他内膜蛋白的因子,很可能影响到胎儿的发育效率。
2 定植和妊娠阶段的母体识别
在透明带滋养下的妊娠第11~12天,猪胚胎从9~10 mm的球形阶段快速延伸成为1 000 mm的长丝状。妊娠的第2周是猪胚胎存活最为关键的阶段。此时,胚胎雌激素合成开始,胚胎间隔和定位完成,母体接收到延长黄体功能的信息。猪的母体识别发生在发情后第11~12天。之前也有研究表明,猪胚胎会通过合成和释放雌激素传达信息给母猪,以示自身的存在,也可能是有其他能够与母体互动的物质,使得怀孕得以持续进行。另一方面,目前的研究报道证实,胚胎产生雌激素并不是定植前发育、胚胎延长和早期黄体维持的必需因素,但对于胚胎妊娠30 d以后的维持是极其必要的。此外,由胚胎分泌的前列腺素E2(PGE2)可能与雌激素一起对母体发出妊娠识别信息。因此,母体妊娠识别可以认为是在排卵后胚胎延长黄体功能期的一种方法。Cardenas和Pope报道,延迟配种会影响囊胚的大小及其分泌雌二醇,但不影响其形态多样性。另外,在此阶段母猪至少要有4个胚胎成活,否则黄体将会退化导致妊娠终止。
母体以雌激素作为识别信号的主要机制可能是子宫释放内膜前列腺素(PGF2α)的减少。在发情周期中,内膜以脉动形式分泌PGF2α进入子宫静脉中(内分泌方向),引起黄体溶解。在妊娠中,胚囊雌激素与内膜互动改变内膜PGF2α的分泌方向进入子宫内部(外分泌方向)。最终,离开子宫的血液中PGF2α浓度降低,黄体维持不会溶解(见图2)。
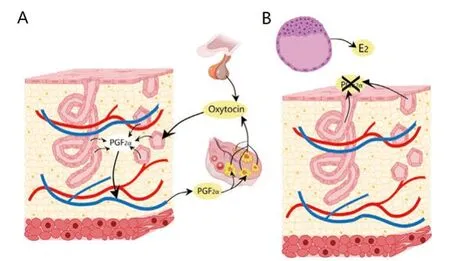
图2 妊娠母体识别:黄体功能周期建立于排卵之后被胚胎延长。胚胎产生改变PGF2α(前列腺素F2α)路径的雌二醇,从而阻止黄体溶解
此外,Carnahan等人证实,在猪中催产素刺激PGF2α的分泌。妊娠早期,催产素诱导子宫内膜释放PGF2α进入子宫血管系统受到抑制,黄体功能得以维持。PGF2α与PGE2一起作为胚胎信号的调节者,可刺激内膜血管形成和黄体-母体互相作用。
雌激素还能够增加许多子宫内膜基因的表达,如成纤维细胞生长因子7(FGF7)、分泌磷蛋白1、信号转换子、转录1激活子(STAT1)、溶血磷脂酸受体3、斯钙素1、白细胞介素1、瞬时受体电位阳离子通道、亚家族V、受体辅助蛋白(IL1RAP)和醛酮还原酶家族1等。延长后的猪胚胎也会分泌细胞因子,包括IL1B2、INFG和IFN-δ。因此,胎儿分泌的雌激素、IL1B2和IFNG的协同作用,刺激子宫内膜对来自于胎儿的IFNG与IFND做出反应,这是母体妊娠建立的关键所在(见图3)。
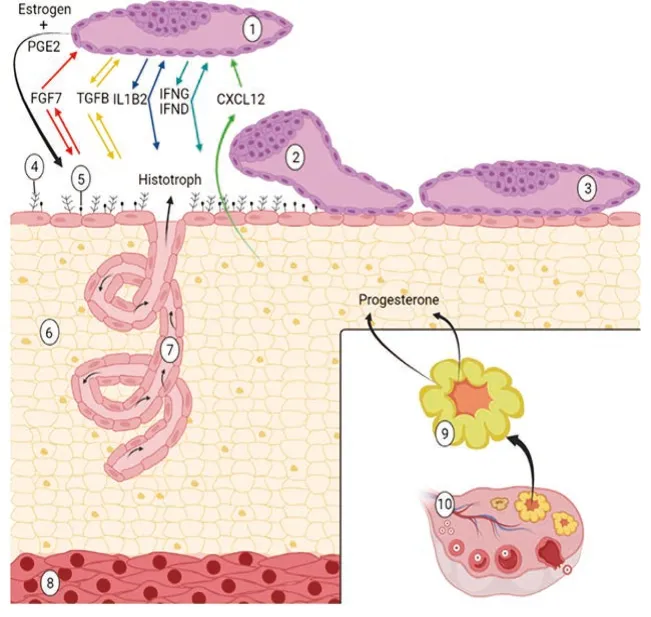
图3 围定植期:在猪体中胚胎延伸和定植受来自于内膜层的分泌物调控,来自于卵巢的孕酮、胚胎的雌激素、IL1B2、IFND、IFNG、TGFB和 内 膜 层 的TGFB、FGF7、CXCL12。内膜和胚胎基因,分化调节这些因素。编码蛋白包括作用于内膜的转运子、酶、生长因子、转移和黏附因子,能够改变组织营养质组成和子宫宫腔表皮顶端(下调抗黏附因子mucin:Muc-1黏附整合蛋白)以支持胚胎存活,如直接作用于胚胎刺激其生长、发育、分化和在围定植期黏附子宫宫腔表皮。有效证据显示,这些过程需要孕酮、雌 激 素、IL1B2、,IFND、IFNG、TGFB、FGF7和CXCL12等联合才能促进胚胎良好发育、内膜功能及定植。
定植是囊胚附着在子宫合适位置上,胚胎与母体之间建立循环传递的过程,从而建立功能性胎盘和成功妊娠。定植包括3个阶段:胚胎延长、黏附、胚胎与子宫内膜表皮融合,同时表达许多因子,包括生长因子、促进黏附的分子和细胞因子。所有的上述过程都在不同的脂类和激素调控下进行,特别是孕酮、雌二醇和前列腺素,在胚胎发育、内膜修饰和胚胎-母体交流之间许多必需蛋白的表达都受这些激素的调节。在围植入期(peri-implantation),宫腔表皮和胚胎滋养层同步发展出黏附能力,从而启动黏附过程的级联放大。因此,胎儿需要去除位于宫腔表皮上的覆有外被多糖的抗黏附分子(mucin1:Muc-1),从而暴露出整合粘连蛋白,促进胚胎黏附,这是子宫接受胚体的“窗口”。在其他物种中,胚胎会持续入侵表皮屏障直到妊娠建立。
滋养层-内皮黏附过程受调节血管形成和细胞移动性的生长因子调节。在这些生长调节因子中,在胎儿发育过程中与血管形成有关的血管内皮生长因子(VEGF),与妊娠85~105 d的胎儿体重相关。此外,转化因子超家族(TGF)是调节胚胎分化和成熟的转录因子。在猪体中,TGF-β的表达在胚胎延伸和定植前会增加,这是母体子宫内膜与胎儿之间建立交流的必要条件。
此外,细胞因子是一类被不同类型细胞产生的蛋白和糖蛋白、肿瘤坏死因子、干扰素、集落刺激因子(CSFs)和趋化因子等,作为免疫和炎症反应的调节子,对于母体-胚胎识别非常关键。大约妊娠第12天,猪胚胎会分泌能够调节定植期间子宫内膜免疫性的IFNs和IL(1B和6)。特别是白细胞介素1β(IL1B2)在妊娠第12天的猪胚胎中表达提高,这表明胚胎延伸和黏附子宫内壁需要这些细胞因子。最近研究显示,在妊娠阶段,子宫内膜和胎儿组织以细胞特性方式表达CXCL12和其受体CXCR4。此外,CXCL12的表达受IFN-γ的诱导,而IFN-γ在滋养层细胞迁移和招募CD4+、CD8+和CD4+CD8+ T细胞进入子宫内膜。上述研究结果表明猪的胎盘属于上皮绒毛膜胎盘类型,胎儿发育调节与母体对干扰素的免疫反应都在母体-胎儿连接点进行。
因此,胎儿IL1B2和IFNs很可能通过子宫表皮和基质激活MAPK、NFKB和JAK-STAT信号通路创造了促炎反应平衡的微环境。白细胞介素-1 β2可以在胎儿内引发类似途径,促使胚胎生长和快速延伸。此外,其他炎性调整因子如LIF、IL6、IL8和PG可以促进维持此环境,有助于胚胎存活和妊娠建立。
尽管如此,生长因子、白细胞介素、干扰素和化学因子对胚胎早期存活非常重要,黄体因其影响着孕酮合成与分泌的卵巢结构,在此过程中也起着关键作用。特别需要强调的是,颈静脉采血不能检测到脉冲式孕酮水平,而后大静脉局部采血可以检测到。由于孕酮在肝脏代谢,涉及全身系统的颈静脉中浓度很低。从这方面讲,研究卵巢孕酮分泌量时,采样应尽量采集靠近分泌部位的血样。
与其他哺乳动物不同,不论胎盘是否需要猪在整个妊娠期维持黄体。妊娠期间足量孕酮能够诱导子宫内膜间质分化、腺体分泌和胎盘形成,这对胎儿存活和发育至关重要。在妊娠11~21 d间,周期黄体(cyclic corpus luteum)到妊娠黄体(gestational corpus luteum)的转变维持孕酮分泌,是胚胎持续阶段成功建立的必要因素。孕酮分泌是胚胎存活的关键,因其直接作用于子宫内膜,特别是腺体和腔表皮,刺激组织营养物质分泌,激素、酶、生长因子、细胞因子中,蛋白、黏附因子、营养物质和其他物质的复合物,这些物质在提供胎儿营养、定植和胎盘形成中起重要作用。Lee等人在研究卵泡期和黄体期组织营养中的蛋白表达时发现,黄体期VEGF、G2COP、COL4、CRP2、MYG和FUT4的表达水平升高。这表明在黄体期内,子宫中血管生成,细胞内质网和高尔基体之间的蛋白转移,胞外基质和血管平滑肌增殖,氧转运等都被激活。
3 胎盘
胎盘是母体与胎儿之间营养物质、代谢物和呼吸气体交换的关键器官。胎盘还产生激素、细胞因子和其他影响整个妊娠期胎儿生长发育的调节分子。猪的胎盘为弥漫型、互为折叠、非入侵性的上皮绒毛膜胎盘,胎儿组织不会入侵进入母体内膜或发生内膜蜕膜。
上皮绒毛膜胎盘是最为表层的非入侵型胎盘,整个妊娠期子宫宫腔表皮保持完整。猪子宫中的上皮绒毛膜胎盘由6层细胞组成(母体内皮血管、连接组织、内膜表皮、滋养层表皮、连接组织和胎儿内膜血管)。滋养外胚层直接黏附于宫腔表皮,作为胎儿生长发育的母体血液滋养和组织营养支持通道(见图4和图5)。
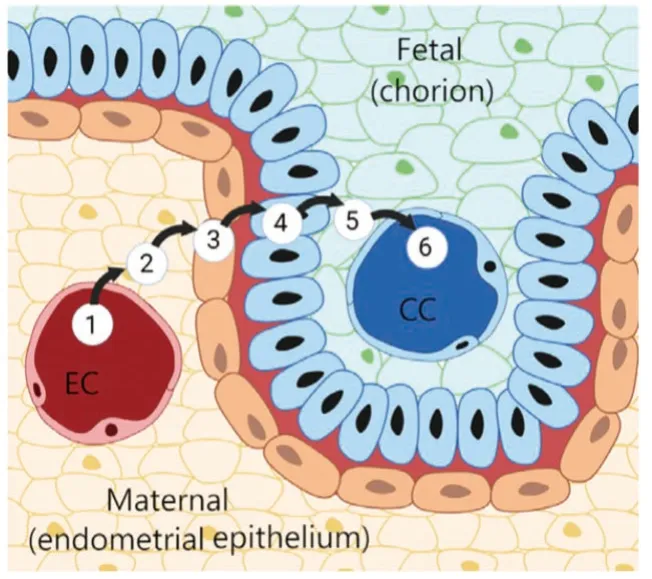
图4 猪上皮绒毛膜胎盘,由6个细胞层组成
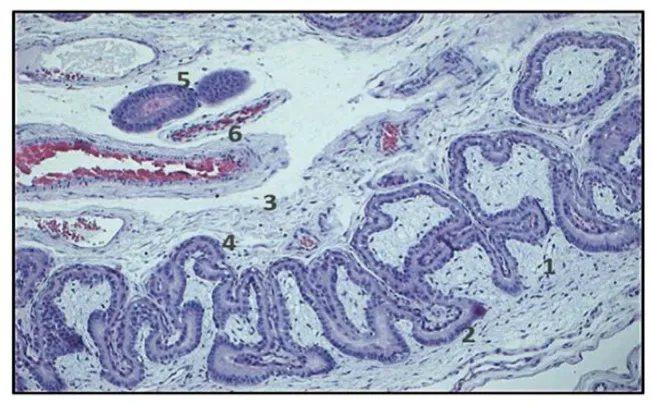
图5 猪妊娠45 d母体-胎儿洁面光学显微镜观察,HE染色
胎盘形成起始于定植期,此时特殊细胞黏附和细胞转移,引导和促使滋养层细胞黏附于宫腔内膜表皮上。在妊娠第18~30天,黏附过程进展迅速,发育出绒毛膜(滋养层)和尿囊;妊娠第30~60天,绒毛膜和尿囊的融合;第60~70天,可根据重量、表面积和胎盘空隙(placental areolae)等指标判断胎盘发育成熟度。绒毛膜脊和相应的内膜凹陷的形成导致折叠,这些折叠则可以增加母体-胎盘之间联系交流的表面积。在妊娠第30天,双层表皮(滋养层与内膜表皮)可以形成更多的胎盘折叠。随着妊娠进行,这些折叠变得更为复杂和延长。抑制腔表皮和滋养层细胞可以缩短母体与胎儿血液之间的距离,因此可以减少交换物质穿越胎盘的扩散距离(见图6)。
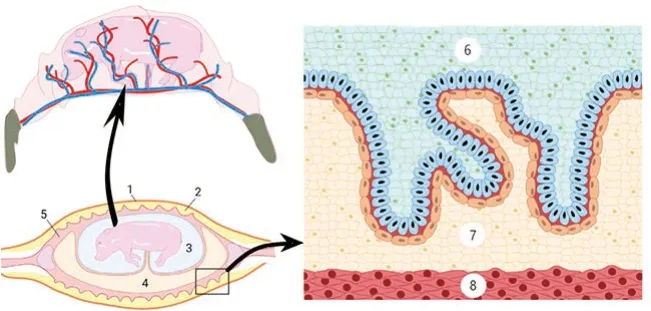
图6 猪胎盘绒毛膜表面(chorion)上布满绒毛膜绒毛(chorionic villi),形成胎儿-母体交界面
胎盘折叠形成2种胎盘滋养层细胞:柱状滋养层细胞(位于胎盘折叠的顶部)和长方体细胞(位于胎盘折叠的底部与侧面)。之前的研究表明,肝素酶存在于长方体细胞内。这些酶能够在细胞移动时修饰胞外基质和基底膜,这表明长方体细胞在胎盘折叠的形成和发育过程中起着重要作用。其他研究报道,在胎盘折叠发育过程中,除了丝氨酸蛋白酶抑制剂,HAI-1等重要分子中,长方体细胞的增殖和移动增加,调节滋养层细胞增殖。
除了在胎盘折叠中起作用,长方体细胞还与猪胎盘的机械力有关,这涉及到胎盘折叠发育过程中形态改变,影响肌动蛋白在子宫宫腔上皮细胞与滋养层表皮细胞之间聚集,纤维原细胞(fi broblast)分化成为肌成纤维细胞(myofi broblast)和扩大上皮下的血管。此外,胎盘折叠的形成能够增加母体-胎儿互动的表面积,从而提供胎儿生长发育的充足营养。因此,胎盘折叠对胎盘效率(placental effi ciency)有重要影响。
4 宫内发育迟缓
宫内发育迟缓(intrauterine growth restriction,IUGR)是 指 哺乳动物胚胎或胎儿在妊娠阶段不能充分发挥它们的生长潜能。早产胎儿的胎龄非常重要,一种情况妊娠提前终止,此时胎儿往往还没有达到足够的胎龄;另一种情况宫内发育迟缓,但已妊娠到期满。在人类中,宫内发育迟缓和早产是全球范围内婴儿死亡率的两个重要因素。
在多胎物种中,如猪,宫内发育迟缓主要通过个体初生重判断。猪的宫内发育迟缓在自然情况也是存在的,但严重的IUGR是养猪生产的主要问题,因为低初生重会造成断奶前仔猪高死亡率和发病率,以及终生生长性能较差和发育不佳。最近的数据显示,15%~25%的仔猪初生重低于1.1 kg,这表明高产仔增加了低初生重仔猪的比例。繁殖效率的提升造成胎儿数量的增加,而子宫容量有限造成窝内个体体重均匀度差异变大。胎儿数量与胎儿生长之间呈负相关,胎儿数量越多,胎儿个体发育越差。随着窝产仔数增加,每个胎儿平均分配到的血流数量越少。此外,子宫容量能够在妊娠30 d起就影响胎儿的产前生长,也决定了胎儿体重变异程度,而这种体重差异会随着妊娠的推进越来越大,最后造成较小体重胎儿比例增加。
在产前生长受限的动物,表现除大脑外,内脏器官均较小,这就是脑保护效应。因此,判断IUGR的有效方式就是大脑与肝脏的比例。在正常胎儿中,肝脏重量稍重于大脑,因此大脑与肝脏的比例小于1。
证据表明,除了增加死亡率与发病率,IUGR对于特定生长性能如饲料转化率、体组成和肉质具有永久性影响。因此,这对于任何养殖动物生产都非常重要,而低初生重仔猪引起经济损失主要有2个原因:1)低初生重动物的死亡率高;2)动物综合生产性能差,如低日增重、饲料转化率不佳和低瘦肉沉积效率。
5 胎盘与宫内发育迟缓
胎盘是母体与胎儿之间的主要联系纽带,负责营养物质、代谢物和呼吸气体交换。交换主要由动脉、静脉和毛细血管组成的血管网络进行。因此,胎盘不能有效运输营养物质会直接影响胎儿发育,与胎盘血液流动、胎盘重量和胎儿重量相关,是引起IUGR的主要因素。
胎盘血管化主要有助于胎儿生长发育的均一性。约克夏母猪的胎盘在妊娠期间大小和面积在持续增长,直到妊娠期的后三分之一才停止,因此形成胎儿之间对营养竞争的环境。而眉山猪在妊娠期间则不改变胎盘大小,其胎盘血管密度显著增加。更好的胎盘血管化能够增加母体-胎儿的物质交流,有利于胎儿更加有效和均匀生长。因此,胎儿占据有利位置,确保充足的胎盘血流对于胎儿发育非常关键。
除了血管化,胎盘结构也必须有助于效率的提升。最近的实验室研究表明,子宫胎盘形态功能在妊娠第30天、45天、60天和90天发生改变,这与胎儿性别和大小有关。在妊娠第30天,较小的胚胎的绒毛膜折叠稍微多些,而在妊娠第45天和60天,滋养层表皮的绒毛膜折叠在较大胎儿中更多些。此外,较大雌性胎儿与母体之间的接触界面上围内膜血管(peri-endometrial)的比例更高,也有数据证实在妊娠第45天,较大胎儿的围内膜血管的数量更多。当然,这可以解释为:由于更高比例的血管数量可以提供更充足的营养,因此可以促进胎儿生长和提高胎儿体重。相反在妊娠第45天,不管胎儿体重大小,雄性胎儿的母体-胎儿交界面上具有较大的内膜腺体。较大的内膜腺体对胎儿有利,特别是雄性胎儿,因为其全面发育需要更多的营养物质。因此,胎盘形态功能的不同不但影响胎儿体重,还会影响雌雄不同性别。
虽然对猪的产前死亡率的影响因素做了广泛研究,仍有很多问题还未找到答案。其中,子宫容量在胎儿优势和存活率方面具有最重要的影响。所有相关问题探索与解决,都会帮助调整母猪妊娠阶段良好的管理措施,以降低产前死亡率。
原文题目:《Pregnancy in pigs: the journey of an early life 》
原文作者:F.R.C.L. Almeidaa, A.L.N. Alvarenga Dias b
原文出处:《Domestic Animal Endocrinology 》78 (2022) 106656