褐飞虱致害性变异机制研究进展
袁龙宇,李燕芳,肖汉祥,齐国君,张振飞
(广东省农业科学院植物保护研究所,广东省植物保护新技术重点实验室,广州 510640)
尽管目前有各种各样的植物保护方法,但是昆虫和病原体仍然造成了世界作物至少15%的损失(Oerkeetal., 2006)。为了控制害虫侵害,确保粮食供应,抗虫作物品种的推广作为一种经济且环保的措施得到了广泛关注。然而在实际的应用中发现,植食性害虫能够克服寄主的抗性,使害虫种群致害寄主的能力逐渐增强,造成抗虫品种使用年限缩短。褐飞虱Nilaparvatalugens是水稻重大害虫之一(娄永根和程家安, 1997)。培育并推广抗褐飞虱水稻品种是控制该重大害虫的重要绿色防控手段,但田间褐飞虱种群只需要经过7~10代的选择即可适应抗虫水稻品种(Itokawa and Kisimoto, 1981; Pathak and Heinrichs, 1982)。例如,自国际水稻研究所推广应用第1个抗褐飞虱水稻品种IR26(含抗虫基因Bph1)以来,不断出现新品种抗性下降乃至抗性完全丧失的现象。由于上述的原因,导致了以下两种后果:一方面不断产生新的致害型害虫种群,另一方面导致抗虫品种的使用寿命缩短,已成为该虫高效治理的主要障碍(Kobayashi, 2016)。在早期的相关研究中,国内外昆虫学家使用生物型(biotype)来区分褐飞虱对水稻致害性不同的个体或种群,不同的“生物型”往往拥有相似的形态特征但却具有对水稻不同的致害表型(Claridge and Den Hollander, 1983)。随着研究的深入发展,学者们发现褐飞虱致害性的增强实际上应该是一种适应性进化的现象,具体来说是褐飞虱在这种适应性进化过程中,与致害性相关的某些等位基因频率发生变化,因此可以将这些等位基因作为褐飞虱致害性相关的分子标记(Kobayashi, 2014)。目前,不仅有使用分子标记的方式来解释褐飞虱致害性表型内在机制的探索,同时还有许多褐飞虱致害不同抗虫水稻品种的致害性变异的分子机制研究。本文在此基础上综述了褐飞虱致害性变异的遗传基础、分子标记、变异的主动机制和被动机制,不仅有助于揭示褐飞虱与水稻的互作机制,而且有助于我们更好理解褐飞虱对寄主水稻的适应性机制,对延长抗虫水稻品种的使用寿命、做好褐飞虱的致害性监测以及制定褐飞虱可持续防治策略制定均有重要意义。
1 致害性变异的遗传基础
昆虫的致害性是指昆虫对寄主植物的致害能力,致害性个体可以在寄主植物上存活并为害,而非致害性个体则不能存活为害(黄富, 1989)。致害性作为反映昆虫适应寄主植物选择压力程度的一种性状,其形成过程有时也会伴随着适合度代价,如蜜露量(Panguiaetal., 1980)和存活率的降低(俞晓平等, 1993)。
不同生物型个体一般具有相似的形态特征但对相同寄主植物产生不同的致害特性(Claridge and Den Hollander, 1983)。有不少研究显示,许多致害性变异的现象在多种植食性昆虫中均有发现(纪锐, 2013),其中包括褐飞虱Nilaparvatalugens、稻瘿蚊OrseoliaoryzaeWood-Mason、小麦黑森瘿蚊Mayetioladestructor、烟粉虱Bemisiatabaci、麦二叉蚜Schizaphisgraminum等种类。在上述的种类中,相关研究鉴定出不少的致害性变异种群,其中麦二叉蚜12个,稻瘿蚊14个,小麦黑森瘿蚊13个,烟粉虱24个,而在褐飞虱中鉴定出11个致害性变异种群(Thongphaketal., 1999; Katiyaretal., 2000; Shufranetal., 2000; Sardesaietal., 2001; 程遐年等, 2003; 张扬, 2005; 罗晨, 2005)。
关于褐飞虱生物型的提出,最早始于1971年,国际水稻研究所于菲律宾吕宋岛多个地点采集的褐飞虱在TN1和Mudgo水稻上饲养时,发现不同种群在Mudgo上的存活率存在显著差异(Athwaletal., 1971)。随后,通过把田间采集的褐飞虱在多种不同抗虫品种水稻上饲养,相继发现了能适应TN1、Mudgo、ASD7和Rathu heenati等抗虫品种的褐飞虱生物型I、生物型II、生物型III和生物型IV(Claridge and Den Hollander, 1980; 张焓娇, 2018)。为了解释褐飞虱不同致害性种群的形成原因,国内早期研究中发现褐飞虱生物型I在抗性品种的连续选择下,其致害性逐步增强并形成能致害抗性品种的褐飞虱生物型II,而生物型II在感虫品种水稻饲养后,致害力会慢慢减弱,退化为生物型I,说明褐飞虱致害性在世代间是可变异的(肖英方等, 1994; 王桂荣等, 1999)。
早期的研究认为褐飞虱不同生物型与水稻抗虫品种之间存在“基因对基因”的关系,不同致害性的褐飞虱种群可以表示为不同生物型,主要是因为褐飞虱致害性由单基因控制(Barrion and Saxena, 1985; 刘芳等, 2003)。也有人认为单基因或微效多基因是昆虫克服水稻抗性的遗传机制(周金明, 2017)。随着研究的深入,目前越来越多的研究显示,褐飞虱对抗虫品种的适应实际上是受多基因控制的,在遗传中可以导致生物型的多基因型现象(Claridge and Den Hollander, 1983; Tanaka, 1999; Downieetal., 2010; Kobayashi, 2016)。
随着抗虫水稻中抗虫基因不断的被挖掘,目前已经有31个抗褐飞虱基因被发现,其中有3个基因被克隆(杜波等, 2018),并且不同的致害性种群在繁殖、交配选择等生理方面并无显著差异,所以“生物型”可能不适合来描述褐飞虱致害性的差异(Claridge and Den Hollander, 1983; 姜人春, 1999)。褐飞虱中不同“生物型”所指的种群只是在其对不同抗性品种寄主的致害能力上有区别,不同“生物型”种群对抗性品种寄主适应性的差别实际上是反映了种群中的致害性相关基因具有不同的等位基因频率(Downieetal., 2010; Kobayashi, 2016)。从种群遗传的角度来说就是,褐飞虱物种中包含了适应不同抗性品种水稻相关的等位基因,具有不同致害力的种群则是由种群中等位基因的频率改变而形成的(图1)。
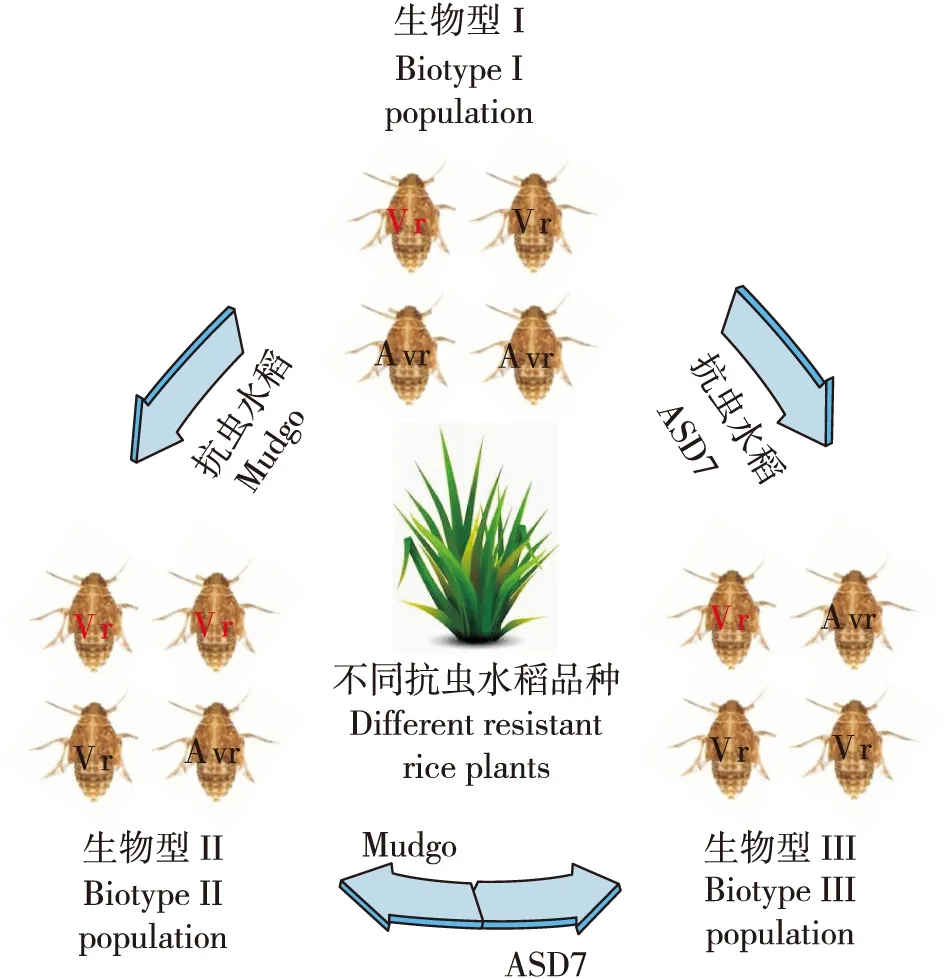
图1 褐飞虱致害性生物型种群和非致害性生物型种群转换示意图Fig.1 Transformation of different ‘Biotype’ populations contained both virulent and avirulent genotypes of brown planthoppers注:Vr,致害性基因型;Avr,非致害性基因型。Note: Vr, virulent genotype; Avr, avirulent genotype.
2 致害性变异的分子标记
物种的遗传性状是由其基因决定的,基因中DNA分子的碱基序列的变化也能影响遗传性状的变化。目前分子生物学技术的发展极大程度地促进了害虫致害性遗传机制的研究。为了比较具有不同致害能力的害虫个体或群体间在DNA水平上的差异,一些学者进行了寻找与致害性相关的分子标记的尝试。如通过随机扩增多态性DNA(Random Amplified Polymorphic DNA, RAPD)或线粒体DNA(Mitochondrial DNA, mtDNA)来区分麦二叉蚜的不同生物型(Aikhionbareetal., 1998; Aikhionbare and Mayo, 2000);用扩增的限制性内切酶片段长度多态性(Amplified Fragment Length Polymorphism, AFLP)作为标记来分析稻瘿蚊或烟粉虱生物型的转化(Behuraetal.,2000;Katiyaretal., 2000);用序列特征性扩增区域(SCARs)标记来检测稻瘿蚊的生物型(Behuraetal., 2000)。早期的研究在褐飞虱中通过RAPD方法,已发现不同致害性种群存在明显的遗传分化(王桂荣等, 2001; 傅强等, 2004)。近年来的相关遗传连锁作图研究,主要是基于简单重复序列(Simple Sequence Repeat, SSR)标记和单核苷酸多态性(Single Nucleotide Polymorphism, SNP)标记进行,从褐飞虱的染色体上也定位到了一些与致害性相关的DNA分子标记(Jingetal., 2011; Jairinetal., 2013; Jingetal., 2014; Kobayashietal., 2014)。用SNP作为分子标记去分析同种害虫致害性的变化,既能为快速准确检测提供便利,又有助于加深对害虫致害性进化遗传机制的理解(Morinetal., 2004)。Kobayashi等(2014)通过数量性状位点分析和BSA(Bulked Segregant Analysis)性状定位,获得了褐飞虱致害携Bph1抗虫基因水稻品种的5个SNP分子标记,发现这些标记位于一个隐性的致害性基因中。Kobayashi(2016)指出,致害性的进化实际上是由多基因共同控制的,在致害性进化中仍存在许多未知的遗传变异。
随着褐飞虱全基因组测序的完成(Xueetal., 2014),从全基因组范围去进一步寻找致害性相关的SNP分子标记是有必要的且在理论上也是可行的。通过对比高致害力RH-P和低致害力TN1-P两个褐飞虱群体在基因组水平、基因表达水平的联合分析后,发现影响褐飞虱对Bph3抗性基因水稻致害的基因主要集中在被动防御基因上,如P450基因、酯酶基因和表皮蛋白等(庞锐, 2017)。褐飞虱致害性重测序的基因组信息中,发现了有42种基因可能与褐飞虱致害性变异相关,而且通过RNAi的方式验证了其中变异程度高、受选择区域多的基因中有19种基因(P450, 神经肽受体F, innexin shaking-B蛋白等)影响褐飞虱在RH抗虫水稻上的致害性(袁龙宇, 2020)。因此致害性变异可通过相关的SNP分子标记进行有效监测,但现有的SNP分子标记信息仍比较欠缺。
3 致害性变异的主动适应机制
在数百万年的进化过程中,植物已进化出针对植食性昆虫的防御策略,这些策略导致基因组和代谢水平上的多种分子相互作用(娄永根&程家安, 1997)。生物体生存的能力取决于其对外部刺激快速有效的作出反应并可持续防御的能力。这些防御利用有毒化合物或使用机械防御结构(例如刺和毛)直接保护植物,或通过吸引食草攻击者的天敌或寄生虫的分子相互作用间接保护植物(Baldwin, 2010; Wu and Baldwin, 2010)。植物快速识别和响应草食动物的手段包括对寄主效应子的感知(Maffeietal., 2012)、各种信号离子的排出/流入(Bricchietal., 2013)、丝裂原活化蛋白激酶(MAPK)活化和蛋白磷酸化(Arimuraetal., 2011)、NADPH氧化酶的活化以及活性氧(ROS)和活性氮(RNS)的产生(Marinoetal., 2012)等。这些级联反应导致植物激素茉莉酸(JA)和水杨酸(SA)的产量增加(Consalesetal., 2012)、乙烯含量的增加(Scalaetal.,2013)、后期防御反应基因的表达与挥发性有机化合物的释放(Karbanetal., 2010)以及有毒化合物的生产(Karban, 2011)等。
昆虫在长期的适应性进化过程中可以通过其唾液中的某些成分来影响植物的防御,使其适应植物的抗性(Hogenhout and Bos, 2011),如图2。例如,在“植物-蚜虫”相互作用关系的研究中发现,蚜虫唾液中诱导子可刺激植物SA途径介导的防御反应关键酶基因表达(Moran and Thompson, 2001),这种刺激SA途径基因表达的现象,有可能导致对抗蚜虫更有效的JA途径基因表达的抑制(Zarateetal., 2007)。另外,谷实夜蛾Helicoverpazea的唾液葡萄糖氧化酶(GOX)可以抑制烟草中抗性物质烟碱的产生(Musseretal., 2002),同样的机制在蚜虫中也存在(Ejaouannetetal., 2014)。在刺吸式口器昆虫巢菜修尾蚜Megouraviciae、黑尾叶蝉NephotettixbipunctatusFabricius及褐飞虱唾液腺中还发现了一类能够结合Ca2+的蛋白,可以通过抑制胼胝质的形成来应对植物堵塞反应的策略(Willetal., 2007; Konishietal., 2009)。此外有研究显示,褐飞虱唾液中的某种成分能够激活水稻本身的β-1, 3-葡聚糖酶分解胼胝质,使褐飞虱能够顺利取食(Haoetal., 2008)。Huang等人鉴定出一种褐飞虱唾液鞘蛋白基因Nlshp,该基因的表达被dsRNA抑制后,褐飞虱唾液腺鞘在抗性水稻上不能正常形成,影响唾液的分泌,说明该蛋白在褐飞虱取食过程中起着关键作用(Huangetal., 2015)。Ye等人(2017)发现在褐飞虱唾液中存在一种钙离子结合蛋白NlSEF1,该蛋白能诱导水稻体内Ca2+和H2O2的升高,引起一系列水稻防御反应,导致褐飞虱的摄食和存活率下降。Shangguan等(2018)发现了褐飞虱分泌的另一类粘蛋白样蛋白(NlMLP)。NlMLP在褐飞虱唾液腺中高表达,在稻飞虱取食水稻过程中分泌到水稻组织内。NlMLP能诱导水稻细胞死亡,能上调水稻防御相关基因表达和胼胝质沉积。近期作者也发现一种唾液蛋白NlSP7能调控褐飞虱在不同抗虫水稻的取食行为影响褐飞虱的致害性,同时NlSP7还能够调控水稻麦黄酮代谢影响水稻防御反应(另文发表)。
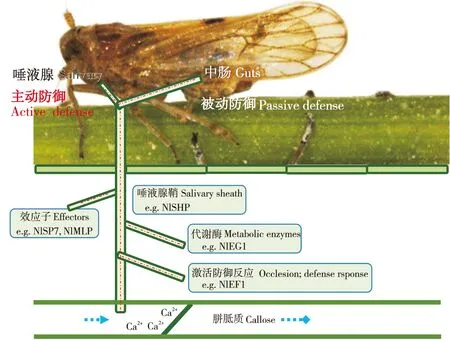
图2 褐飞虱唾液对植物防御反应的影响Fig.2 Influence of brown planthopper saliva on plant defense response
4 致害性变异的被动适应机制
当昆虫在取食植物过程中不可避免地摄取了寄主植物被诱导产生的毒性物质时,可以通过多种机制去适应这些毒性物质并形成抗性(Desprésetal., 2007)。这些致害机制中,由代谢酶减少摄入、增强对植物防御化合物的代谢能力或尽量排泄出去、以及降低害虫靶标对防御化合物的敏感性,在害虫致害寄主时起着更重要的作用(Uemuraetal., 2019)。
昆虫的中肠中包含多种与消化、解毒、糖代谢等相关的酶类,在昆虫与植物的相互作用中起到重要作用。2016年郑瑜从褐飞虱中肠转录组中筛选出与消化、解毒以及糖代谢等有差异表达的基因,成功克隆了18个重要的差异表达基因(郑瑜, 2016)。褐飞虱体内3种主要的解毒酶(P450、谷胱甘肽和ABC转运蛋白)和保护酶的活性在取食抗虫水稻品种后均会明显升高(吕仲贤等, 1997; 周亦红等, 2003; Yangetal., 2005; 刘玉坤等, 2011)。褐飞虱取食抗虫水稻品种YHY15(含抗褐飞虱基因Bph15)后,3个P450基因(CYP4C61、CYP6AX1和CYP6AY1)的表达量上调,RNAi结果表明:CYP4C61可促进褐飞虱在YHY15上取食(Pengetal., 2017)。谷胱甘肽S-转移酶也被证实参与褐飞虱对寄主植物的适应(Sunetal., 2013)。为探索害虫适应抗虫作物的潜在新基因,转录组等组学技术的应用不断增多。Zhang等(2019)利用敏感水稻品种Nipponbare和Bph6转基因抗虫水稻品种以及最新的测序技术,鉴定出1 893个差异表达基因,其中细胞凋亡和自噬、以及解毒等基因在取食抗虫水稻品种的褐飞虱中上调。
在分子水平上,代谢酶基因受抗性植株或者植物抗性物质诱导表达的现象也越来越多地被发现(Fengetal., 2001; Lietal., 2007)。例如,禹海鑫(2013)在褐飞虱唾液腺中发现的基因Nl4777与Bos等(2010)研究的豌豆蚜MP43效应子属于高度同源基因。褐飞虱唾液中含有β-葡萄糖苷酶,用该酶处理抗性水稻可以明显增加水杨酸、乙烯和过氧化氢的含量,降低了茉莉酸的含量。结果表明,β-葡萄糖苷酶处理与褐飞虱取食水稻的作用结果相似,都激活了水稻防御信号转导途径(王霞等, 2007)。Ji等(2017)在唾液腺中鉴定出内源性β-1,4-葡聚糖酶(NlEG1);NlEG1能促进褐飞虱口针进入水稻韧皮部,并降解细胞壁中的纤维素。在褐飞虱中肠中发现的胰脂肪酶基因,主要通过调节褐飞虱的三酰甘油代谢和取食行为来影响褐飞虱的致害性(Yuanetal., 2020)。因此,昆虫对植物毒性物质代谢能力的增强是其致害性提高的主要因素之一。
5 展望
随着各种组学技术的发展,褐飞虱及水稻的基因组学研究已取得了一些进展。目前,一方面在水稻种质资源中检测出许多褐飞虱抗性基因(Akankshaetal., 2019)。并且克隆并鉴定了几个抗性基因如Bph15、Bph9、Bph3等(杜波等, 2016),这为阐明褐飞虱致害性不同抗性水稻品种的分子机制提供了基础。另一方面褐飞虱的基因组已测序,褐飞虱唾液的转录组和蛋白质组学数据也在迅速积累中(Huangetal., 2019)。不同水稻品种在抗性压力下褐飞虱种群的基因组变异将成为理解昆虫对寄主变异的适应性的重要途径之一。根据水稻抗褐飞虱基因的类别,在互作过程中褐飞虱也产生了不同的致害机制,主要分为主动适应机制和被动适应机制。通过基因组、转录组、蛋白组多层次的关联分析褐飞虱致害表型相关的基因变异,并根据致害性变异机制的类型,通过RNAi、CRISPR/Cas9等基因技术研究这些基因调控褐飞虱致害性变异的机制,对昆虫致害性相关基因的多样性和等位基因的功能进行探索,将有助于揭示植物与植食性昆虫协同进化的过程,有助于提升粮食生产过程中害虫可持续控制的理论。

