刺梨叶提取工艺优化及其抗氧化活性研究
刘丹 丁小艳


摘 要:目的:比较不同极性部位提取物抗氧化能力和成分类型,为刺梨叶所含成分进一步研究提供参考方向。方法:通过正交实验优化刺梨叶供试液提取工艺,将提取液分别依次用乙酸乙酯和水饱和正丁醇依次萃取,得到醇层、乙酸乙酯层、正丁醇层、水层,以DPPH自由基清除率和总抗氧化力为评价指标,比较不同层提取物抗氧化能力。结果:提取条件最佳组合为料液比1∶30、超声时间60 min、乙醇浓度60%。正丁醇层提取物的抗氧化能力最强。结论:刺梨叶中富含多酚黄酮类物质,正丁醇层提取物具有更强的抗氧化能力。
关键词:总黄酮;总多酚;提取工艺;抗氧化活性
Optimization of Extraction Process and Antioxidant Activity of Active Substance from Rosa Roxburghii Leaves
LIU Dan1, DING Xiaoyan2
(1.Guizhou Institute for Food and Drug Control, Guiyang 550004, China; 2.Guizhou Material Industry Technology Research Institute, Guiyang 550016, China)
Abstract: Objective: The antioxidant capacity and component types of extracts from different polar parts were compared to provide a reference direction for the further study of the components contained in Rosa roxburghii leaves. Method: The extraction process of the test solution from Rosa roxburghii leaves was optimized by orthogonal experiment. The extract was extracted with ethyl acetate and water saturated n-butanol in turn to obtain alcohol layer, ethyl acetate layer, n-butanol layer and water layer. The antioxidant capacity of the extracts from different layers was compared with DPPH free radical scavenging rate and total antioxidant capacity. Result: The best combination of extraction conditions was solid-liquid ratio 1∶30, ultrasonic time 60 min and ethanol concentration 60%. N-butanol extract has the strongest antioxidant ability. Conclusion: Rosa roxburghii leaves are rich in polyphenols and flavonoids, and n-butanol layer extract has stronger antioxidant capacity.
Keywords: total flavonoids; total polyphenols; extraction process; antioxidant activity
實验中所用刺梨叶,被2003版《贵州省中药材、民族药材质量标准》收录,是药食同源植物,在贵州省等地分布较为广泛,目前在贵州多地有种植基地,为贵州的优势经济作物[1-3]。近年来,刺梨产业的发展得到了贵州省委、省政府的高度重视,大力支持相关的科学研究。
刺梨叶中的成分对自由基有清除作用。刺梨中的多酚类、黄酮类成分,已被研究证明具有很好的抗氧化作用[4-6]。在近年来的研究中发现刺梨叶有α-葡萄糖苷酶抑制活性,对2型糖尿病大鼠脂代谢也起一定的治疗作用[7-11],这都与刺梨叶的抗氧化机制相关,说明刺梨叶中的抗氧化活性物质值得被深入研究,可制成茶叶等饮品,具有广阔的食品、保健食品应用前景。本实验优化刺梨叶活性成分提取工艺,再比较刺梨叶不同极性部位提取物的抗氧化活性。
1 材料与方法
1.1 材料与仪器
刺梨叶样品为蔷薇科蔷薇属植物缫丝花的干燥叶;Folin-Ciocalteu试剂(F-C试剂,自制);没食子酸对照品(中国食品药品检定研究院,批号110831-201204);芦丁对照品(成都曼斯特生物有限公司,批号MUST-11040302);水为去离子水;试剂均为分析纯。
CARY100-Bio紫外-可见分光光度计(美国瓦里安中国有限公司);DY-H4-型电热恒温水浴锅(上海精宏实验设备有限公司);KQ-500DB超声波清洗仪(昆山市超声仪器有限公司);ACCULAB型万分之一电子天平(深圳市郎普电子科技有限公司);高速中药粉碎机(上海精宏试验设备有限公司);高效液相色谱仪(美国沃特世中国有限公司);ALC-210.4电子天平(赛多利斯科学仪器北京有限公司);GZX-GFC-101-2-BS型电热恒温鼓风干燥箱(上海博泰实验设备有限公司);80-2台式低速离心机(上海医疗器械集团有限公司)。
1.2 实验方法
1.2.1 溶液制备
(1)提取工艺优化供试品溶液制备。刺梨叶干燥后粉碎,过筛,得刺梨叶供试品。称取适量刺梨叶供试品,加入10倍量的石油醚浸泡达24 h脱色后,过滤,用石油醚洗涤,干燥后称取1 g样品于50 mL锥形瓶中,精密称定,设置60%乙醇超声提取,
3 000 r/min离心10 min,取上清液稀释后待测。
(2)对照品溶液制备。①芦丁标准溶液的配制。准确称取芦丁对照品116.84 mg置于50 mL容量瓶中,用60%乙醇稀释并定容至刻度,制得2.29 mg/mL对照品储备液。精密吸取2.5 mL对照品储备液于25 mL
容量瓶中,60%乙醇稀释至刻度,制得229.0 μg/mL芦丁标准液[12]。②没食子酸标准溶液配制。精密称取没食子酸对照品50.0 mg于50 mL容量瓶中,去离子水溶解定容至50 mL,得质量浓度为0.899 mg/mL没食子酸储备液。精密吸取该储备液5 mL于50 mL容量瓶中并用去离子水定容至刻度,制得89.9 μg/mL的没食子酸标准溶液[13]。
(3)抗氧化活性比较供试液制备。精密称取1.2.1项下脱色并干燥后的刺梨粉20 g,60%乙醇溶液,料液比1∶10(g∶mL),超聲提取60 min,提取2次,过滤。精密吸取滤液50 mL,为醇层,其他滤液减压蒸发回收乙醇,剩余水溶液分别采用极性增大的乙酸乙酯和水饱和正丁醇依次萃取,最后为水相部位。
1.2.2 正交实验
根据前期的单因素实验,各条件最佳点为液料比25∶1,超声时间30 min,乙醇浓度60%。以各最佳点为中心设计正交实验。以目标函数确定达到总黄酮和总多酚的最佳提取条件,选择加权综合评分法,以总黄酮和总多酚各占50%来确定最佳提取工艺[14],因素水平见表1。
1.2.3 总抗氧化力和DPPH自由基清除率测定
(1)总抗氧化力测定。精密称取不同极性部位提取物于25 mL容量瓶中,制成浓度为2.6 mg/mL的样品液,将样品液稀释10倍,则制得待测液。分别加入待测液0.5 mL、1.0 mL、1.5 mL、2.5 mL、3.5 mL和4.5 mL于10 mL具塞试管中(空白不加样液,以同体积超纯水代替),加超纯水至体积为1.5 mL,加入0.6 mol/L的H2SO4溶液1 mL,28 mmol/L的Na3PO4溶液1.5 mL,4 mmol/L的钼酸铵溶液1.5 mL,再加超纯水至总体积为10 mL,摇匀后置于95 ℃恒温水浴中1.5 h,取出,冷至室温,在695 nm波长处测定吸光度。每个样品平行3次实验。
(2)DPPH自由基清除率测定。将上述总抗氧化力测定中制成的样品液稀释100倍则制得待测液,分别取0.7 mL、1.0 mL、1.3 mL、1.6 mL、1.9 mL和2.2 mL待测液,加超纯水至4 mL,再加0.25 mmol/L的DPPH乙醇溶液2 mL,置暗箱中反应30 min,于517 nm处测定吸光度。对照不加供试液。每个样品平行3次实验。
2 结果与分析
2.1 正交实验优化
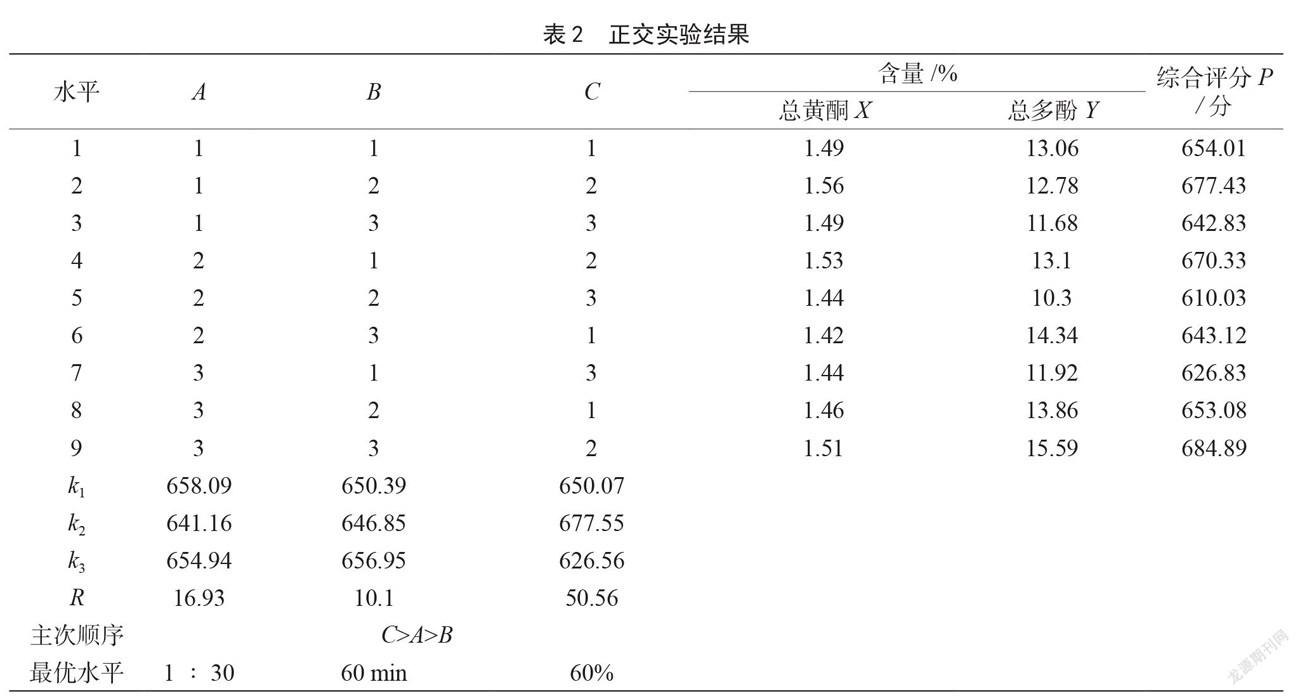
由表2可知,极差分析结果显示,提取条件中对测定结果影响程度由大到小的顺序为乙醇浓度、料液比、超声时间;由k值得,最优组合为A1B3C2,得分为664.20分,低于正交实验表中的最佳组合A3B3C2(684.89分)。因此当料液比1∶30、超声时间60 min,乙醇浓度60%时,综合评分最高,提取工艺最佳。
2.2 刺梨叶不同极性部位抗氧化力比较
由表3可知,刺梨叶不同部位的抗氧化能力大小均为水饱和正丁醇层>乙酸乙酯层>醇层>水层。
3 结论
刺梨叶的药理活性与其抗氧化机制有关,可开发相关的保健食品。实验前期研究中发现刺梨叶有很高的抗氧化活性,对刺梨叶的各个极性部位提取物的抗氧化活性进行对比,发现刺梨叶中起抗氧化作用的物质主要在正丁醇层,其次乙酸乙酯层,研究结果表明有必要对抗氧化能力强的极性部位进行深入研究。
参考文献
[1]贵州省药品监督管理局.贵州省中药材、民族药材质量标准[M].贵阳:贵州科技出版社,2003.
[2]包俊.贵州苗族医药研究与开发[M].贵州:贵州科技出版社,1999.
[3]统战政协.把刺梨产业开发成为贵州精准脱贫特色产业[N].贵州政协报,2016-05-06(A2).
[4]陈代雄,姜东,张永华,等.刺梨多糖对动物免疫功能的影响[J].遵义医学院学报,1991(1):1-5.
[5]管春平,何艳娇,徐成东.滇大蓟中黄酮的提取及其对羟基自由基清除作用研究[J].楚雄师范学院学报,2013,28(6):50-55.
[6]何伟平,腾建文,朱晓韵,等.刺梨Vc和多酚成分稳定性及抗氧化性研究[J].广西轻工业,2011,27(9):1-3.
[7]黄康,王征.绿原酸防治2型糖尿病作用机制的研究进展[J].中国食物与营养,2013,19(9):66-69.
[8]黄伟,安华明,杨玉,等.机械伤胁迫下刺梨果实的抗氧化反应[J].西南大学学报(自然科学版),2009,31(8):109-113.
[9]简崇东,唐雄林,黄晓华,等.脑梗死患者口服刺梨汁抗动脉粥样硬化临床研究[J].亚太传统医药,2017,13(3):136-137.
[10]简崇东.刺梨药理作用的研究进展[J].中国医药指南,2011,9(29):38-40.
[11]李福明,汪洋,韦敏.刺梨叶醇提物体外抗氧化活性和α-葡萄糖苷酶抑制活性研究[J].中国现代应用药学,2015,32(6):685-688.
[12]丁小艳.贵州不同基地刺梨果及叶质量对比分析及抗氧化活性研究[D].贵阳:贵州师范大学,2015.
[13]刘丹,江帆,丁小艳,等.黔产刺梨果中总多酚的含量测定及其干燥方式考察[J].中国实验方剂学杂志,2016,22(23):20-23.
[14]刘庆林,樊卫国,安华明.刺梨叶片中总黄酮和水溶性多糖的提取工艺[J].山地农业生物学报,2005(6):
522-526.

