NMNAT1缺失对小鼠视网膜双极细胞和无长突细胞的影响
曹 瑾 吴彩霞 毛建华
在哺乳动物组织中,视网膜依赖于适当的 NAD+稳态来维持生存和发挥功能[1-3]。烟酰胺单核苷酸腺苷转移酶1(NMNAT1)是一种高度保守的核定位蛋白,可催化烟酰胺单核苷酸(NMN)或烟酸单核苷酸(NaMN)的腺苷酸化形成 NAD+,这是所有哺乳动物 NAD+生物合成途径的收敛步骤[4]。迄今为止,已有超过30种 NMNAT1 突变被证实与严重致盲疾病相关[5-7]。然而NMNAT1除了影响NAD+稳态外,还在视网膜中存在多种潜在作用。如NMNAT1具有去乙酰化酶功能,可以促进视网膜祖细胞的存活[8],而成熟小鼠中 NMNAT1的消融导致由神经退行性NADase SARM1介导的光感受器快速死亡[9]。此外,NMNAT1构成神经保护蛋白Wld(s)的大部分序列,亦可延缓轴突退化[8]。最近有研究证实,视网膜 NMNAT1缺失会在出生后不久引起小鼠快速和严重的视网膜变性[5,10],但具体影响机制尚未明了。故本研究通过构建NMNAT1条件性敲除小鼠模型,旨在深入分析NMNAT1缺失对视网膜神经元细胞结构和功能的影响。
1 材料与方法
1.1 材料与仪器NMNAT1条件敲除小鼠[NMNAT1fl/fl小鼠,采用胚胎干细胞(ES细胞)打靶技术商业化制备]和野生型 129/SV-E 小鼠(北京维通利华公司),实验动物许可证:SCXK(京)2016-0011。RIPA裂解缓冲液(美国Thermo Fisher Scientific公司);BCA蛋白质测定试剂盒(北京CoWin Biotechnology公司);NMNAT1抗体、BRN3A抗体、Calretinin(CALR)抗体、CHX10抗体(美国Millipore公司);恢复蛋白(RCVRN)抗体、视紫质(RHO)抗体(美国CST公司);Leica CM1850 低温冰冻切片机(德国Leica Biosystems公司);Superfrost Plus 载玻片(美国Fisher Scientific公司);HE染色试剂盒(北京Solarbio公司);Nikon Eclipse Ti 光学倒置显微镜和激光扫描共聚焦显微镜(日本Nikon Instruments公司)。
1.2 方法
1.2.1 动物模型构建将NMNAT1fl/fl小鼠与野生型 129/SV-E 小鼠充分回交。将loxP靶向NMNAT1基因座(NMNAT1fl/fl)的纯合小鼠与Six3启动子下表达Cre重组酶的转基因小鼠(NMNAT1wt/wtSix3-Cre)杂交,获得条件敲除小鼠[11]。杂交产生杂合的 NMNAT1fl/wt和Six3-Cre NMNAT1fl/wt后代,它们与NMNAT1fl/fl小鼠进一步杂交以产生接近孟德尔比率的条件敲除(Six3-Cre NMNAT1fl/fl)和同窝对照(NMNAT1fl/fl)小鼠。实验小鼠定期与野生型129/SV-E小鼠回交以保持遗传完整性。将实验小鼠维持在标准的12 h光照/黑暗循环下,提供充足的食物和水。本研究经我院医学伦理委员会批准。
1.2.2 NMNAT1敲除小鼠的鉴定使用来自耳部穿刺活检的基因组DNA,通过实时荧光定量PCR(qPCR)检测对小鼠进行基因分型。Six3-Cre引物序列:上游为5’-GCCCTGGCAGTGTCTTAG-3’;下游为5’-CAGTGCGTGTCGTGGAGT-3’。NMNAT1引物序列:上游为5’- CCTTGTACCTGACCATGTCAACA-3’;下游为5’-CCTGGGAGGCATAGACCATGTA-3’。引物以终浓度0.75 μmol·L-1添加到 PCR 反应体系中。热循环条件为95 ℃ 2 min,95 ℃ 30 s,58 ℃ 30 s,72 ℃ 45 s,共35个循环,最后72 ℃延伸5 min。
1.2.3 Western blot检测NMNAT1蛋白表达使用RIPA裂解缓冲液从小鼠视网膜提取总蛋白。通过BCA蛋白质测定试剂盒检测蛋白质浓度。将裂解产物在95 ℃的十二烷基硫酸锂上样缓冲液中煮沸5 min。蛋白质被Bis-Tris聚丙烯酰胺凝胶分离并转移到聚偏二氟乙烯膜上。用50 g·L-1脱脂牛奶缓冲液在室温下封闭1 h,随后用兔抗鼠NMNAT1抗体(11000稀释)4 ℃孵育过夜,抗兔辣根过氧化物酶结合二级抗体(15000稀释)孵育2 h,最后用ECL发光液进行检测,并计算各蛋白的表达量。
1.2.4 制作冰冻切片在基因敲除小鼠出生后第0、4、10、30天(P0、P4、P10、P30),使用断颈法处死小鼠,在手术显微镜下沿眼眶缘剪下小鼠眼球,并浸入40 g·L-1多聚甲醛中固定15 min,然后剪除角膜并再次固定45 min。 随后,在 1×PBS 中清洗样本并在脱水溶液(含有200 g·L-1蔗糖)中于4 ℃下孵育12 h。脱水后,将样品在含有200 g·L-1蔗糖和Tissue-Tek®冷冻切片包埋剂的11 混合液中孵育1 h,然后转移到冷冻切片包埋剂中,并放入-80 ℃冻存。使用低温冰冻切片机切割16 μm的切片并置于Superfrost Plus 载玻片上。
1.2.5 视网膜组织学检查HE 染色切片在带有DS-Ri2 相机的尼康Eclipse Ti 型显微镜下拍照。使用尼康NIS-Elements软件测量视网膜外边缘至视神经两侧4个等距离点的视网膜厚度,视网膜厚度定义为与视网膜外边缘正交并终止于视网膜内边缘的连线的长度。每只动物平行采集6个重复样本,每个基因型完成 3 个生物学重复检测,计算平均厚度值。
1.2.6 免疫荧光化学染色视网膜切片用 1×PBS 短暂冲洗并在封闭缓冲液(含体积分数10%山羊血清和体积分数0.5% Triton X-100)中室温孵育1 h。封闭后,将切片与一抗[用含有体积分数 5% 正常山羊血清、体积分数0.5% Triton X-100的缓冲液按1200(BRN3A抗体)、1200(CALR抗体)、1500(CHX10抗体)比例稀释]在4 ℃下孵育过夜。次日切片用 1×PBST洗涤,并与 DAPI染色剂、山羊抗兔 Alexa Fluor-568 和(或)山羊抗小鼠 Alexa Fluor-488二抗在室温下继续孵育1 h。最后,将切片清洗,用Prolong Gold®抗淬灭试剂覆盖盖玻片,并在激光扫描共聚焦显微镜下拍照。
1.3 统计学方法用SPSS 25.0软件进行统计学处理。每只动物平行采集6个重复样本,每个基因型完成3 个生物学重复检测,计算视网膜厚度的平均值。多组间比较采用单因素方差分析,两两比较采用LSD-t检验,检验水准:α=0.05。
2 结果
2.1 NMNAT1条件敲除小鼠模型的构建与验证几次杂交后,继承Six3-Cre和floxed NMNAT1基因座的基因敲除小鼠在胚胎视网膜中表现出Cre介导的 NMNAT1前两个外显子切除,其中包含重要的底物结合域(图1A)。qPCR检测结果表明,与同窝对照小鼠相比,出生后第4天(P4)时基因敲除小鼠的视网膜NMNAT1表达降低了75.6%(P<0.05)。进一步Western blot实验证实,与同窝对照小鼠相比,P0时基因敲除小鼠的视网膜 NMNAT1 蛋白表达水平也显著降低,差异有统计学意义(P<0.05,图 1B)。

图1 NMNAT1条件敲除小鼠模型的构建与验证 A:视网膜特异性Six3-Cre介导的NMNAT1基因片段切除示意图;LP示loxP 位点,E1-4示外显子1-4。B:Western blot检测P0时基因敲除(-/-)小鼠和同窝对照(+/+)小鼠视网膜中NMNAT1蛋白表达水平。
2.2 视网膜组织病理学检查HE染色结果显示(图2),P0时基因敲除小鼠和同窝对照小鼠的视网膜组织横截面没有明显的形态差异(图2A),视网膜厚度比较差异无统计学意义(P>0.05,图2E); 然而,P4时基因敲除小鼠距离视神经500 μm、1000 μm、1250 μm的视网膜厚度均明显低于同窝对照小鼠(均为P<0.05),并表现出视网膜内层和外层中的分层破坏以及大规模细胞死亡的证据,视网膜外丛状层(包含光感受器和双极细胞神经元突触结构)已经出现损伤,在中央视网膜中部最为严重(图2B)。周边视网膜厚度(距离视神经1750 μm)尚未受影响(P>0.05,图2F)。而P10时基因敲除小鼠距离视神经500 μm、1000 μm、1250 μm、1750 μm的视网膜厚度与同窝对照小鼠相比均减少(均为P<0.05),然而仍然可见内层和外层视网膜神经元的分界(图2C、2G)。 P30时基因敲除小鼠全部视网膜内外层的退化几乎完成(图 2D)。

图2 NMNAT1缺失导致两组小鼠视网膜出现组织学损伤(标尺:20 μm) A、B、C、D分别为不同时期两组小鼠视网膜横截面HE染色;E、F、G分别为不同时期两组小鼠视网膜厚度差异(与同窝对照小鼠相比,*P<0.05)。GCL:神经节细胞层;NBL:神经母细胞层;IPL:内丛状层;OPL:外丛状层;INL:内核层;ONL:外核层;IS/OS:感光器内段/外段层。+/+:同窝对照小鼠,-/-:基因敲除小鼠。
2.3 视网膜神经节细胞、双极细胞和无长突细胞的存活状态经免疫荧光染色检测P4和P10时基因敲除小鼠(P4和P10分别代表视网膜退化的早期和晚期阶段)的视网膜切片,结果显示(图3):P4和P10时,NMNAT1基因敲除小鼠[P4:(36±6)个,P10:(31±5)个]和同窝对照小鼠[P4:(29±5)个,P10:(29±4)个]的视网膜神经节细胞的相对数量差异均没有统计学意义(均为P>0.05)(图3A)。此外,P4时基因敲除小鼠与同窝对照小鼠相比,视网膜双极细胞[(26±4)个、(28±3)个]和无长突细胞[(97±12)个、(168±19)个]的数量差异均无统计学意义(均为P>0.05),但在P10时基因敲除小鼠视网膜中双极细胞数量[(42±4)个]较同窝对照小鼠[(168±19)个]减少了约 75%(P<0.05)(图3B),视网膜无长突细胞的数量[(23±3)个]较同窝对照小鼠[(47±7)个]减少了约 51%(P<0.05)(图3C)。

图3 NMNAT1 缺失对两组小鼠视网膜神经节细胞、双极细胞和无长突细胞存活的影响(标尺:20 μm) A:BRN3A荧光抗体阳性染色的视网膜神经节细胞;B:CALR荧光抗体阳性染色的无长突细胞;C:CHX10荧光抗体阳性染色的双极细胞。
2.4 光感受器RCVRN和RHO的表达采用免疫荧光染色法定量小鼠光感受器的RCVRN和RHO表达。结果发现,与同窝对照小鼠相比,P4时基因敲除小鼠几乎不表达RCVRN(图4A)和RHO(均为P<0.05)(图4B)。
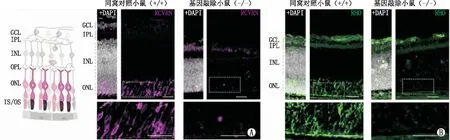
图4 NMNAT1缺失对P4时两组小鼠RCVRN(A)和RHO(B)表达的影响(标尺:20 μm)
3 讨论
哺乳动物的NMNAT存在3种亚型:NMNAT1、NMNAT2、NMNAT3[12-14]。而人类与啮齿类动物NMNAT的同源异构体之间氨基酸序列的相似性很高。如人类NMNAT1与小鼠NMNAT1的氨基酸序列有80%左右的同源性[11-18]。因此,NMNAT1选择性敲除小鼠是探索人类NMNAT1相关性眼病的理想模型。
本研究证明了小鼠视网膜NMNAT1缺陷会导致出生后不久光感受器、双极细胞和无长突细胞的严重退化。总的来说,这种表型与文献报道的视网膜NMNAT1 部分或完全抑制的研究一致,文献指出在出生后第1周内开始出现视网膜变性,并在1个月时基本完成[6]。虽然本研究描述的NMNAT1相关的视网膜变性的进展相对更为迅速,但本研究在两方面进一步表征了这种表型:首先,评估了NMNAT1敲除后特定视网膜神经元亚型的存活;其次,评估了NMNAT1敲除后光感受器的功能改变。
对NMNAT1敲除视网膜中特定细胞类型的检查表明,NMNAT1敲除视网膜中存在严重的光感受器变性,也表明特定内部视网膜神经元群的丧失。虽然光感受器可能是NMNAT1相关病理学的主要目标,但视网膜双极细胞和无长突细胞在视网膜发育过程中也受到NMNAT1敲除的显著影响。而神经节细胞似乎在初期发育过程中不受NMNAT1敲除的影响,直到后期才显示出受到NMNAT1敲除的影响。说明视网膜双极细胞和无长突细胞亦为NMNAT1敲除相关视网膜变性的靶细胞,并且双极细胞对NMNAT1敲除比无长突细胞更敏感。这些结果与最近的研究形成了部分对比,Kuribayashi等[13]和 Sasaki 等[14]在视网膜体外培养模型中敲除NMNAT1的研究中报道了更薄的INL,但在NMNAT1敲除的体外模型中表达HuC/D的无长突细胞或表达蛋白激酶Ca的双极细胞的数量没有变化。然而,这项研究确实报道了NMNAT1敲除体外模型中初级硝酸盐反应阳性的光感受器细胞的数量减少。在整个视网膜中,Six3启动子于胚胎第9.5天(E9.5)左右激活,并在 E12.5 时显示出显著增强的活性[17]。我们认为,与Six3-Cre的E9.5激活相比,在体外模型中的NMNAT1在发育过程中被敲除的相对较晚[4,19],这可以解释无长突细胞和双极细胞的结果差异。
来自共同祖细胞的各视网膜神经元亚型的分化流程和紧密协调已经得到广泛研究与证实,最近的研究已经开始探索哺乳动物视网膜发育所需的大量表观遗传调控[2,20-23]。本研究创新之一是P4时NMNAT1敲除小鼠视网膜中几乎不表达RHO和RCVRN。RHO是人眼中的视锥细胞所含的三种色觉感光色素中的一种,在光的作用下起色觉作用[20],其他两种是视蓝质、视青质。RCVRN选择性定位在视网膜中的钙结合蛋白,参与RHO对视杆鸟苷酸环化酶的激活,可促进环鸟苷酸的再合成、钙通道的重开放及暗状态的恢复[21-22]。虽然我们未使用NMNAT1抗体确定视网膜中 NMNAT1的表达分布,但先前的研究显示,RT-qPCR结果证明NMNAT1是视杆细胞中NMNAT的主要表达亚型[10,13,24]。
总之,本研究表明了 NMNAT1缺失相关的早期和严重的视网膜变性涉及多种类型细胞的结构和功能损伤。NMNAT1 对光感受器、双极细胞和无长突细胞的早期存活至关重要。

