陇东地区油污土壤紫花苜蓿(Medicago sativa)和金鸡菊(Coreopsis lanceolata)
——植物修复效应比较
井明博, 王金成,, 张 威, 周立辉, 张绍鹏
(1.陇东学院生命科学与技术学院,甘肃庆阳 745000;2.甘肃省陇东生物资源保护利用与生态修复重点实验室陇东学院,甘肃庆阳 745000;3.甘肃省极端环境微生物资源与工程重点实验室中国科学院西北生态环境资源研究院,甘肃兰州 730000;4.安全环保技术研究所长庆油田公司油气工艺研究院,陕西西安 710021;5.中国石油天然气股份有限公司长庆油田分公司第十一采油厂,甘肃庆阳 745000)
原油污染土壤生物修复技术是当今环境修复领域研究热点和难点,其中植物修复技术因其成本低、效果好、无二次污染、可持续性大面积原位修复和美化环境等优点而备受青睐[1]。目前,紫花苜蓿(Medicago sativa)、地毯草(Axonopus compressus)、大米草(Spartina anglica)、黑麦草(Lolium perenne)、凤仙花(Impatiens balsamina)和长药八宝(Hylotelephium spectabile)等已成功应用于油污土壤植物修复[2-8]。然而,油污土壤植物修复过程易受多种因素的影响,其中气候条件、地形地貌、土壤性质等是影响植物修复效果的关键因素[6-7]。因此,筛选本土适生耐油植物应用于油污土壤植物修复不仅能保证修复效果,而且能有效提高植物定植率,防止枯黄病的发生,促进根区油污去除效果[9-10]。
作为油田主产区的陇东黄土高原干旱少雨、土壤贫瘠、盐碱化程度高,因此植被分布有明显的地域性[11]。本研究团队多年来在该地区实施油污土壤场地生态修复工作,期间发现菊科植物不仅根区修复效果好,而且具有极强的油污耐受性、抗寒性以及牲畜不可食用性等特点,并陆续报道了金盏菊(Calendula officinalis)和非洲菊(Gerbera jamesonii)对陇东地区油污土壤植物修复效应[9,12],但尚未开展与其他植物修复效果的比较研究。
为此,本研究以豆科植物紫花苜蓿(Medicago sativa)为参照[3],以菊科植物金鸡菊(Coreopsis basalis)为受试植物,在油田某采油厂作业区进行了5个月的场地修复试验。通过比较2种受试植物生理特性、土壤理化特性和土壤微生物特性对不同油污浓度胁迫时的响应情况,解析在陇东地区紫花苜蓿和金鸡菊对油污土壤植物修复效果的主要微生态影响因素,为陇东地区油污土壤植物修复提供备选植物品种及其基础参考数据。
1 材料与方法
1.1 供试样地选择和试验设置
研究区位于甘肃省庆阳市庆城县(107°16′32″~108°05′49″E,35°42′29″~36°17′22″N),海拔1011~1623 m,土壤类型为黄绵土[9]。为了最大程度评价原位状态下植物修复效果,油污土样源自油田某采油厂作业区内所收集的不同浓度(0.72%~36.37%)油污土壤,其中原油污染物为落地原油和清罐原油混合物。油污土壤养分背景值为全氮含量1.49~3.27 g·kg-1、全磷0.31~1.81 g·kg-1、碱解氮22.69~26.37 mg·kg-1、速效磷16.15~18.71 mg·kg-1、有机质10.51~13.19 g·kg-1、pH为7.78~7.94。试验以总石油烃(Total Petroleum Hydrocarbons, TPH)含量为3.07%、6.93%、9.12%和11.43%油污土壤为供试土样,在文中分别标识为3%、7%、9%和11%,试验设计如表1所示。
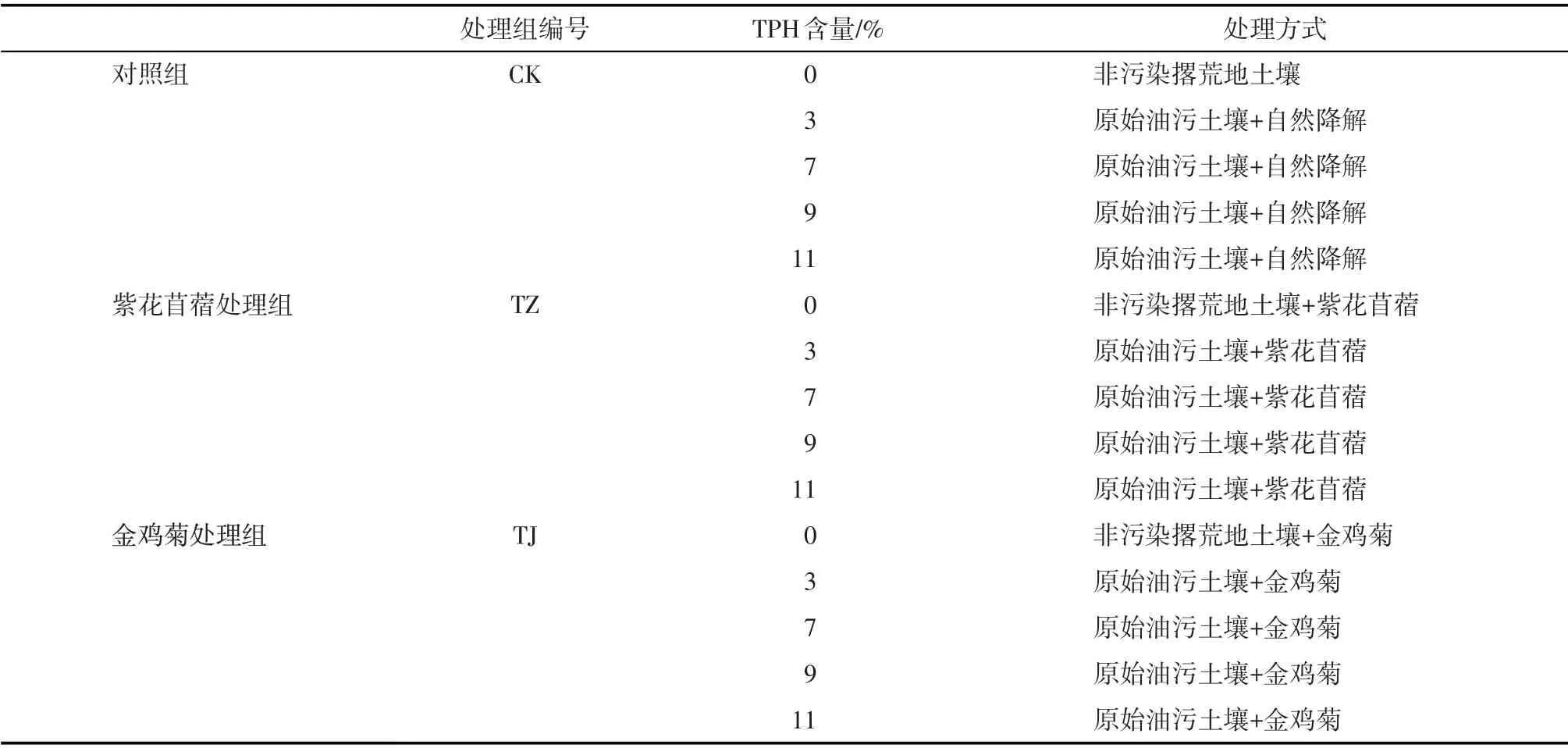
表1 试验设计Tab.1 Design of experiment
试验采用场地修复方式,修复池长×宽×深为3 m×3 m×0.5 m。为确保受试植物根系能自然延伸到油污土层,根据前期试验数据金鸡菊在非油污土壤中根长为17.5~22.3 cm,将油污土层厚度铺设为25~30 cm。包括对照组(CK)在内,每个浓度设置3个重复,共计45个修复池。于2020年3月20日播种,每个对应的修复池播撒种子1000 粒,覆土约1 cm,采用人工补水方式保持最大田间持水量的65%左右进行发苗。于4月30日对株高约10 cm植株幼苗进行间苗,以确保受试植物根区修复效果将每个修复池黑心菊和紫花苜蓿种植密度保持在50 株·m-2[1]。以2020 年5 月1 日开始,修复试验进行5 个月,于2020年9月30日结束。
1.2 植物生理指标、土壤理化和酶活性测定
修复结束后按对角线五点法收获长势相对一致的供试植物各20 株。采用抖根法[7]收集每株供试植物的根区土样混匀并随机分为两份,一份用于土壤微生物(细菌)高通量测序;另一份阴干过2 mm筛后测定相关土壤理化和酶活性指标。土壤碱解氮、速效磷、脲酶和多酚氧化酶分别采用碱解扩散法、0.5 mol·L-1NaHCO3浸提-钼锑抗比色法、靛酚蓝比色法和邻苯三酚比色法测定[12];植物根活力、植物叶片叶绿素a和b含量、地上及地下生物量、根冠比和出苗率参照Zhen 等[5]和祁迎春等[13]进行测定。土壤TPH 残留量采用超声-索氏萃取-重量法测定[12],土壤TPH去除率计算公式为:

1.3 土壤微生物多样性测序
委托某公司基于Illumina Miseq PE 2500平台进行土壤微生物(细菌)高通量测序。扩增引物为341F/805R(341F 引物:5’-CCCTACACGACGCTCTTCCGATCTG-3’;805R 引物:5’-GACTGGAGTTCCTTGGCACCCGAGAATTCCA-3’),对土壤微生物总DNA进行PCR扩增[14]。采用Illumina测序工作流程完成文库制备、测序和下机数据初步分析。
1.4 数据分析
利用SPSS 25.0 和R 3.3.1 对数据进行分析,用GraphPad Prism 5.0 和R 3.3.1 作图。土壤微生物群落结构(属分类水平)分析利用云平台(www.biocloud.org)进行。运用“Vegan”包的“Varpart”函数分析不同油污浓度胁迫时上述3类指标对土壤TPH去除率的贡献率,所有数据均经过Hellinger 转换,用Venn 图表示2种受试植物生长特性、土壤理化特性和微生物特性对根区土壤TPH 去除率的纯效应以及共同效应,图中的数字代表上述3 类指标对不同油污浓度影响时受试植物根区土壤TPH 降解情况的信息解释率[15]。
2 结果与分析
2.1 不同油污浓度胁迫时2 种受试植物根区土壤TPH去除率变化情况
F检验和多重比较(Duncan,α=0.05)结果显示(图1):TZ和TJ处理组根区土壤TPH去除率均随油污浓度增加而下降(P<0.05)。与3%油污组相比,TZ 处理组在7%、9%和11%时分别显著下降了39.06%、72.52%和97.12%,而TJ 处理组则在9%和11%油污浓度时显著降低了43.62%和97.07%(P<0.05),表明2种受试植物根区土壤TPH去除率均随油污浓度增加而降低,这与大多数研究结论基本一致[3,6,9,12],原因在于原油污染物进入土壤后会增加土壤黏度,阻碍土壤和植物根区呼吸作用[13],加之原油污染物对植物根系所产生的生理毒害作用随油污浓度增加而加剧[7],因此植物根区土壤原油污染物的去除率逐渐下降。
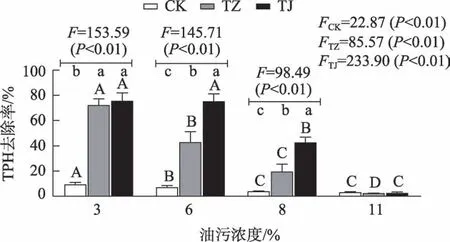
图1 不同油污浓度胁迫时紫花苜蓿和金鸡菊根区土壤TPH去除率变化Fig.1 Changes of the root-zone soil TPH removal rate of Medicago sativa and Coreopsis lanceolata under different TPH concentrations stress
其次,独立样本t检验结果显示(图1):3%油污浓度时TJ 和TZ 根区土壤TPH 去除率无显著差异,而7%和9%油污浓度时TJ 处理组根区土壤TPH 去除率与TZ 处理组相比分别高出75.81%和121.21%(P<0.05),但在11%油污浓度时二者与CK间无显著差异。即7%~9%油污浓度时,金鸡菊根区土壤TPH去除率均显著高于紫花苜蓿,但当油污浓度高达11%时2 种受试植物均未表现出明显根区修复效应。研究指出油污浓度增加对不同种属植物根区TPH 去除率的抑制程度不尽相同[10],原因在于油污土壤植物修复依赖于根区土壤微生物的降解作用,即植物根区土壤原油降解功能菌属种类和数量是决定其TPH 去除率的关键因素[5],但不同种属植物根区土壤微生物对此过程的响应方式不尽相同最终导致了根区TPH去除率有所差异。
2.2 不同油污浓度胁迫时2种受试植物生理指标变化情况
由于11%油污浓度时2种受试植物均未表现出明显根区修复效应,因此仅对3%~9%油污浓度时2种受试植物各项指标做后续分析。首先,与非油污土壤对照组相比,7%和9%油污浓度下TZ处理组出苗率和叶绿素比分别下降了43.08%~106.92%和31.42%~87.15%,而TJ处理组则分别下降了20.00%~68.15%和28.70%~70.48%(P<0.05),但在3%油污浓度时二者间均无显著差异(图2a,图2b);其次,与非油污土壤相比,TJ 处理组根冠比、地上和地下部干重在3%油污浓度时分别增加了8.40%、16.48%和26.43%(P<0.05),TZ 处理组则无显著变化,而当油污浓度增至7%和9%时,TZ 处理组上述3 项指标的下降程度明显高于TJ处理组(P<0.05)(图2c,图2d,图2e);此外,TJ 处理组根活力在3%~9%油污浓度时与非油污对照组相比分别增加了164.64%、216.95%和57.68%,但TZ 处理组仅在3%和7%油污浓度时增加了150.94%和78.89%(P<0.05)(图2f)。上述结果说明,浓度为3%油污土壤对2种受试植物的影响相对较小,但浓度介于7%~9%的油污土壤对紫花苜蓿出苗率、叶绿素比、地上部干重、地下部干重和根冠比的抑制程度显著高于金鸡菊。
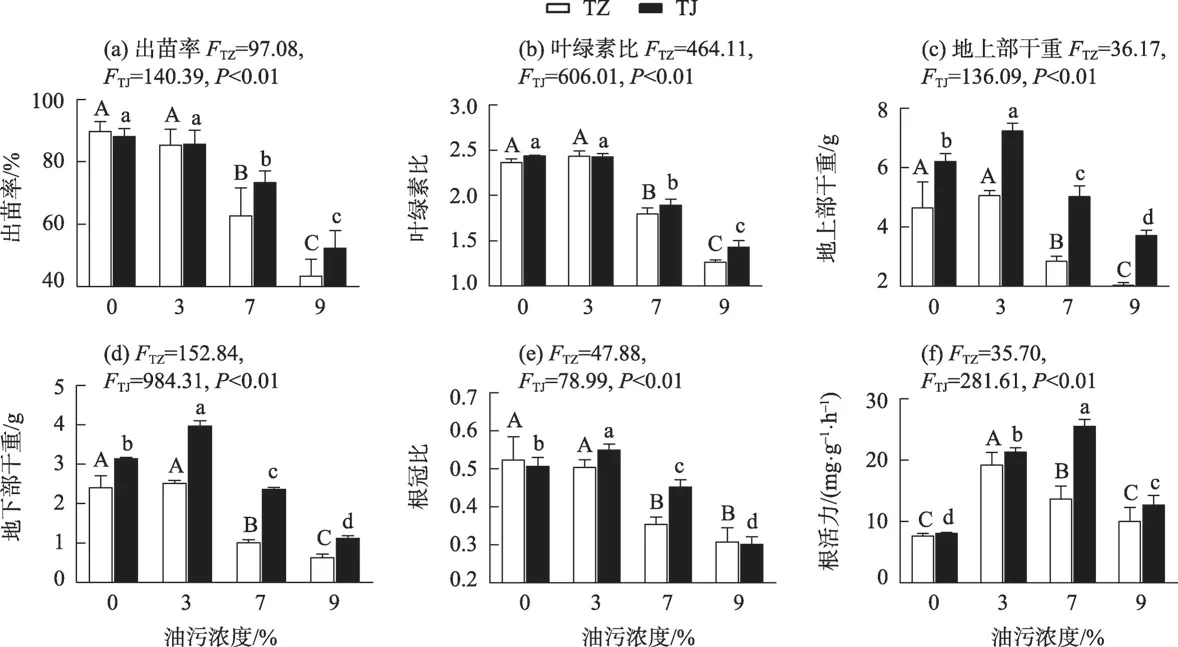
图2 不同油污浓度胁迫时紫花苜蓿和金鸡菊生理指标变化Fig.2 Changes of the physiological index of M.sativa and C.lanceolata under different TPH concentrations stress
研究指出,浓度低于5%油污土壤对非洲菊(Gerbera jamesonii)地上及地下部干重有明显促进作用,但7%时则为抑制作用[12];而浓度≤1%的油污土壤对互花米草(Spartina anglica)植物生物量、根冠比、叶绿素比和根活力无显著影响,但浓度达到3%~5%时则可产生明显抑制作用[5],上述研究结论与本研究结果有相似之处,即不同植物应对不同浓度原油污染物胁迫时各项生理指标的耐受性不尽相同,但总体而言,过高的油污浓度对其生理指标可产生明显抑制作用。究其原因,除通过土壤因素间接影响外,还在于原油污染物可通过细胞膜渗透进入植物根系组织,后经过植物富集作用对植物体地上及地下部分产生毒害作用,进而阻碍植物正常生理功能[16]。就本研究结果来看,金鸡菊对浓度在3%~9%油污土壤的耐受性明显优于紫花苜蓿。
2.3 不同油污浓度胁迫时2种受试植物根区土壤理化指标变化情况
由表2 可知,2 种受试植物根区土壤pH 随油污浓度增加而升高,而碱解氮、速效磷、脲酶、碱性磷酸酶活性则随之降低(P<0.05)。原因在于原油进入土壤后因其强疏水性可引起表层和次表层土壤干旱,加剧土壤盐渍化,导致Ca2+和Na+积累的同时降低阳离子交换量,从而升高土壤pH[17]。而油污浓度增加所导致土壤pH升高会限制土壤养分的有效化水平[5,9],加之原油污染物进入土壤后促使土壤养分比例的失衡[14],抑制了植物根区土壤微生物生长繁殖[18],最终导致土壤速效养分含量降低。
2 种受试植物相较而言,在非油污土壤(0%)中TZ处理组根区土壤碱解氮含量相对较高(P<0.05),但在3种浓度油污土壤中2种受试植物根区土壤碱解氮含量并无显著差异;7%和9%污染土壤中TZ处理组根区土壤速效磷含量与TJ 处理组相比分别高出26.71%和53.08%(P<0.05),由此说明原油污染物对紫花苜蓿根区碱解氮含量和金鸡菊根区速效磷含量的抑制作用相对较大。目前多数学者认为,一定浓度的原油污染物会驱动植物根区土壤微生物群落结构发生改变,有利于原油污染物的生物降解,但原油降解功能微生物的生长会消耗土壤速效养分[6,9]。为了说明土壤碱解氮和速效磷含量的降低与根区土壤微生物和植物生长消耗之间的联系,笔者测定了2种受试植物根区土壤脲酶和碱性磷酸酶活性(表2)。t检验结果显示,在7%和9%油污浓度时TJ处理组根区土壤脲酶活性与TZ处理组相比分别增加了54.42%和68.39%(P<0.05),碱性磷酸酶活性增加了65.85%和188.80%(P<0.05),说明在7%~9%油污浓度范围内TJ 处理组根区土壤脲酶和碱性磷酸酶活性显著高于TZ处理组,但相对较高的土壤脲酶和碱性磷酸酶活性并未增加TJ 处理组根区土壤碱解氮和速效磷含量,加之相对较低的土壤pH 反而有利于土壤养分有效化水平,由此说明,可能由于金鸡菊根区修复过程中土壤微生物的生长繁殖消耗了土壤养分进而导致其速效磷含量低于紫花苜蓿,而紫花苜蓿根区碱解氮含量的下降则可能与根区土壤微生物群落结构受原油污染物的影响有关。
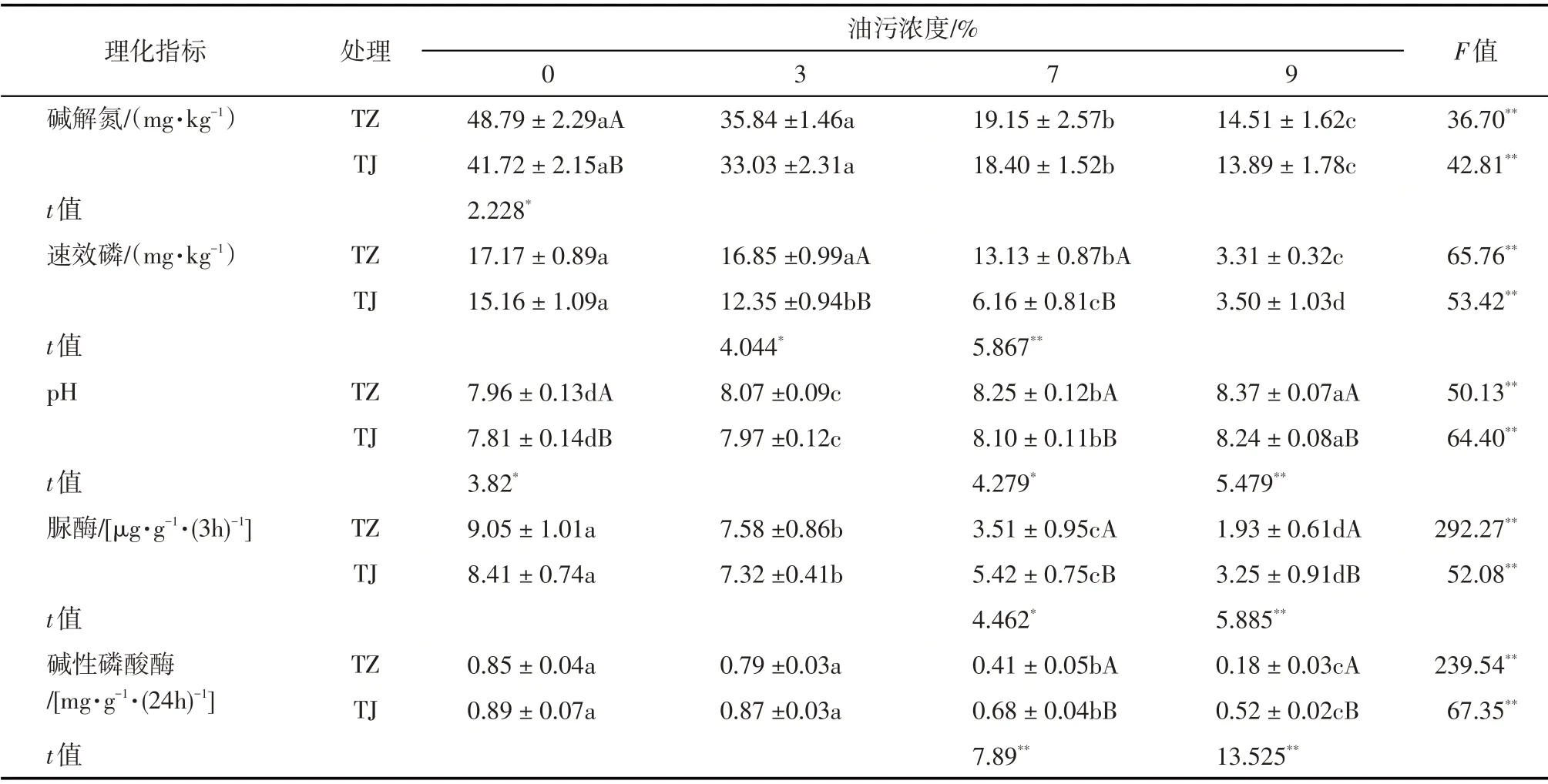
表2 不同油污浓度胁迫时紫花苜蓿和金鸡菊根区土壤理化指标变化情况Tab.2 Changes of physical and chemical index of Medicago sativa and Coreopsis lanceolata root-zone soil under different TPH concentrations stress
2.4 不同油污浓度胁迫时2种受试植物根区土壤微生物群落变化
由表3可知,与非油污土壤相比,随着油污浓度从3%增至9%,TZ 处理组根区土壤微生物OTU 数量、Chao1 指数和Shannon 指数分别下降了14.21%~72.20%、28.86%~67.10%、30.96%~57.54%,而TJ 处理组则依次下降了6.35%~61.79%、2.17%~32.85%和1.11%~27.66%(P<0.05),表明2 种受试植物根区土壤微生物丰富度和多样性均随油污浓度增加而降低,原因在于油污毒性效应随浓度增加而加剧[7],导致植物根区微生物群落多样性下降。然而3种油污浓度胁迫时TJ 处理组根区土壤OTU 数量、Chao1指数和Shannon 指数显著高于TZ 处理组(P<0.05),这表明油污浓度增加对金鸡菊根区土壤微生物群落丰富度和多样性的抑制作用相对较小。
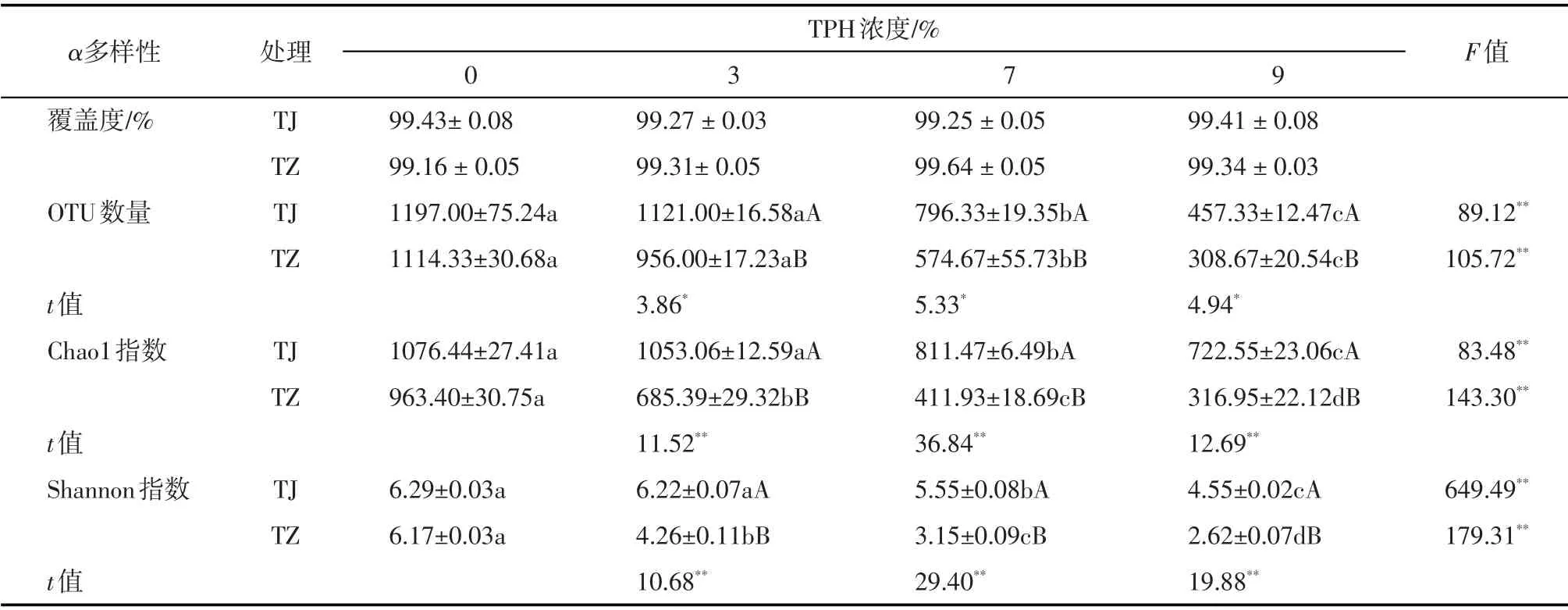
表3 不同油污浓度胁迫时紫花苜蓿和金鸡菊根区土壤微生物群落丰富度和多样性变化(相似度为97%)Tab.3 Changes of root-zone soil microbial richness and diversity of M.sativa and C.lanceolata under different TPH concentrations stress(Similarity is 97%)
2种受试植物根区土壤微生物高通量测序结果显示(图3):相对丰度>1%的优势菌属包括食烷菌属(Alcanivorax)、纤细单胞菌属(Gracilimonas)、海杆菌属(Marinobacter)、Halanaerobium属、嗜盐单胞菌属(Halomonas)、鞘氨醇单胞菌属(Sphingomonas)、假黄色单胞菌属(Pseudoxanthomonas)、Lutibacter属、Fodinicurvata属、Proteiniphilum属、假单胞菌属(Pseudomonas)、类诺卡氏菌属(Nocardioides)、分支杆菌属(Mycobacterium)、海细菌属(Marinobacterium)和深海弯曲菌属(Thalassolituus)。优势菌属聚类结果(欧式距离法)将供试土样划为3 个类群,类群Ⅰ为TJ处理组,类群Ⅱ为TZ处理组,类群Ⅲ则为非油污土壤,上述结果在一定程度上反映出植物种属差异是决定油污土壤微生物群落结构的关键因素。
此外,食烷菌属(5.01%~12.50%)、纤细单胞菌属(3.92%~8.49%)、海杆菌属(4.10%~14.15%)、Ha-lanaerobium属(2.99%~4.86%)、嗜盐单胞菌(12.97%~18.01%)和类诺卡氏菌属(8.62%~19.69%)在TJ 处理组中的相对丰度显著高于其他处理组(P<0.05);而TZ 处理组中鞘氨醇单胞菌属(5.46%~10.25%)、Lutibacter属(8.81%~9.67%)、假单胞菌属(7.81%~14.65%)和分枝杆菌属(10.15%~12.59%)的相对丰度则相对较高(P<0.05)。根据目前已有研究[9,19-21]可知,食烷菌属、Gracilimonas属、海杆菌属、Halanaerobium属、鞘氨醇单胞菌属、假黄色单胞菌属、假单胞菌属、类诺卡氏属、分支杆菌属、海细菌属和深海弯曲菌属中存在于原油降解功能菌,这为金鸡菊和紫花苜蓿进行油污土壤根区修复提供了生物学基础。对上述优势菌属相对丰度进一步分析表明,与9%油污浓度组相比,在3%和7%油污浓度时,TJ处理组食烷菌属相对丰度分别高出2.15 倍和2.50倍,海杆菌属分别高出2.06 倍和2.01 倍,类诺卡氏菌属分别为高出2.28倍和1.74倍,而海细菌属则分别高出2.64倍和2.58倍(P<0.05),因此与9%油污浓度组相比,3%和7%油污浓度组土壤微生物群落结构相似度更高(图3);而TZ处理组中原油降解功能菌属仅有鞘氨醇单胞菌属、假单胞菌属和分枝杆菌属,其相对丰度在3%和7%油污浓度也均显著高于9%油污浓度胁迫组。综上所述,油污浓度相对较低时(3%~7%)2种受试植物对原油降解功能菌属的富集作用相对较强,这在一定程度决定了土壤TPH去除率相对较高,而TJ处理组根区土壤原油降解功能菌属的富集作用明显强于TZ 处理组则可能是决定金鸡菊根区土壤TPH 去除率显著高于紫花苜蓿的关键生物学环境因素。此外,非油污土壤中2 种受试植物(TZ-0%和TJ-0%)根区土壤微生物群落结构较为相似的原因可能是与植物根系效应相比,土壤母质、理化性质和气候条件等环境因素对土壤微生物群落结构的影响相对较强,加之植物修复时间相对较短,因此非油污土壤中2 种受试植物优势菌属(相对丰度>1%)的群落结构与油污土壤相比更为相似。
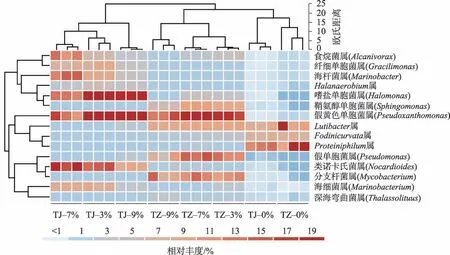
图3 不同油污浓度胁迫时紫花苜蓿和金鸡菊根区土壤微生物优势菌属聚类结果heatmap图Fig.3 Heatmap of relative abundance of the dominant genus of microbial community of root-zone soil of M.sativa and the C.lanceolata under different TPH concentrations stress
为了进一步解析不同处理组间细菌群落结构的差异,相对丰度≥0.1%的菌属LEfSe 分析(LDA值≥4.0)结果显示(图4):在属分类水平上,3种油污浓度胁迫时TJ 处理组中差异指示菌多为原油降解功能菌属,其中Algiphilus属、鞘氨醇单胞菌属、类诺卡氏菌属、Subgroup_7 和深海弯曲菌属等均已被揭示为具备芳烃降解能力的功能菌属[14,22-23],这在一定程度上亦体现出金鸡菊对根区原油降解功能菌属的富集效应优于紫花苜蓿。
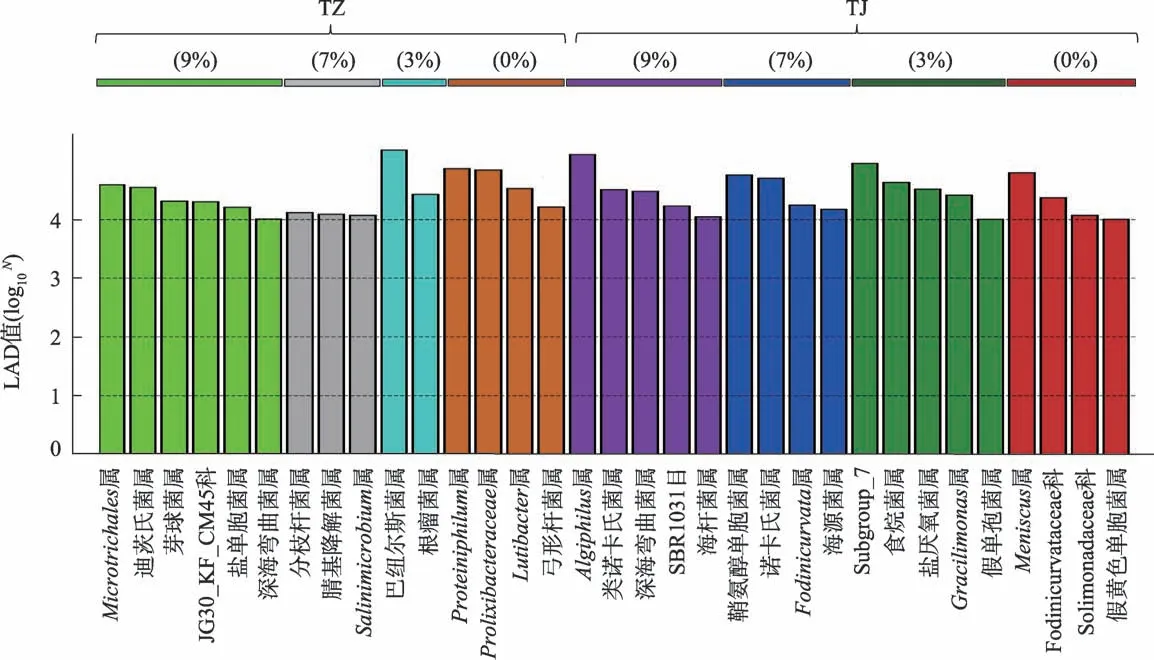
图4 不同处理组间LEfSe差异比较分析LDA值分布Fig.4 LDA value distribution histogram based on LEfSe comparison analysis among different treatments
2.5 2 种受试植物生理特性、土壤理化特性和微生物特性对土壤TPH去除率的方差分解
为了揭示紫花苜蓿和金鸡菊植物生理特性、土壤理化特性和土壤微生物特性对土壤原油污染物去除率的信息解释量,本研究采用方差分解来解析上述3类指标对浓度分别为3%、7%和9%污染土壤根区TPH 去除率的贡献率的结果显示(图5):随着油污浓度从3%增至9%,TZ 处理组植物生理特性、土壤理化特性和微生物特性对土壤TPH 去除率的贡献率纯效应分别从41%、36%和29%降至4%、9%和14%(图5a,图5b,图5c),而TJ 处理组则从48%、31%和34%降至9%、18%和30%,表明油污浓度增加对紫花苜蓿和金鸡菊植物生理特性的抑制作用导致其对土壤TPH去除率的贡献率逐渐下降,而金鸡菊土壤理化特性和微生物特性则决定其根区TPH 去除率显著高于紫花苜蓿(图5b,图5c,图5e,图5f)。
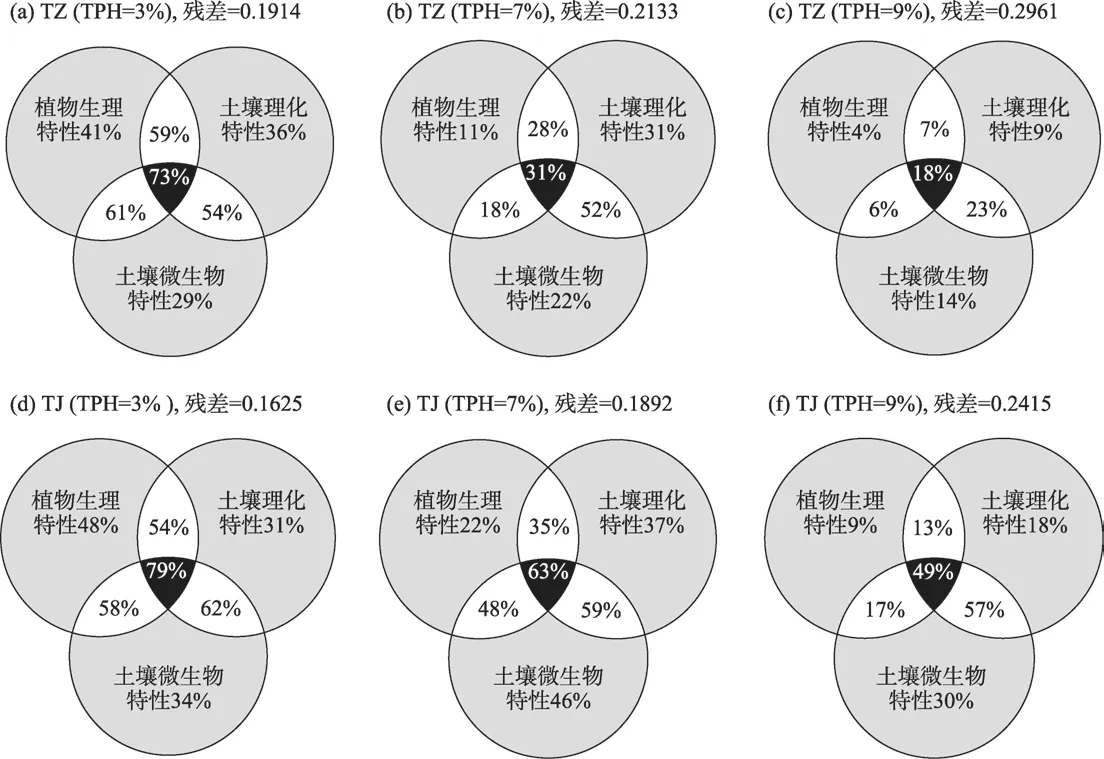
图5 紫花苜蓿和金鸡菊应对3种油污浓度胁迫下植物生理特性、土壤理化特性和土壤微生物特性对土壤TPH去除率的纯效应和共同效应Fig.5 Pure effects and co-effects of plant physiological traits,soil physical-chemical properties and soil microbial properties of M.sativa and C.lanceolata under 3 kinds of soil TPH concentrations stress acorrding to variance decomposition analysis
3 类指标共同效应方面,3%油污浓度时植物生理特性×微生物特性的共同作用[TZ(61%)、TJ(58%)]是贡献土壤TPH去除率的关键环境因素(图5a,图5d),而7%和9%油污浓度时,土壤理化特性×微生物特性的共同作用[TZ(52%,23%)、TJ(59%,57%)]则是决定根区土壤TPH去除率的关键环境因素,但9%油污浓度时TZ处理组土壤理化特性×微生物特性共同作用降至23%,这可能与植物生理指标×土壤理化特性共同作用降至7%有关(图5b,图5c,图5e,图5f),由此说明,油污浓度增加对紫花苜蓿植物生理特性的抑制作用间接影响了土壤理化特性和微生物特性,最终导致其根区土壤TPH去除率相对较低,而金鸡菊根区土壤微生物特性在7%和9%油污浓度时依然高达46%和30%则是决定其根区土壤TPH去除率显著高于紫花苜蓿的决定性因素。
3 结论
油污浓度从3%、7%增至9%,金鸡菊根区土壤TPH 去除率均高于紫花苜蓿。浓度介于7%~9%油污土壤对金鸡菊根冠比、根活力指数、叶绿素比、土壤pH、脲酶和碱性磷酸酶活性的抑制作用显著低于紫花苜蓿。3%~9%油污浓度范围内,金鸡菊根区土壤OTU数量、Chao1指数和Shannon指数均显著高于紫花苜蓿,且金鸡菊根区土壤原油降解功能菌属相对丰度高于紫花苜蓿。油污浓度增加抑制了紫花苜蓿植物生理特性进而限制其根区TPH去除率,而土壤理化特性和微生物特性的共同作用使得金鸡菊根区土壤TPH去除率高于紫花苜蓿。

