硬毛粗盖孔菌YM11菌株的分离鉴定与驯化栽培*
唐少军,许 隽,杨 祎,任 锐,邵晨霞,吴胜莲,喻桃生
(1.湖南省微生物研究院,湖南 长沙 410009;2.湖南湘蕈生物科技有限公司,湖南 长沙 410009)
大型真菌是药物活性物质的重要来源,1969年日本科学家田池等[1]发现香菇(Lentinus edodes)中的提取物对小鼠体内肿瘤有抑制作用,从此拉开了对食(药)用真菌研究的序幕。随着不断的探索,大量食(药)用真菌被制作成抗癌药物,目前已经有50多种用于加工[2-5]。大型药用真菌相较于西药,具有疗效长、对身体损害小的优点,近几年引起了医药界的高度关注。因此,挖掘药用真菌资源对开发活性药物或药物先导分子具有重要的意义。
硬毛粗盖孔菌(Coriolopsis trogii)是一种重要的大型药用真菌,隶属于担子菌门(Basidiomycota)伞菌纲(Agaricomycetes)多孔菌目(Polyporales)多孔菌科(Polyporaceae)革孔菌属(Coriolopsis)[6],也被命名为Trametes trogii[7]、Funalia trogii[8],是一种生长在温带的木腐菌,常见于杨树和柳树上,我国东北、华北、内蒙古、西北、华中等地均有分布[9]。硬毛粗盖孔菌含有多种生物活性物质,能分泌纤维素酶、过氧化物酶和漆酶,有较强的木质素降解能力[10-11],可对工业废水进行脱色,同时还能吸附Hg2+、Cd2+和Zn2+等重金属离子,有环境修复功能[12];其野生子实体粗提物有提高免疫[13]、抗氧化[14]、保肝[15]、抗肿瘤[16-17]等多种活性,有重要的药用价值。然而,目前对硬毛粗盖孔菌的系统鉴定、生物学特性分析与栽培应用的报道较少。通过分离鉴定得到一株野生硬毛粗盖孔菌,首次开展其驯化栽培及抗肿瘤活性试验,丰富了硬毛盖孔菌的资源,并为该菌株的开发利用提供参考。
1 材料与方法
1.1 供试材料
野生菌株子实体样品采自山东省青岛市502省道路边的柳树上,参照参考文献[17]的方法,对野生菌实体进行组织分离,得到供试菌株YM11。
1.2 试剂和仪器
主要试剂:葡萄糖、酵母粉、MgSO4·7H2O、KH2PO4、ZnSO4·7H2O均为分析纯,国药集团化学试剂有限公司;乙酸乙酯、乙醇,北京化工厂;宫颈癌细胞(Hela)、人脐静脉血管内皮细胞(HUVEC),中国典型培养物保藏中心(China center for type culture collection,CCTCC)。
GYM固体培养基配方:葡萄糖 30 g·L-1,蛋白胨 15 g·L-1,MgSO4·7H2O 1 g·L-1,KH2PO41.5 g·L-1,琼脂粉 15 g·L-1,pH 6.5。
主要仪器:IX51倒置显微镜,日本奥林巴斯公司;N-1000v-W型旋转蒸发仪,瑞士步琦公司;酶标仪,美国伯乐公司;ST 16 R型离心机,美国赛默飞世尔公司;MCO-15AC型CO2培养箱,日本三洋公司;Milli-Q水纯化系统,美国默克公司;EVO 10扫描电镜,德国蔡司公司;S8APO体式显微镜,德国徕卡公司。
1.3 YM11菌株的形态鉴定
75%酒精消毒子实体表面,用无菌手术刀切开子实体,在中心位置挖取黄豆大小的子实体,置于GYM固体培养基中,26℃条件下培养。菌丝萌发后转接至试管培养基中保藏菌株,菌株编号YM11。参照参考文献[18]的方法,利用扫描电镜观察YM11菌株的菌丝形态和孢子形态,利用体式显微镜观察子实体的表面和内部特征。
1.4 YM11菌株的分子鉴定
利用真菌基因组试剂盒提取YM11菌株的基因组。以提取到的基因组为模板,采用通用引物对ITS1/ITS4(5′-TCCGTAGGTGGTGAACCTGCGG-3′/5′-TCCTCCGCTTATTGATATGC-3′),对该菌株的 ITS序列进行PCR扩增。反应体系30.0 μL含10×PCR Buffer 5.0 μL、dNTP 3.0 μL、正向引物 1.0 μL、反向引物 10 μL、DNA 模板 2.0 μL、Taq DNA 聚合酶2 U,以无菌去离子水补足至30.0 μL。扩增程序参照参考文献[19]。将PCR扩增产物连接至pMD18-T载体,转入大肠杆菌菌株top10后,提取阳性质粒送至生工生物工程(上海)股份有限公司进行测序。将测序得到的序列在NCBI数据库上进行Blast比对,从中获取与供试菌株亲源关系较近的模式菌株ITS序列,运用MEGA 3.1和Clustal X 1.81,采用邻接法(N-J)构建系统发育(重复次数Replications=1 000,自举Bootstrap值取百分比)。
1.5 YM11菌株的生物学特性分析
1.5.1 不同碳源对菌丝生长的影响
培养基配方为GYM固体培养基配方,试验碳源30 g·L-1,其他成分含量一致。试验碳源分别采用葡萄糖、玉米粉、蔗糖、可溶性淀粉、麸皮、乳糖、大米粉、土豆粉。以不加碳源为对照,每组3个重复。使用打孔器将一个直径约1.1 cm的菌块接种于培养皿(直径9 cm)中央,25℃培养箱中培养10 d,观察菌丝长势,采用“十”字交叉法每天测量菌落直径,并计算菌丝平均生长速度。
1.5.2 不同氮源对菌丝生长的影响
培养基配方为葡萄糖GYM固体培养基配方,试验碳源15 g·L-1,其他成分含量一致。试验氮源分别采用酵母粉、蛋白胨、谷氨酸、牛肉膏、硝酸钾、尿素、草酸铵。以不加氮源为对照,每组3个重复。使用打孔器将一个直径约1.1 cm的菌块接种于培养皿(直径9 cm)中央,在25℃培养箱中培养10 d,观察菌丝长势,按1.5.1的方法测定菌丝平均生长速度。
1.5.3 不同温度对菌丝生长的影响
用打孔器将一个直径约1.1 cm的菌块接种于GYM固体培养基(直径9 cm)中央,分别于5℃、10℃、15℃、20℃、25℃、30℃、35℃、40℃培养箱中培养10 d。每组3个重复,观察菌丝长势,按1.5.1的方法测定菌丝平均生长速度。
1.5.4 不同pH对菌丝生长的影响
以稀盐酸和稀氢氧化钠溶液调节GYM培养基pH梯度,分别为4、5、6、7、8、9,使用打孔器将一个直径约1.1 cm的菌块接种于GYM固体培养基(直径9 cm)中央,每组3个重复,25℃培养箱中培养10 d,观察菌丝平均长势,按1.5.1的方法测定菌丝平均生长速度。
1.6 YM11菌株的驯化栽培
设计了3种栽培种培养料配方进行对比试验,配方如下。
A:木屑75%、棉籽壳10%、麸皮10%、葡萄糖4%、石膏1%,含水量60%~65%;
B:木屑75%、棉籽壳10%、麸皮10%、玉米粉4%、石膏1%,含水量60%~65%;
C:木屑75%、棉籽壳14%、麸皮10%、石膏1%,含水量60%~65%。
采用17 cm×33 cm×0.04 cm规格的聚丙烯塑料栽培袋,将上述搅拌均匀的培养料装入袋中,每袋0.9 kg,料面压平后套塑料环和封口盖。袋料于121℃灭菌4 h,冷却至26℃以下接种。每袋接入4 g菌丝块,接种后于26℃避光培养。待菌丝长满袋后,转移至出菇房,用手术刀在栽培袋的侧边横向划4 cm口进行催蕾。出菇期间,温度为24℃~26℃,相对湿度85%~95%,每天提供1 000 lx~1 500 lx散射光3 h~5 h。子实体采收后计算产量和生物学效率。
1.7 栽培子实体粗多糖的制备
取2 kg硬毛粗盖孔菌子实体40℃条件下烘干,将烘干的子实体研磨后经200目滤网得到子实体粉末,向粉末中加入蒸馏水,然后在95℃条件下浸提24 h,得到的滤液经减压浓缩得到水提物。参照参考文献[20],用Sevag法除蛋白后将溶液缓慢加入4倍体积的无水乙醇中,4℃条件下静置8 h~10 h,然后在10 000 r·min-1、4℃条件下离心10 min后收集底部沉淀,收集到的沉淀经过冷冻干燥后得到粗多糖。
1.8 栽培子实体粗多糖的抗肿瘤活性
将粗多糖用无菌水配制成不同浓度梯度(0、0.5 mg·mL-1、1.0 mg·mL-1、1.5 mg·mL-1、2.0 mg·mL-1、2.5 mg·mL-1、3.0 mg·mL-1),分别经0.22 μm滤膜过滤后备用。在96孔板接种肿瘤细胞Hela、MCF-7和Hep-3B,每孔接种100 μL体积的细胞悬液(含5×103个细胞),置于37℃、5% CO2的培养箱中。待细胞贴壁后,分别加入10 μL不同浓度的粗多糖,以无菌水为空白对照,培养24 h观察细胞形态的变化,并参照参考文献[21]的方法计算细胞抑制率。
2 结果与分析
2.1 YM11菌株的形态鉴定
样品子实体形态见图1。

图1 YM11菌株子实体和菌丝生长情况Fig.1 Fruit body and mycelium growth situation of strain YM11
如图1所示,子实体附生于柳树上,子实体无柄,覆瓦状生长,木质结构,菌盖外伸12 cm~16 cm,菌肉厚3 cm,子实体上下表面颜色一致,有肉眼可见的粗毛结构,分离子实体得到的菌丝在GYM固体培养基上呈白色,由中心向四周辐射生长。
用体式显微镜(15×)观察YM11菌株子实体的表面特征,结果见图2。
如图2所示,子实体下表面有密集的孔口,孔口呈黄褐色,每毫米2个~4个,边缘呈锯齿状;子实体上表面呈黄褐色,有较密的硬毛生长;子实体纵切面结构较松散,有明显的微管,与菌肉同色,微管内可见白色菌丝。

图2 显微镜下YM11菌株子实体形态特征Fig.2 Morphological fruit body characteristics of strain YM11
用扫描电镜观察YM11菌株微观结构,结果见图3。

图3 扫描电镜观察YM11菌株的显微形态Fig.3 The micromorphology of strain YM11 observed by SEM
如图3所示,菌丝在萌发阶段,菌丝较光滑,菌丝结构有分枝,无隔膜,菌丝在老化阶段,菌丝较萌发阶段更粗且不光滑。孢子呈圆型,直径2 μm~3 μm,表面有明显的小刺,形态基本符合硬毛粗盖孔菌的特征。
2.2 YM11菌株的分子鉴定
YM11菌株ITS序列长度为681 bp,将其在NCBI数据库中进行Blast比对,发现与硬毛粗盖孔菌C.trogii(MG779615.1)的ITS序列最为接近,见图4。选取与YM11菌株序列比对相似性较高的其他ITS序列构建了系统发育树,结果也与硬毛粗盖孔菌在一个分支,表明YM11与硬毛粗盖孔菌为同一物种。但Blast比对结果显示YM11菌株ITS序列与硬毛粗盖孔菌C.trogii(MG779615.1)最高相似性仅为98%,可见与已发表的硬毛粗盖孔菌存在遗传差异,因此,结合形态分析可以确定YM11菌株为硬毛粗盖孔菌的新菌株,编号菌株为YM11,并提交ITS序列至NCBI,获得登录号:OM908903。

图4 基于ITS序列的系统发育树Fig.4 Phylogenetic tree based on ITS sequence
2.3 YM11菌株的生物学特性
2.3.1 不同碳源对硬毛粗盖孔菌菌丝生长的影响
在不同的碳源条件下,YM11菌株菌丝生长情况见表1。
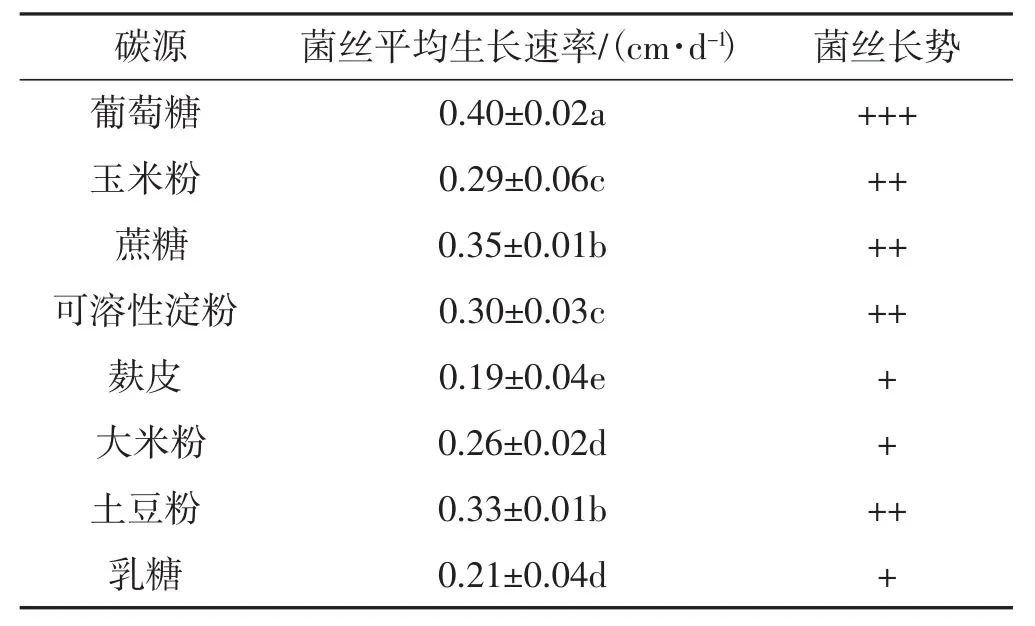
表1 不同碳源对硬毛粗盖孔菌YM11菌丝生长的影响Tab.1 Effect of different carbon sources on mycelial growth of Coriolopsis trogii strain YM11
如表1所示,YM11菌株的菌丝呈现出不同的生长趋势,以葡萄糖为碳源的菌丝生长速率最快且菌丝浓密,其次为蔗糖和土豆粉,而以麸皮和乳糖为碳源时菌丝生长速率最慢且菌丝稀疏。因此,葡萄糖为YM11菌株的良好碳源。
2.3.2 不同氮源对硬毛粗盖孔菌菌丝生长的影响
不同氮源条件下,YM11菌株菌丝生长情况见表2。
如表2所示,YM11菌株的菌丝呈现出不同的生长趋势,以酵母粉为氮源时,表现出最快的菌丝生长速率,其次为蛋白胨和牛肉膏,且以这3种原料为碳源时菌丝浓密;而以尿素和草酸铵为氮源时,菌丝生长慢,菌丝稀疏。因此,酵母粉为YM11菌株的良好氮源。

表2 不同氮源对硬毛粗盖孔菌YM11菌丝生长的影响Tab.2 Effect of different nitrogen sources on mycelial growth of Coriolopsis trogii YM11
2.3.3 不同温度对硬毛粗盖孔菌菌丝生长的影响
不同温度条件下,YM11菌株菌丝生长情况见表3。
如表3所示,YM11菌株的菌丝呈现出不同的生长趋势,5℃~40℃时,其菌丝的生长速率和长势均表现出先增加后减少的趋势,其中25℃菌丝生长速率最快,其次为20℃,在这2种温度条件下菌丝长势也最优;而在40℃条件下菌丝不生长。因此,YM11菌株最适生长温度为25℃。

表3 不同温度对硬毛粗盖孔菌YM11菌丝生长的影响Tab.3 Effect of different temperatures on mycelial growth of Coriolopsis trogii YM11
2.3.4 不同pH对硬毛粗盖孔菌菌丝生长的影响
不同初始pH条件下,YM11菌株菌丝生长情况见表4。
如表4所示,YM11菌株的菌丝呈现出不同的生长趋势,当pH为5.0~7.5时,其菌丝的生长速率和长势均表现出先增加后减少的趋势。其中pH 6.5时菌丝生长速率和长势最优,其次为pH 6.0。因此,YM11菌株最适初始pH为6.5。
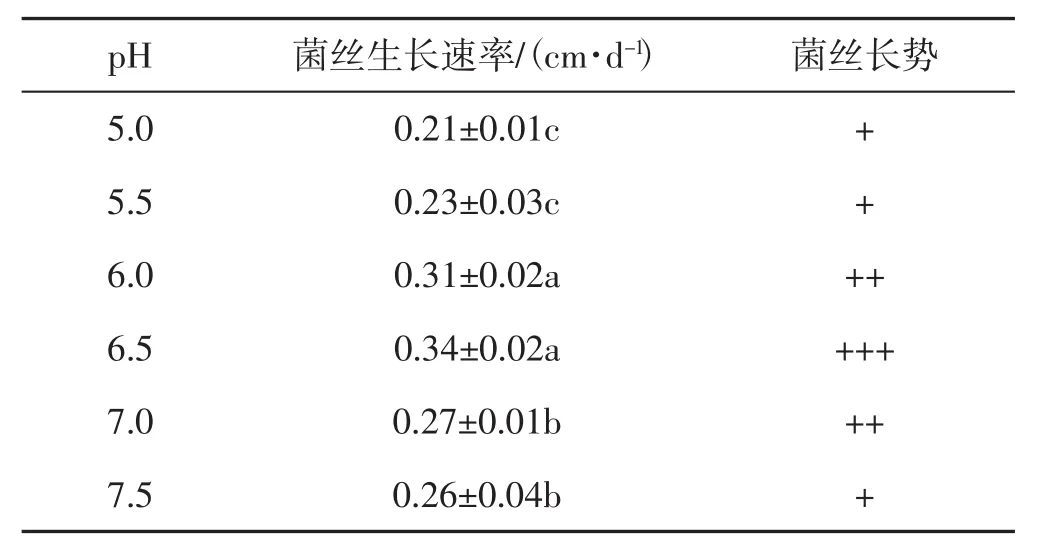
表4 不同pH对硬毛粗盖孔菌YM11菌丝生长的影响Tab.4 Effect of different pH on mycelial growth of Coriolopsis trogii strain YM11
2.4 驯化栽培结果
硬毛粗盖孔菌YM11菌株在3种不同配方的栽培料中均能长出菌丝。其中A配方的菌丝长满菌袋时间最快,为接种后31 d,其次是B配方(34 d),C配方的菌丝生长最慢,长满袋需要39 d。A、B配方的子实体产量无显著差异,每袋1.2 kg,生物学效率达58%,C配方子实体产量为每袋0.9 kg,生物学效率为52%。
栽培子实体生长情况见图5。
如图5所示,硬毛粗盖孔菌菌丝为白色,子实体生长初期为白色,成熟后为黄褐色;菌盖上表面有密集的硬毛,下表面有密集的孔状结构,与野生子实体的形态特征一致。
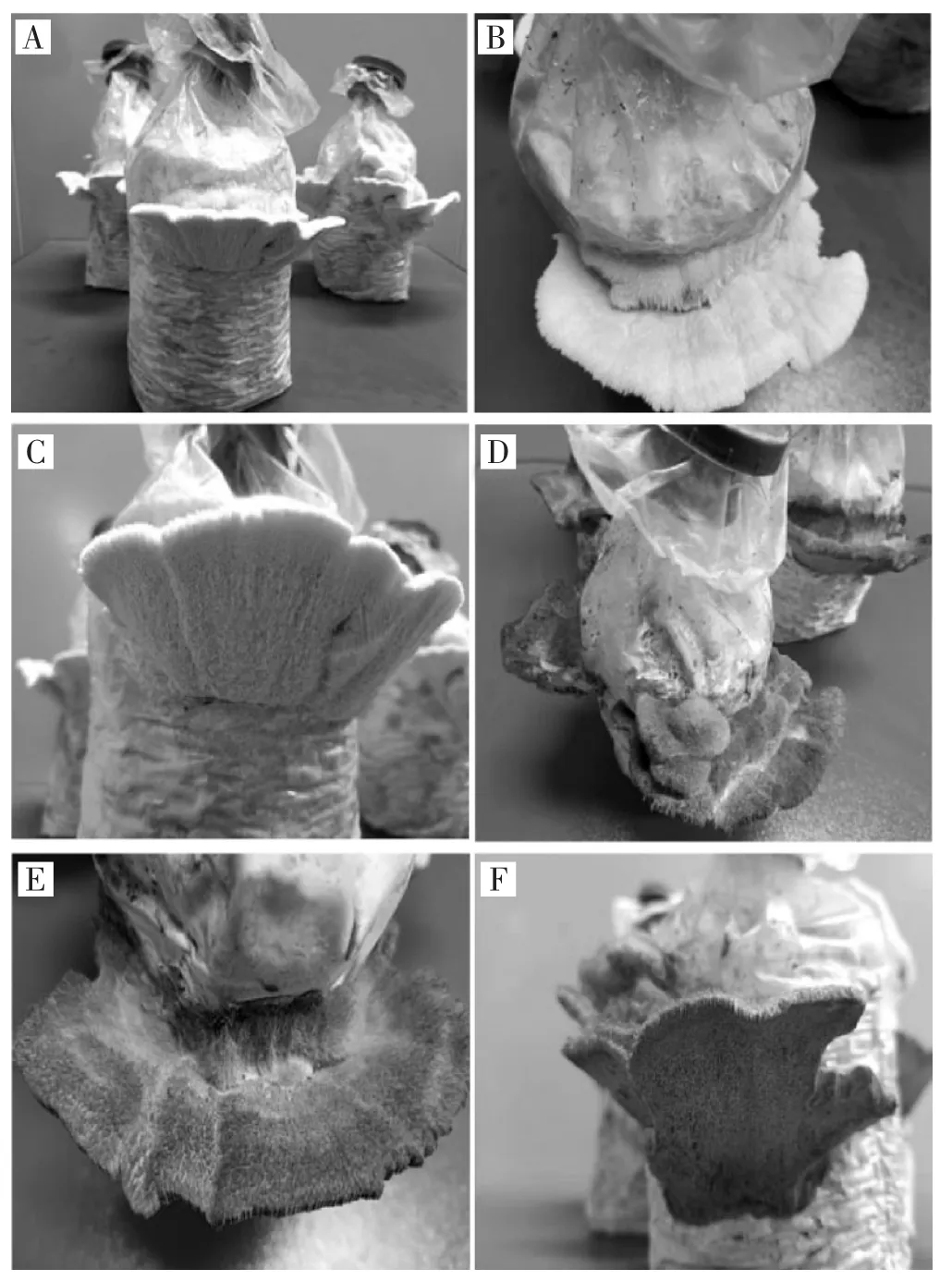
图5 硬毛粗盖孔菌YM11菌株的子实体生长情况Fig.5 Growth situation of fruit body of Coriolopsis trogii strain YM11
2.5 YM11菌株粗多糖的抗肿瘤活性
YM11菌株粗多糖处理MCF-7、Hela和Hep-3B肿瘤细胞观察细胞形态(100×),再经过MTT试验检测抑制率,试验结果见图6。
如图6A所示,细胞形态固缩、细胞数目变少,细胞受到明显的抑制。如图6B所示,通过MTT试验检测发现,肿瘤细胞的抑制率会随着粗多糖质量浓度的增加而增加,表现出明显的量效关系;其对MCF-7、Hela和Hep-3B肿瘤细胞半数抑制浓度分别为 2.43 mg·mL-1、1.37 mg·mL-1、2.14 mg·mL-1,说明其具有广谱高效的抗肿瘤活性。

图6 粗多糖对肿瘤细胞增殖的抑制作用Fig.6 Inhibitory effect of crude polysaccharides on tumor cell proliferation
3 讨论
硬毛粗盖孔菌在分类上目前还没有统一,有3个拉丁名,分别为 C.trogii[6]、T.trogii[7]、F.trogii[8]。其中,T.trogii属于栓菌属(Trametes),其形态和ITS序列与硬毛粗盖孔菌相似性非常高,所以常被误认为是硬毛粗盖孔菌,现在仍有部分学者使用该拉丁名。硬毛粗盖孔菌也曾经一直被误认为是法国粗毛盖孔菌(Funalia gallica),直到2009年由我国学者确认为中国新记录种,命名为F.trogii[22]。但其在NCBI数据分类地位上又属于革孔菌属(Coriolopsis),因此,目前比较广泛应用且认可度较高的拉丁学名为C.trogii[23]。
研究通过结合形态学和分子生物学对一株野生硬毛粗盖孔菌进行了分离与鉴定,发现该菌株与硬毛粗盖孔菌C.trogii(MG779615.1)的ITS序列最为接近,但最高相似性仅为98%,可见与已发表的硬毛粗盖孔菌存在遗传差异,且系统发育树与硬毛粗盖孔菌在一个分支,因此确定该菌株为硬毛粗盖孔菌的新菌株,丰富了硬毛粗盖孔菌菌种资源。
试验发现硬毛粗盖孔菌最适碳源为葡萄糖,最适氮源为酵母粉,最适初始pH为6.5,最适培养温度为25℃。试验结果可为该菌的菌种制备和栽培提供重要参考,对硬毛粗盖孔菌栽培袋的培养料进行了3种配方的筛选,其中A配方菌丝生长速度最快、子实体产量最高、生物学效率最好。研究首次实现了硬毛粗盖孔菌的人工栽培,人工栽培硬毛粗盖孔菌具有菌盖更大、颜色更深,菌肉更厚等性状,且没有覆瓦状生长,这可能与栽培过程中环境因素和管理方式有关,今后需进一步优化栽培条件以提高子实体产量。
通过提取栽培子实体粗多糖,发现该菌的子实体多糖能抑制MCF-7、Hela和Hep-3B肿瘤细胞,其半数抑制浓度分别为 2.43 mg·mL-1、1.37 mg·mL-1、2.14 mg·mL-1,具有广谱高效的抗肿瘤活性,可为该菌的进一步开发利用提供重要参考。

