DWI视觉尺度评估及ADC值测量在未强化胶质瘤分级判定中的对比研究
重庆大学附属三峡医院放射科(重庆 404100)
张丽玲 丁 爽*
胶质瘤是颅内最常见的神经上皮源性肿瘤[1],通常造影后的增强程度被作为恶性的标志,然而,在MRI肿瘤的研究中发现未强化并不等同于低级别肿瘤;且高级别和低级别胶质瘤在MR成像上可能会有重叠的特征[2],并不能真实反映胶质瘤的分化程度,因此仅凭借MRI增强扫描难以指导临床治疗方案的制定及评估预后。扩散加权成像(diffusion weighted imaging,DWI)作为弥散成像技术中最简便的一种成像手段,可以量化水分子弥散受限程度,其表观弥散系数(apparent diffusion coefficient,ADC)与肿瘤细胞密度及良恶性有一定相关性[3],现已广泛应用于颅内各种肿瘤的分级疗效评估中,但在不同MR扫描仪中ADC图的后处理存在一定差异。DWI视觉尺度作为更加简便的方式,无需后处理即可对肿瘤进行分级。因此,能否用简便的DWI视觉尺度评估未强化胶质瘤的分级是本研究的重点。
1 资料与方法
1.1 研究对象回顾性分析2017年至2020年就诊于新疆医科大学第一附属医院并确诊为未强化胶质瘤患者的影像资料。
纳入标准:经过手术病理检查证实符合脑胶质瘤的诊断;术前均行头颅MRI平扫、增强扫描和DWI序列扫描,且相关影像学资料保存完整;MR影像表现为未强化胶质瘤。排除标准:有肿瘤病史或放化疗史; 图像不全或质量不佳(如有运动或金属伪影),无法进一步分析。根据纳入和排除标准,本研究共纳入30例未强化胶质瘤患者,年龄27~70岁,男16例,平均年龄46.5岁,女14例,平均年龄42岁;Ⅰ~Ⅱ级胶质瘤13例,Ⅲ~Ⅳ级胶质瘤17例。
1.2 方法采用美国GE公司的3.0T Signa Hdx System双梯度超导磁共振及西门子Skyra 3.0T。包括常规扫描:轴位T1WI(TR/TE2430ms/13ms)、T2WI(TR/TE3840ms/116ms)及T2Flair(TR/TE8000ms/167ms);矢状位T2WI(TR/TE3380ms/122ms)。层厚6mm,层间距2mm,扫描层数18层,FOV 220×220,矩阵200×200。轴位DWI序列:采用单次激发自旋回波序列,TR/TE6600ms/100ms,层厚6mm,层间距2mm,扫描层数18层,FOV 220×220,矩阵200×200,弥散敏感系数取b=0mm2/s和b=1000mm2/s。 增强扫描:行常规轴位、矢状位和冠状位扫描,扫描参数同常规扫描。造影剂为Gd-DTPA,注射速率4mL/s。
1.3 影像分析由2位具有15年以上年资的放射科医师采用盲法对30例未强化胶质瘤患者的DWI图像进行分级,根据文献[4]对肿瘤的信号强度(signal intensity,SI)进行了1~5分的评分,在b=1000s/mm2时,DWI上肿瘤信号强度的5点评分为:1分:明显低信号,接近于正常脑脊液;2分:正常脑脊液与正常皮层下白质间信号;3分:信号强度等于或类似于正常皮层下白质;4分:正常皮质下白质与正常皮质间强度信号;5分:肿瘤混合区强度高于正常白质,大部分(至少60%)肿块实性部分是采用肿瘤尺寸最大的单片轴位切面进行评分的。如2位医师意见不统一时,通过协商达到一致。
1.4 ADC值测量使用GE ADW4.4及西门子Syngo Via工作站对患者DWI图像进行后处理。点击ADC调整阈值,使其能够包含整个脑组织,计算并生成匹配的ADC图;将肿瘤与生成的ADC图进行匹配,对肿瘤实性区域进行手工绘制ROI,测量ADC值。在ROI的选取过程中,尽量一致选择肿瘤实质内相对均质的区域,避免勾画到肿瘤内部的囊变、坏死区或有出血的部分。对每个肿瘤分别选择5个ROI进行测量,并取5次测量的平均值。
1.5 统计学分析采用SPSS 21.0统计软件进行数据的分析整理,计数资料以例数描述,统计推断等级资料组间差异用非参数秩和检验;不符合正态分布计量资料采用中位数(四分位数)描述,组间比较用非参数秩和检验分析。用ROC诊断曲线确定指标诊断截点并进行指标评价。P<0.05时差异有统计学意义。
2 结 果
2.1 DWI视觉尺度对未强化胶质瘤分级的评估30例未强化胶质瘤中评分为2的有2例,均为低级别胶质瘤,见图1~图4;评分为3的有11例,其中低级别胶质瘤8例,高级别胶质瘤3例;评分为4的有8例,其中高级别胶质瘤有5例,见图5~图8,低级别胶质瘤有3例;评分为5的有9例,均为高级别胶质瘤;未见低级别胶质瘤评分为5,未见高级别胶质瘤评分为2,无病例的评分为1(具体分布见表1)。采用DWI视觉尺度评估未强化胶质瘤分级的敏感性为82.4%,特异性为76.9%,阳性预测值为82.4%,阴性预测值为76.9%,准确率为80%。
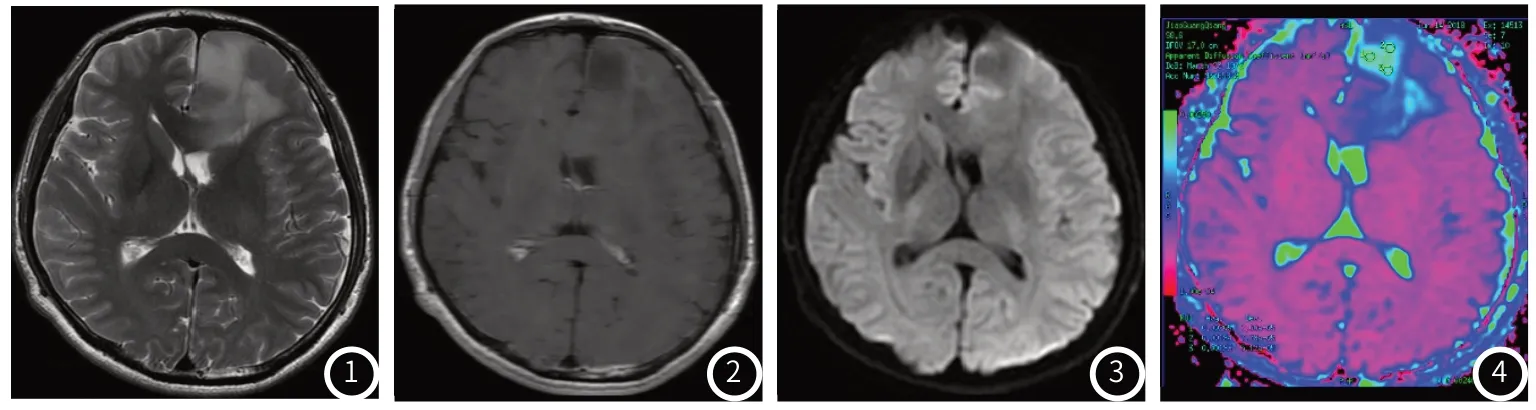
图1~图4 男,46岁,左侧额叶弥漫少突胶质细胞瘤,WHOⅡ级。图1 T2WI呈稍高信号,图2 T1WI增强扫描未见明显强化,图3 DWI呈稍低信号,图4 ADC图测ADC为1.26×10-3mm2;视觉尺度评分为2。
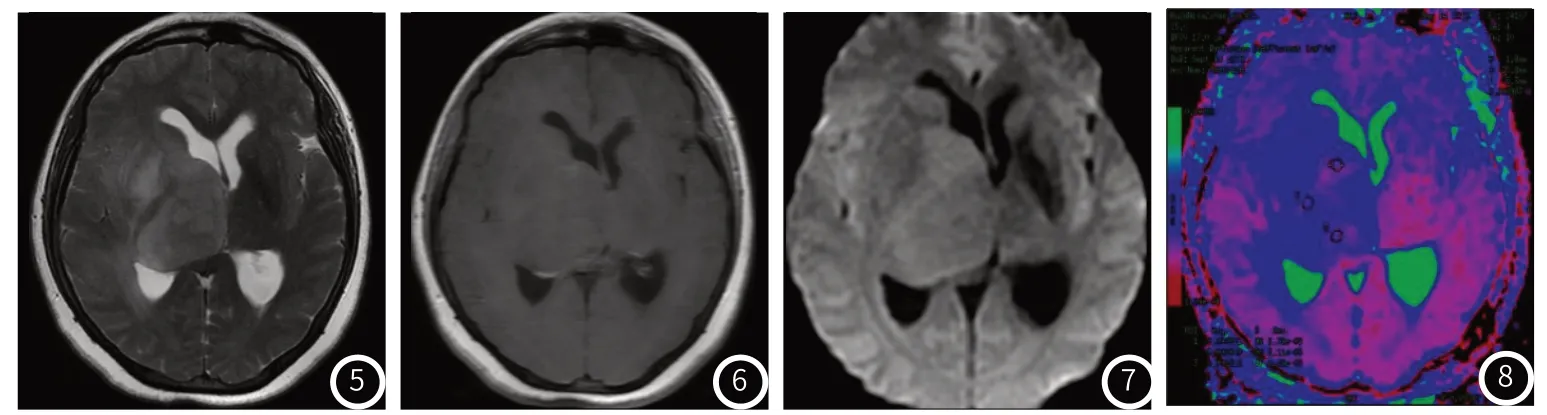
图5~图8 女,43岁,右侧顶叶胶质母细胞瘤,WHOⅣ级。图5 T2WI呈稍高信号,图6 T1WI增强扫描未见明显强化,图7 DWI呈稍高信号,图8 ADC图测ADC为0.93×10-3mm2;视觉尺度评分为4。
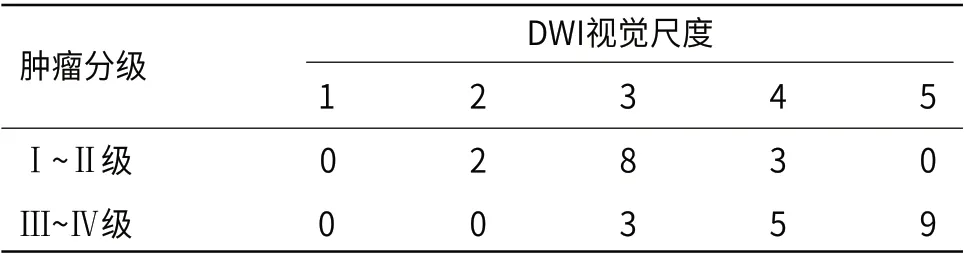
表1 未强化胶质瘤分级的DWI视觉尺度分布
2.2 ADC测量值对未强化胶质瘤分级的评估高级别组的ADC值明显低于低级别组,差异有统计学意义(P<0.05)。具体ADC测量值见表2。采用ADC测量值诊断未强化胶质瘤分级的敏感性为84.6%,特异性为94.1%,阳性预测值为88.9%,阴性预测值为91.7%,准确率为90%。
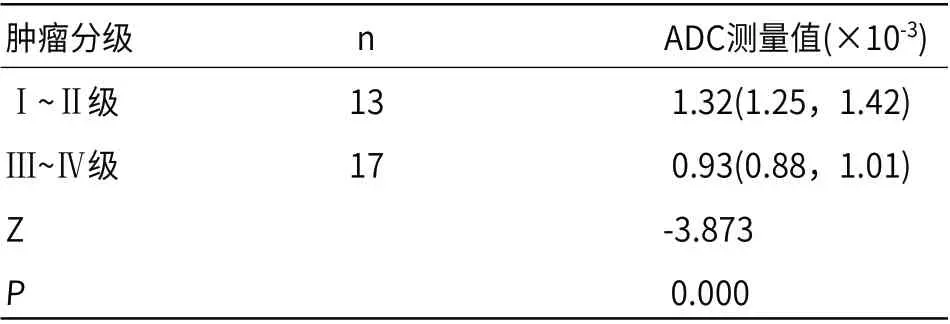
表2 未强化胶质瘤分级的ADC测量值
2.3 视觉尺度评估与ADC测量值评估比较分析DWI视觉尺度评估和ADC测量值数据,采用受试者工作特征曲线下面积(area under the curve,AUC) (ROC)对未强化胶质瘤分级诊断准确性进行比较(ROC曲线见图9)。视觉尺度评估曲线下的面积小于ADC测量值,两者之间的差异有统计学意义(P<0.05)。由ROC曲线可得,DWI视觉尺度分级曲线下面积AUC为0.871,标准误0.064,P=0.001,95%置信区间(0.746~0.996),说明DWI视觉尺度诊断未强化胶质瘤分级效果较好,获得其诊断截点为3。ADC测量值曲线下面积AUC为0.914,标准误0.053,P=0.000,95%置信区间(0.811~1.000),说明ADC测量值诊断未强化胶质瘤分级效果也较好,获得其诊断截点为1.175×10-3mm2。因此两种方法诊断未强化胶质瘤分级效能均较好,且ADC测量值诊断效能略优于DWI视觉尺度评估,见表3。
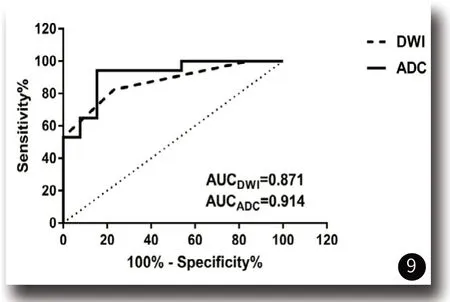
图9 ROC曲线。
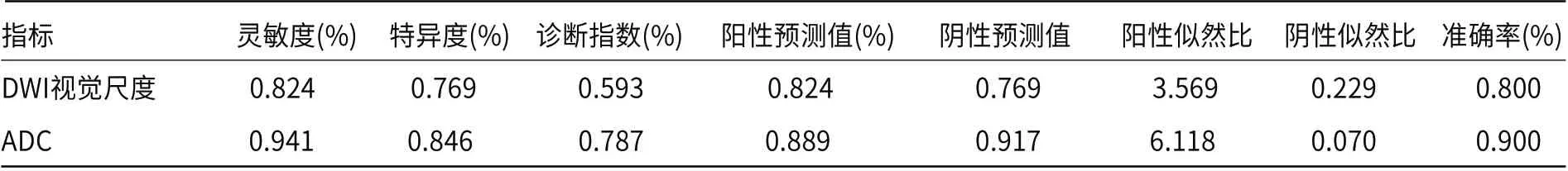
表3 ROC曲线结果评价
3 讨 论
脑胶质瘤病灶区域常常表现为轻微的弥漫性肿胀及边界模糊[5],是因为肿瘤细胞常呈浸润性生长在神经束间、神经细胞和血管周围,但被浸润损害的脑实质其结构变化并不明显,因此在MR增强扫描成像不能真实反映胶质瘤的级别,且不能很好的指导临床治疗及反映预后。2012年的中国中枢神经系统胶质瘤诊断和治疗指南亦指出[6],对于患有低级别胶质瘤的患者,在仅进行外科手术切除,无须放化疗即能取得较好的预后,而对于具有高度侵袭性的高级别胶质瘤而言,其生长迅速且易向周围组织扩散,肿瘤边界显示不清,很难对肿瘤及正常脑组织进行区分,在仅进行外科手术切除后往往复发率较高,因此,此类患者在进行外科手术切除后仍需进行放化疗治疗。由此可见,对胶质瘤进行准确的分级诊断,对于患者治疗方案的制定及预后均有重大意义。
DWI作为弥散成像技术中最简便的一种成像手段,通过对水分子的运动过程进行观察,为脑组织生理状态变化提供信息[7],且DWI无需使用造影剂,是目前唯一的观察活体组织内微观水分子运动的成像技术[8]。与正常脑组织相比,肿瘤细胞的密度一般高于正常组织,且高级别肿瘤细胞增殖能力更强,细胞密度更大,细胞外间隙更小[9],导致水分子自由扩散运动空间减小、运动速度降低,而DWI信号强度与ADC值之间存在负指数函数关系[10],因此ADC值可预测胶质的良、恶级别。且本研究表明ADC值测量对未强化胶质瘤的分级有较高的灵敏度及特异度。
视觉评估是一种简单快速的肿瘤分级方法,研究发现,DWI视觉尺度评估可以为胶质瘤分级提供信息,但对未强化胶质瘤分级评估的研究较少。本研究采用DWI视觉尺度评估未强化胶质瘤的级别,结果显示DWI视觉尺度评估可以对未强化胶质瘤进行分级,且DWI视觉尺度评估与ADC值测量的诊断效能一致,但DWI视觉尺度对未强化胶质瘤分级的灵敏度、特异地、准确率略低于ADC测量值,与Warinthorn等[4]研究结果不一致,是因为本文主要研究的是未强化胶质瘤,说明在未强化胶质瘤中定量指标ADC对肿瘤的分级更有优势。
但是此研究仍有几个局限性,主要的限制是研究对象均为未强化胶质瘤,样本量相对较小,对统计结果可能存在偏倚。其次,在手工勾画感兴趣的区域时,很难避免一些偏差,如肿瘤内的小囊变、坏死及周围的轻度水肿,而肿瘤内部的囊变、坏死和其周边的水肿等改变通常与微血管的通透性有关。同时这是一个回顾性研究,验证结果还需要更大规模的前瞻性试验来证实。
综上所述,DWI视觉尺度和ADC值测量均能区分高级别和低级别未强化胶质瘤。通常认为ADC值测量是一种更准确的胶质瘤分级方法,本研究结果表明,DWI视觉尺度也可以用于评估未强化胶质瘤分级,但其特异度、灵敏度及准确度均较ADC测量值低,其诊断价值需在更大范围的前瞻性研究中进行验证。
———占旭刚4

