β-环糊精和α-生育酚包合物的合成表征和评价
曹 川,解 鹏
(1.安徽职业技术学院环境与化工学院,合肥 230011;2.南京财经大学粮食经济研究院,南京 210046)
β-环糊精(β-CD)通过α-1,4糖苷键将7个吡喃葡萄糖单元连接组成的环状寡糖,β-环糊精是安全的风味载体和保护剂[1]。α-生育酚是植物油中极好的抗氧化剂,并保护这些产品免于脂质过氧化,同时,α-生育酚也是维生素E最广泛的使用形式,但是,它们在水中的溶解性差,在氧气、光线和碱性条件下会分解[2-3]。生育酚在环境温度下为液体,极难分散在水中,目前已经报道了改善生育酚不良特性的研究,包括β-环糊精或其衍生物的复合物[4]、淀粉的纳米包封[5]和 脂质体形成[6]。Koontz等[7]已经评估了环糊精和γ-生育酚包合物的形成和固态表征,采用共沉淀技术合成β-CD与γ-生育酚包埋物。优化了包埋物合成最优条件并用13CNMR方法进行表征,但没有对α-生育酚的包合物、物理混合形式和游离形式进行比较研究。由于复合物形成过程中结构的变化导致其理化性质发生变化,本研究采用共沉淀的方法制备了不同比例的β-CD和α-生育酚包合物,通过XRD,FTIR、TGA和1H NMR光谱对其包合物进行表征,表明客体与β-CD宿主在分子水平上的相互作用。β-CD的络合保护了客体物质,天然抗氧化剂的β-CD包合物的热稳定性增强,包埋物具有氧化稳定性和控释特性,增强储存稳定性,β-CD可以用作保护抗氧化剂和其他生物活性化合物的壁材,并改善其在食品工业中的用途。
1 材料与方法
1.1 试验材料
α-生育酚,美国Sigma公司;β-CD、氢氧化钠、乙酸钠,国药集团化学试剂有限公司;无水乙醇、乙酸均为分析纯,国药集团化学试剂有限公司。
IS50傅里叶变换红外光谱仪(FT-IR),美国尼高力仪器公司;Rigaku TTR-III X射线衍射仪(XRD),日本理学电机公司;S-4800扫描电镜,日本日立仪器公司;AVANCE III 400WB BRUKER NMR光谱仪,瑞士布鲁克光谱仪器公司;SDT Q600 TA差热热重联用仪,美国TA公司;T9紫外可见分光光度计,北京普析通用仪器有限责任公司;JW-1016离心机,佳文设备工业有限公司。
1.2 试验方法
1.2.1 包合物制备 准确称取2 g β-CD至锥形瓶中,加入20 mL蒸馏水,60℃搅拌30 min。将体积比为1:2的α-生育酚与无水乙醇混合物添加到冷却至室温的β-CD溶液中,将α-生育酚与β-CD以不同摩尔比(1:3,1:4,1:5,1:6,1:7,1:8)混合,然后将混合物在30 ℃搅拌4 h。在涡旋振荡器将混合溶液涡旋5 min,4℃冰箱中平衡12 h,达到反应平衡,5 000 r·min-1离心15 min,收集沉淀物干燥备用[8]。
1.2.2 α生育酚和β-CD物理混合物制备 将α-生育酚和β-CD以1:7摩尔比添加至研钵中研磨,用刮铲将成分混合以获得均匀的混合物[1]。
1.2.3 包埋率 包埋率(EE)用紫外分光光度计于292 nm波长处对α-生育酚进行定量分析[9],将α-生育酚/β-CD复合物在95%乙醇中解离24 h,以4 000 r·min-1的速度离心10 min,保留上清液。根据公式计算复合物中α-生育酚含量[10-11]。包埋率EE(%)=截留的活性化合物含量/初始活性化合物含量×100。
1.3 项目测定
1.3.1 XRD测定 通过X射线衍射法测定样品的晶体结构,扫描区域为0~50 °,扫描速率2 °·min-1。使用MDIJade6.0软件记录样品的晶体类型和结晶度[12]。
1.3.2 FT-IR光谱测定 样品与无水KBr体积比为1:100,研磨混合后,将所得样品粉末压制成薄圆盘状。通过FT-IR光谱分析,扫描范围为4 000~4 00 cm-1,分辨率4 cm-1。
1.3.31H NMR光谱 使用NMR光谱仪进行样品测定,扫描频率为100.4 MHz。测试条件为旋转速率5 k Hz,累积扫描次数1 000次。
1.3.4 扫描电子显微镜(SEM) 将干燥分散后的样品分散在铝棒上,在表面喷涂铂/钯合金。扫描电镜加速电压1.0 kv,放大倍数1 000倍[13]。
1.3.5 热性能分析 称取样品5 mg,在50 mL·min-1氮气流下,温度以10 ℃·min-1从50 ℃升到640 ℃。
1.3.6 抗氧化活性测定 将样品保存在室温下,分别于1、2、3、4、5、6、7 d移出,于517 nm 波长处测定样品吸光度,样品抗氧化活性通过DPPH自由基清除率测定[14]。
1.4 数据分析
试验数据采用Origin 8.0和SPSS21.0软件对数据进行相关性分析和回归分析。
2 结果与分析
2.1 包埋率分析
不同摩尔比的α-生育酚/β-CD的包埋率如图1所示。包合物的包埋率为38%~72%。α-生育酚/β-CD的摩尔比从1:3升至1:7时,更多的生育酚被捕获在β-CD腔中,当摩尔比为1:7时,包埋率达到最大值,为72%。然而,当摩尔比从1:7升至1:8时,包埋率基本不变。物理混合物的包埋率较低,可能是由于样品中α-生育酚的吸附误差产生[15]。因此选择α-生育酚/β-CD的摩尔比为1:7时制备包合物。
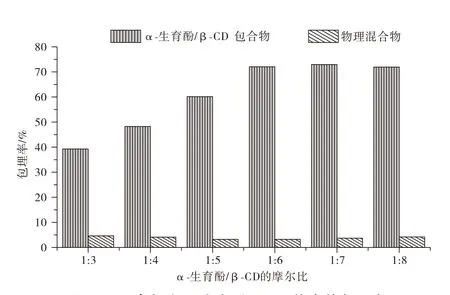
图1 不同摩尔比α-生育酚/β-CD络合的包埋率
2.2 XRD分析
β-CD、物理混合物以及α-生育酚/β-CD包合物的XRD图谱如图2所示,当XRD图谱中出现新峰形成漫射衍射图,或者特征峰的消失都可以表征包合物形成[16]。β-CD的XRD图谱显示出它的峰是强烈而尖锐的,表明其晶体性质。Kayaci等[17]研究表明,β-CD的分子结构是笼式结构,有利于包埋小分子物质形成包合物。α-生育酚/β-CD包合物与β-CD的XRD的特征峰相比,衍射角在4.8°和8°处的特征峰消失,但衍射角在17°处显示新高峰出现,这些高峰形成可能与分子的结构变化有关,表明α-生育酚被络合在β-CD空腔中。物理混合物的衍射图与β-CD的特征峰相似但峰强度不同。综上表明,α-生育酚被β-CD成功包埋,形成包合物。
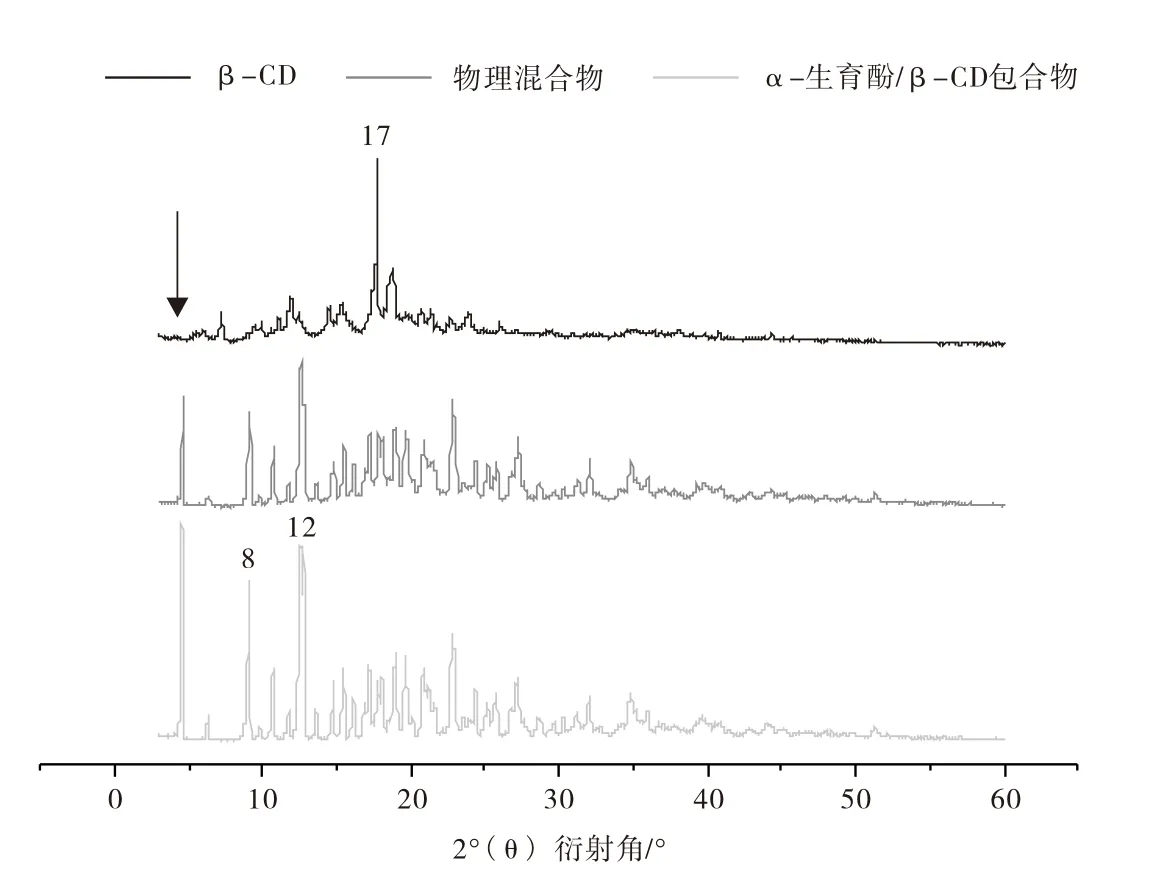
图2 β-CD、物理混合物和α-生育酚/β-CD包合物的XRD图谱
2.3 FT-IR分析
包合物、物理混合物、α-生育酚和β-CD的FTIR谱图如图3所示,α-生育酚的FTIR光谱显示在1 750、2 928 cm-1处的特征谱带分别是由C=O和C-H的拉伸振动引起[18]。与游离α-生育酚相比,包合物在1 158 cm-1(CO),1 750 cm-1(C=O),2 857(CH3)处频带信号强度降低。客体分子特征带的变化,例如峰强度的降低,消失和加宽,归因于CD腔中客体分子拉伸振动限制,客体分子的嵌入减少了被包埋分子的运动并降低了信号强度[19-20],同时表明这些键可以参与其中形成配合物[21]。包合物与β-CD相比,该络合物在特征带O-H峰位置由3 321 cm-1偏移为3 308 cm-1,在包合物中,OH-弯曲(1 641 cm-1)和糖苷键的C-O-C弯曲(1 008 cm-1)振动没有显著变化。客体的峰信号降低和偏移也表明包合物的形成,说明其发生了相互作用。物理混合物中观察到β-CD和α-生育酚的特征带,表明分子之间几乎没有相互作用。
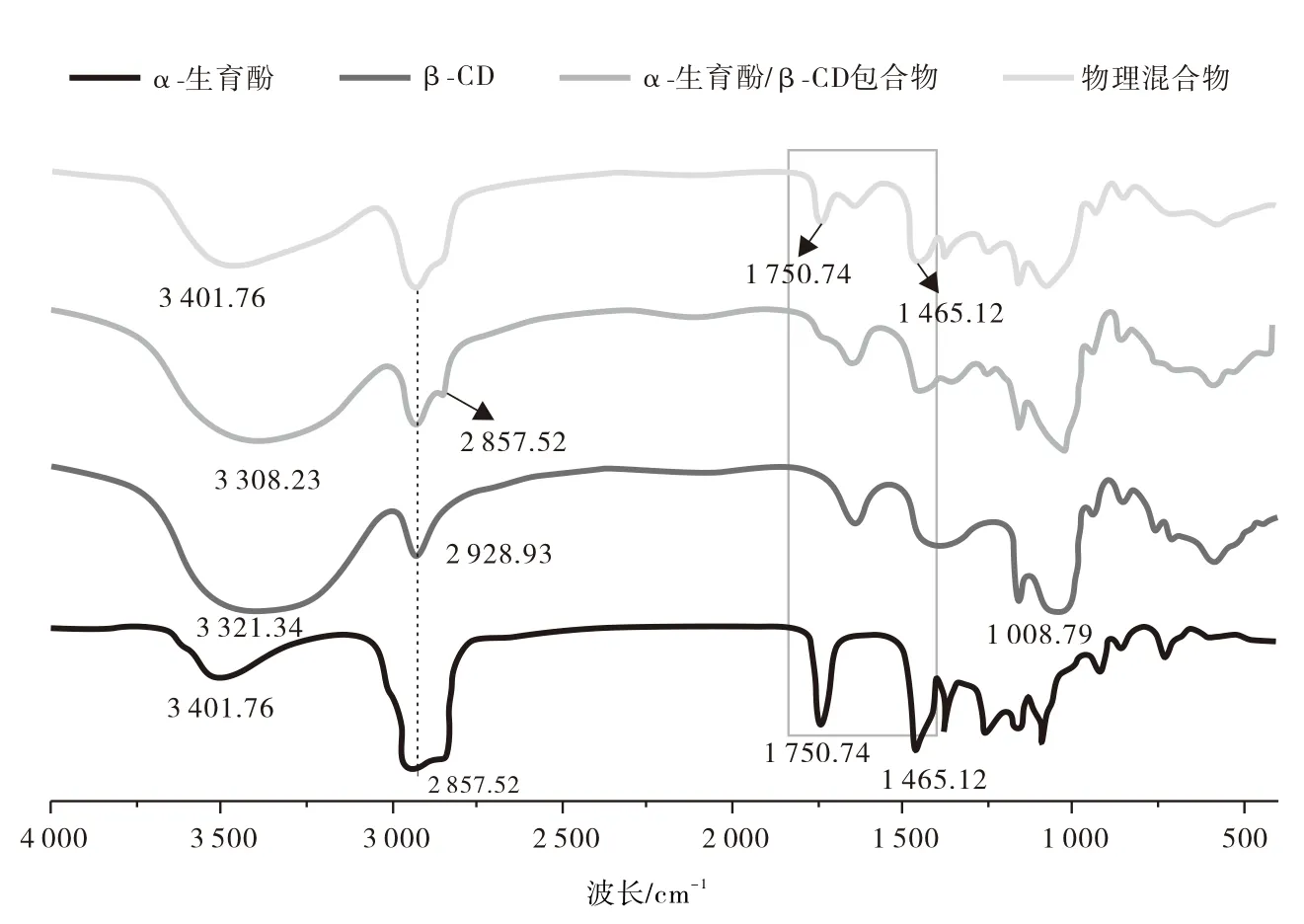
图3 β-CD、α-生育酚、物理混合物和α-生育酚/β-CD包合物的FTIR图谱
2.4 1H NMR分析
β-CD、α-生育酚、物理混合物和包合物在DMSO-d6中的1H NMR如图4所示,1HNMR光谱已用于研究和表征嵌入式工具,以验证包合物的真实形成[22]。1H NMR光谱表明,α-生育酚/β-CD包合物的O-H与β-CD分子的骨架质子的存在显示0.3 ppm的化学位移。这些化学位移的变化很小,因为它们之间的相互作用是非共价键。包合物中的信号与物理混合物和游离的α-生育酚的信号相比,均有所改变。物理混合物的谱图中可以发现β-CD和α-生育酚信号,但信号强度降低了。结合分子水平的FT-IR和1H NMR分析结果。综上表明,α-生育酚/β-CD包合物已经被成功制备。
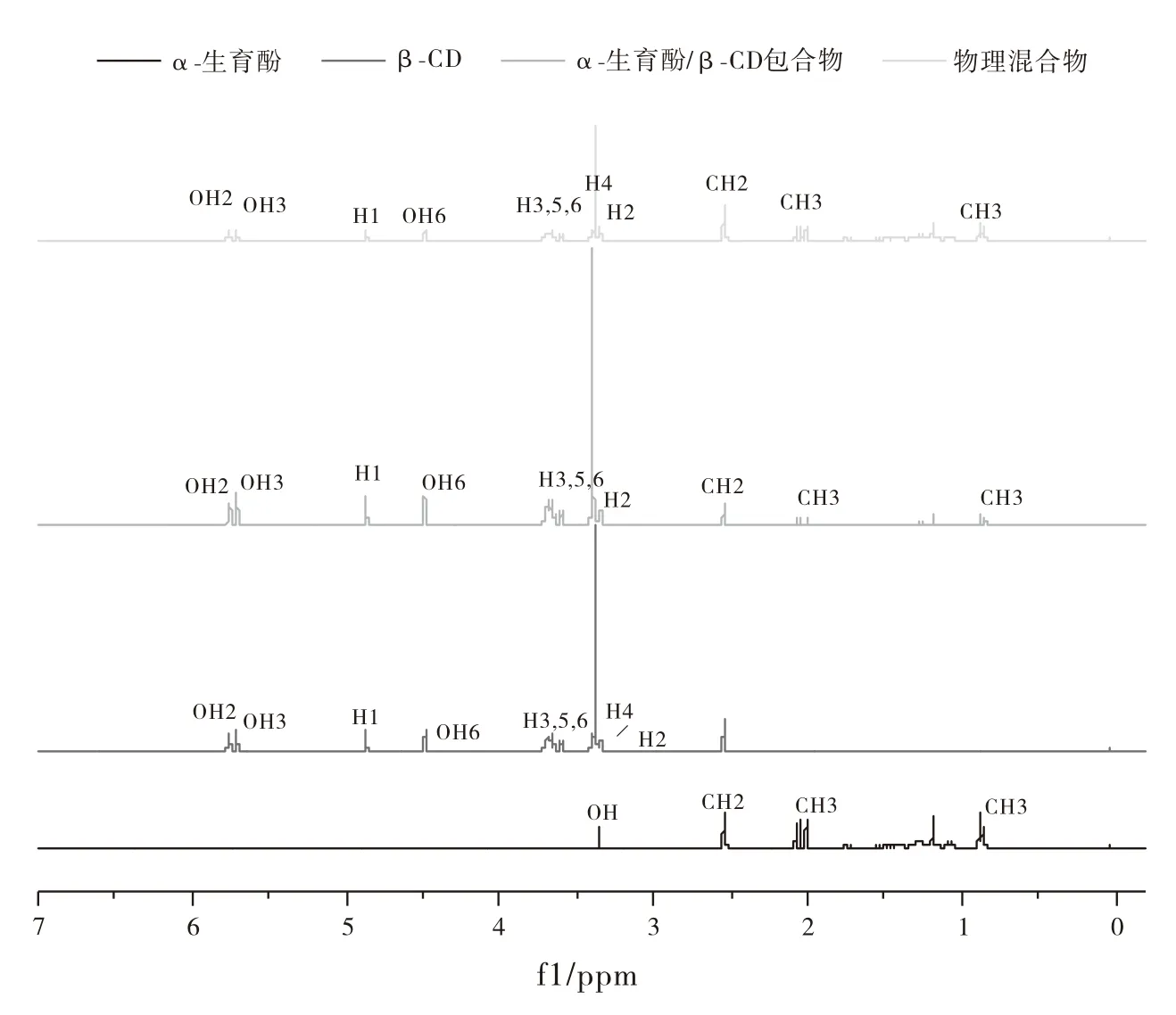
图4 β-CD、α-生育酚、物理混合物和α-生育酚/β-CD包合物的1H NMR
2.5 扫描电镜分析
样品的颗粒形态如图5A~C所示,β-CD可能是客体化合物形成包合物的良好宿主分子[23]。β-CD具有不规则的块状形状(图5C),物理混合物显示球形颗粒与碎片混合(图5A)。显然,α-生育酚与β-CD混合或粘附于物理混合物的表面。然而,包合物与物理混合物相比,观察到的结构的粒径和形状发生了变化(图5B),显示了球形颗粒和混合碎片结合,观察到较小的团簇形成,这表明可能形成了络合物[24]。Galvão等[20]研究评估了β-CD和橙或桉树精油包合物的形态,显示与纯β-CD相比粒径和形状的变化。因此,β-CD和包合物的不同形态表明包合物的形成。

图5 样品的颗粒形态
2.6 热重分析(TGA)分析
β-CD、α-生育酚,包合物和物理混合物的TGA谱图如图6所示,β-CD与α-生育酚之间的相互作用极大影响了热稳定性,该分析显示β-CD与包合物的三个区域的质量损失。第一个区域在150 ℃左右,质量损失10%以下,可能是由于与β-CD相关的表层水蒸发所致。第二阶段约为200℃,质量损失为2%,可能是由于内部水分蒸发所致。第三个阶段约为350℃时,质量损失为80%,可能与化合物降解有关[25]。样品之间差别较明显阶段在第一和第三阶段,α-生育酚/β-CD包合物显示出更高的热稳定性[26]。此外,物理混合物也表现三个阶段的质量损失现象。可以观察到,物理混合物第一阶段的质量损失约为50%,高出包合物质量损失4倍以上。此外,α-生育酚的TG曲线可以在280℃观察到独特的过程,该过程由于蒸发而损失95%质量。可以得出结论,包合物比物理混合物和游离α-生育酚更稳定,表明包合物的形成。
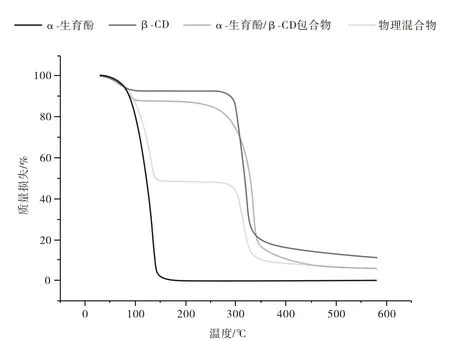
图6 α-生育酚、β-CD、α-生育酚/β-CD包合物和物理混合物的热重图
2.7 抗氧化活性分析
DPPH是一种广泛用于测试抗氧化剂分子清除自由基的化合物,适用于亲脂性抗氧化剂的研究,抗氧化活性是α-生育酚的基本特征。α-生育酚、物理混合物和包合物的DPPH自由基清除活性测定如图7所示,包合物的抗氧化活性明显高于物理混合物和游离形式的α-生育酚的抗氧化活性[27-28]。表明物理混合物的自由基清除能力类似于游离α-生育酚。在室温(25±1)℃放置7 d,三种抗氧化剂的活性均降低,但是α-生育酚和物理混合物的降低速度更快,α-生育酚的DPPH自由基清除能力迅速从80.2%降低至15.3%,原因是分子中以游离形式存在的α-生育酚具有酚羟基。包合物DPPH自由基清除能力从80.6%降低到42.7%,表明包合物可以持续稳定释放α-生育酚的抗氧化活性。究其原因β-CD作为壁材,避免温度和氧气损坏的屏障,从而提高抗氧化剂的稳定性。
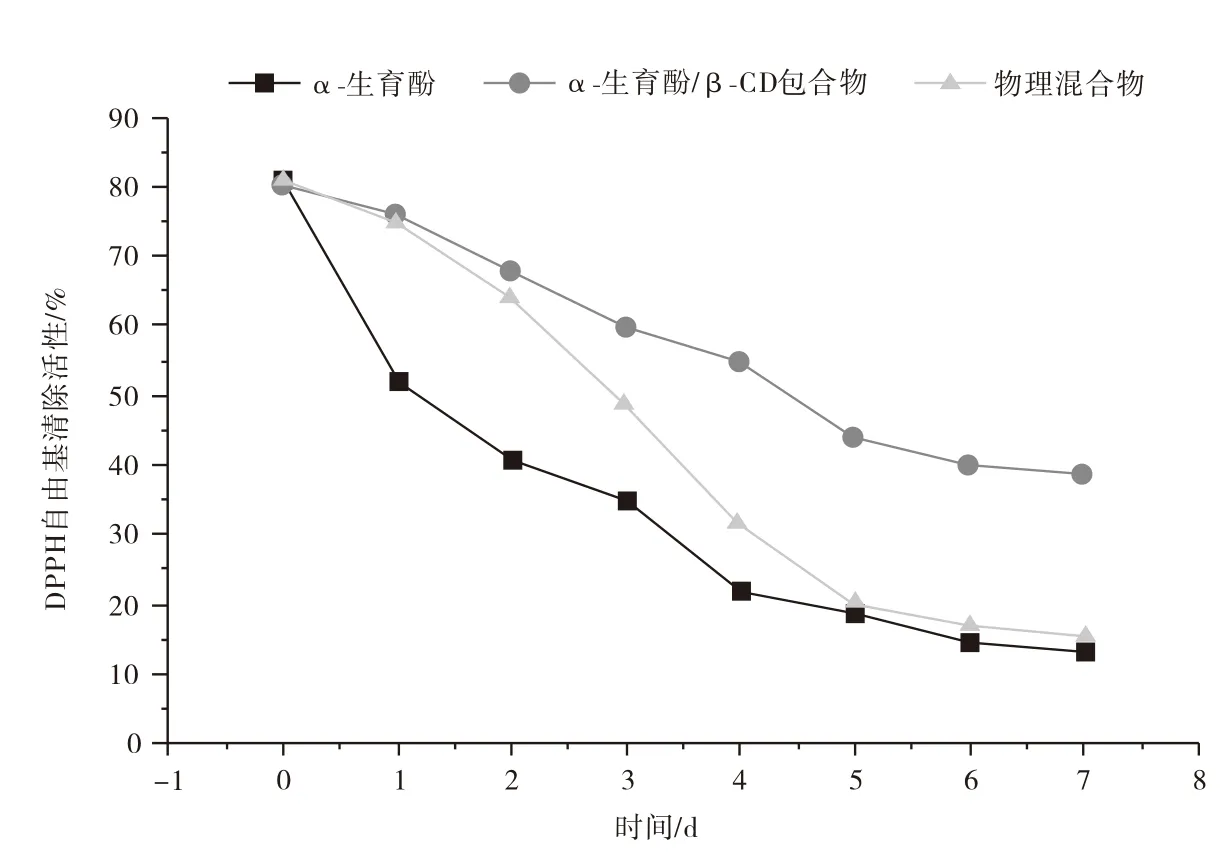
图7 α-生育酚、物理混合物和α-生育酚/β-CD包合物的自由基清除率
3 结论
本研究表明,通过共沉淀法β-CD成功包埋了α-生育酚。当α-生育酚与β-CD的摩尔比为1:7制成的包合物具有较高的包埋率。通过SEM,XRD,FTIR和1H NMR证实α-生育酚/β-CD包合物的形成。同时,包合物可以提高α-生育酚的热稳定性和抗氧化活性,扩大α-生育酚在食品等行业的应用领域,为β-CD作为壁材包埋活性物质提供参考依据。

