JNK信号通路对犬骨髓间充质干细胞多能性基因表达的影响
田仰清,郭 娟,汪娅媛,严 涵,昂艳芬,闫晓霞,严玉霖*
(1.云南农业大学动物医学院,云南昆明 650201;2.云南西双版纳州动物疫病预防控制中心,云南景洪 666100)
骨髓间充质干细胞(bone mesenchymal stem cells,BMSCs)不仅可多向分化、自我增殖,还具有分离难度较低、组织来源丰富、同种异源注射免疫排斥反应小等优点[1],在临床医疗中具有极大的潜能和研究价值,而以犬骨髓间充质干细胞(canine bone mesenchymal stem cells,cBMSCs)为基础的再生医学是兽医学研究的热点和前沿领域[2]。骨髓是机体内BMSCs含量最丰富的组织,但骨髓有核细胞中BMSCs数量极少,仅占细胞总数的0.001%~0.1%[3],且在分离传代过程中BMSCs会逐渐老化丧失多能性,严重影响细胞定向分化的效率及增殖[4]。因此,探索并认识影响BMSCs多能性的外在条件和内在机制是目前急需解决的关键问题。
c-Jun氨基末端激酶(c-Jun N-terminal kinase,JNK)也称为应激激活蛋白激酶,是哺乳类细胞中丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路的另一亚类。当生物因素(如α干扰素、白介素1、细胞内毒素)、物理因素(如电离辐射、渗透压、紫外线、高温)等因素的干扰机体时,将会活化JNK信号通路。JNK信号通路参与细胞增殖和分化、形态维持、骨骼构建、凋亡、恶性转化等生物反应,在细胞增殖、分化和应激中也发挥重要作用[5-6]。
SP 600125是JNK信号通路的可逆ATP竞争性抑制剂[7-8],可有效抑制JNK信号通路中相关基因的表达。JNK信号通路在细胞增殖和分化中发挥重要作用,有研究报道,雷帕霉素通过抑制JNK信号通路,可以促进牙髓干细胞的增殖和成骨分化[9],还有其他研究结果表明通过调控JNK信号通路,可以促进肌腱干细胞成骨分化[10],若能通过抑制JNK信号通路使cBMSCs多能性基因表达上调,对解决cBMSCs在分离传代过程中逐渐老化丧失多能性的问题具有重要意义。本研究通过添加SP 600125达到抑制JNK信号通路的目的,探讨JNK信号通路对cBMSCs多能性基因的影响,对维持cBMSCs多能性以及临床使用中优化干细胞培养质量提供理论基础。
1 材料与方法
1.1 材料
1.1.1 实验犬 3月龄雄性实验用健康比格犬,购自青岛博隆比格犬养殖有限公司。
1.1.2 主要试剂与仪器 胎牛血清(FBS)、DMEM/F12培养基,Gibico公司产品;TritonX-100,德国Biofroxx公司产品;MTT,中国Biosharp公司产品;Anti-Canine CD 44 APC、CD 34 PE、CD 45-FITC、CD 11 a-FITC,美国eBioscience公司产品;RNA逆转录试剂盒,TaKaRa公司产品;流式细胞仪,美国BD公司产品;Bio-Rad-Cfx荧光定量PCR仪,美国Bio-Rad公司产品;CO2培养箱、Thermo生物安全柜,美国Thermo Scientific公司产品;Bio-Tek ELx800吸收光酶标仪,美国Bio-Tek公司产品;倒置显微镜,Olympus公司产品。
1.2 方法
1.2.1 细胞的分离培养鉴定及分组 犬麻醉后,在无菌状态下抽取骨髓,由云南农业大学病理实验室参照专利“同时分离培养犬骨髓间充质干细胞和多功能造血干细胞的方法”(专利号ZL 201410405353.X)分离间充质干细胞,并以适宜的细胞密度(1×106~5×106/mL)接种至培养瓶中,放入CO2培养箱中培养,每3 d换一次液,长至80%~90%进行传代。cBMSCs培养传至第3代,添加抗CD34、CD44、CD45、CD90和CD11a荧光标记单克隆抗体,使用流式细胞仪对细胞表面标记进行鉴定。取第3代细胞进行试验,通过MTT试验计算得到SP 600125的最适浓度,试验分为对照组(普通培养基),抑制组(添加10-6mol/L SP 600125的普通培养基)。
1.2.2 MTT法检测细胞活性 MTT法参照GB/T16886.5-2003《医疗器械生物学评价5部分:体外细胞毒性试验》,通过MTT试验计算得到SP 600125对cBMSCs的最适试验浓度,在最适药物浓度下测定对照组及抑制组的细胞活性情况。将3代细胞培养第7、14、21天的细胞消化制成细胞悬液,调整细胞浓度转移至96孔板,加入培养基,放置培养箱孵育观察细胞情况,加入MTT溶液后继续培养。经二甲基亚砜处理后使用酶联免疫检测仪检测各孔吸光值,即OD值。
1.2.3 荧光定量PCR 从培养瓶中收集第7、14、21天的3代细胞,使用TRIzol法提取总RNA。将起始RNA统一定量为1 000 ng,按照宝生物反转录试剂盒说明书将完整性良好的RNA模板反转录为cDNA。所有步骤均在冰上操作,所得cDNA 置于-20 ℃保存待用。
根据GenBank中C3肉瘤毒素底物1(Ras-related C3 botulinum toxin substrate 1,RAC1)、激活转录因子2(Activating transcription factor 2,ATF2)、性别决定基因相关转录因子2(SRY related high mobility group box 2,Sox2)、多能性相关基因多梳蛋白4(chromobox homolog 4,CBX4)基因序列,采用 Primer Premier6.0、Oligo 6.0软件设计特异引物,引物序列如表1所示。

表1 荧光定量PCR引物序列
以GAPDH基因作为内参,利用反转录产物进行荧光定量PCR检测相关基因mRNA表达水平。反应体系(20 μL):TB Green Premix ExTaqⅡ(Tli RNaseH Plus)(2×)10 μL;上、下游引物各(10 μmol/L)0.8 μL;DNA 模板2 μL;dH2O 6.4 μL。反应程序:5 ℃ 3 min;95 ℃ 1 min,50 ℃~60 ℃ 30 s,72 ℃ 5 min,扩增共40个循环。
1.2.4 ELISA法检测细胞上清液蛋白含量 从培养瓶中收集第7、14、21天的3代细胞上清液,使用ELISA试剂盒测上清液蛋白浓度。按照Canine CBX 4 ELISA试剂盒和Canine SOX 2 ELISA试剂盒说明书添加标准品和待测样品,使用酶标仪在450 nm波长下检测各孔吸光值(OD值)。
2 结果
2.1 细胞分离培养与鉴定
2.1.1 分离培养原代cBMSCs形态观察 相差显微镜下观察分离得到的原代cBMSCs细胞形态及生长情况,在第11天时培养瓶中以先变形细胞为中心出现短梭形细胞且细胞团明显呈漩涡状贴壁聚集生长(图1)。

A.3 d;B.5 d;C.11 d
2.1.2 cBMSCs 表型鉴定结果 取第3代cBMSCs进行流式细胞术分析,CD44和CD90强阳性,CD34、CD11a、CD45为阴性,符合间充质干细胞的细胞表面标记物特点(图2)。

图2 细胞表面标记流式鉴定结果
2.2 MTT 检测结果
2组细胞增殖率由图3可知,抑制组在第7天极显著高于对照组(P<0.01),在第14天显著高于对照组(P<0.05)。

图3 各组cBMSCs细胞增长率
2.3 荧光定量PCR法检测结果
2.3.1 cBMSCs中RAC1 mRNA表达情况 从图4可知,抑制组RAC1 mRNA表达水平在第7天时显著低于对照组(P<0.05),在第14、21天均极显著低于对照组(P<0.01)。
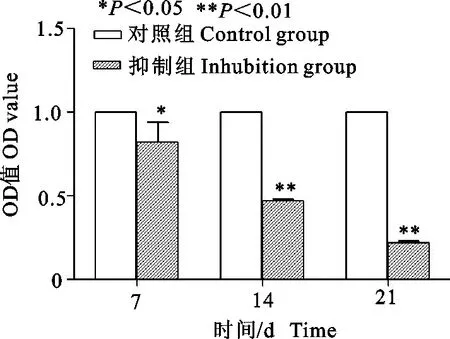
图4 各组cBMSCs RAC 1 mRNA表达水平的比较
2.3.2 cBMSCs中ATF2 mRNA表达情况 从图5可知,抑制组ATF2 mRNA表达水平在所有时间点均极显著低于对照组(P<0.01)。

图5 各组cBMSCs ATF 2 mRNA表达水平的比较
2.3.3 cBMSCs中CBX4 mRNA表达情况 从图6可知,抑制组CBX4 mRNA相对表达水平在3个时间点均极显著高于对照组(P<0.01)。

图6 各组cBMSCs CBX 4 mRNA表达水平的比较
2.3.4 cBMSCs 中Sox2 mRNA表达情况 从图7可知,抑制组Sox2 mRNA相对表达水平在3个时间点均极显著高于对照组(P<0.01)。

图7 各组cBMSCs Sox 2 mRNA表达水平的比较
2.4 ELISA法检测结果
2.4.1 cBMSCs细胞上清液中CBX 4蛋白含量
2.4.1.1 CBX 4标准曲线构建 由CBX 4的标准品得到其标准曲线如图8所示,回归方程为y=0.032 4x-0.020 3,R2= 0.997 4,符合标准曲线要求。

图8 CBX 4 ELISA标准曲线
2.4.1.2 CBX 4含量变化 从图9可知,与对照组比较,cBMSCs上清液中除第14天的抑制组,第7、21天均极显著高于对照组(P<0.01)。

图9 各组cBMSCs培养基上清中CBX 4含量
2.4.2 cBMSCs细胞上清液中Sox 2蛋白含量
2.4.2.1 Sox 2标准曲线构建 由Sox 2的标准品得到其标准曲线如图10所示,回归方程为y=0.077 3x+0.019 6,R2= 0.999 6,符合标准曲线要求。
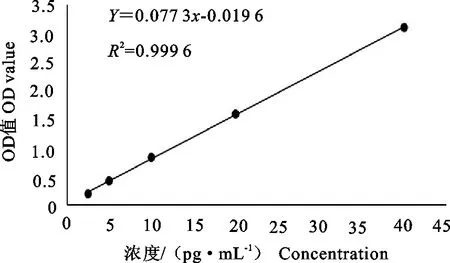
图10 Sox 2 ELISA标准曲线
2.4.2.2 Sox 2含量变化 从图11可知,抑制组Sox 2蛋白含量在3个时间点均极显著高于对照组(P<0.01)。

图11 各组cBMSCs 培养基上清中Sox 2含量
3 讨论
BMSCs的多能性即增殖和分化能力,在临床治疗中起着关键作用,但随着BMSCs的衰老,BMSCs的多能性会逐渐丧失,严重影响治疗效果[11-12]。多能性相关基因CBX4、Sox2对BMSCs多能性的维持具有重要作用。CBX4可指示BMSCs的衰老情况,CBX4是核心蛋白复合体 1(polycomb complex 1,PRC1)的组成部分,参与维持核仁异染色质过程,在维持细胞身份和器官发育中发挥重要作用[13],核仁与细胞内稳态及衰老调节相关。过表达CBX4可减轻人MSC 的衰老,而CBX4缺乏时细胞衰老加速。研究表明,衰老小鼠体内CBX4基因过表达时,小鼠MSC的衰老现象减轻,骨关节炎的发生几率变小,除此之外还有研究报道CBX4可减缓维持人表皮干细胞分化过程延缓细胞衰老[14-15]。Sox2基因是Sox家族的重要成员之一,与MSCs的自我更新及分化潜能密切相关,在MSCs的分化多能性维持和细胞生长等生理过程中起重要调节作用[16-17]。
JNK信号通路在调控细胞生长、分化和凋亡等一系列不同的生理过程中发挥重要作用,RAC1、ATF2是JNK信号通路中下游通路因子。RAC1是一种小分子 GTP酶,可调控JNK信号通路[18-19]。众所周知在临床骨髓疾病中RAC1的量还指示着炎症的情况,与巨噬细胞的数量有关,研究中抑制组RAC1 mRNA表达水平在第14、21天时低于对照组的程度比第7天更为明显,推测可能是因前期分离的细胞中含有少量巨噬细胞引起的。JNK介导ATF2磷酸化增强其转录活性,c-Jun磷酸化的诱导对于许多不同的细胞增殖、凋亡过程以及癌症细胞的调节非常重要[20-21]。有研究报道ATF2具有抑制癌细胞和促进癌细胞的双重作用。相较于正常细胞,在癌变的肾细胞中ATF2的表达量更高;当敲除癌变肾细胞中的ATF2 时,癌细胞的增殖与迁徙能力明显降低[20],SP 600125组在培养过程中相较于对照组表现出更好的增殖情况,其中机制可能与ATF2的表达减少有关。
本研究中抑制组由于添加了JNK信号通路抑制剂,JNK信号通路相关基因RAC1、ATF2的mRNA表达水平降低。抑制JNK信号通路后,多能性相关基因CBX4、Sox2 mRNA的表达水平增加,表明cBMSCs细胞状态保持“年轻态”,细胞衰老情况得以缓解,提示JNK信号通路可能是维持cBMSCs多能性的分子机制之一。
综上所述,cBMSCs多能性可使细胞维持增殖及分化能力,而抑制JNK信号通路可维持cBMSCs的多能性,但其中的作用机制还需更深一步的研究。

