低温诱导糙皮侧耳菌丝成熟的机制研究
许子洁 曹子健 胡宝 徐子昕 王晶 郑素月 王春霞


摘要:为探究低温诱导糙皮侧耳菌丝成熟的机制,为糙皮侧耳在实际栽培与生产中提供理论依据与技术支撑,以糙皮侧耳菌株“双抗黑平”为試验材料,测定不同温度诱导处理后糙皮侧耳的出菇情况及菌丝生理指标的变化。设置3种不同温度处理,分别为对照组(25 ℃)、低温处理组(17 ℃)、高温处理组(33 ℃)。结果表明,经低温17 ℃诱导处理糙皮侧耳后可正常出菇,而25、33 ℃诱导处理后均无原基形成,无法形成子实体。经不同温度诱导处理后,DAB染色显示处理组中菌丝的染色程度较深。经不同温度诱导处理后,处理组中可溶性糖、可溶性蛋白和游离脯氨酸的含量显著高于对照组(P<0.05),并且33 ℃高温处理组中各个物质的含量最高;丙二醛和相对电导率的变化趋势基本一致,均是处理组显著高于对照组(P<0.05);菌丝中CAT活性的大小依次为33 ℃处理组>17 ℃处理组>25 ℃处理组;高温处理组菌丝POD活性最高,达到115.63 U/(g·min),但17 ℃处理组与对照组无明显差别(P>0.05);不同温度诱导处理7 d,对照组中SOD活性最高,然而经12 h和24 h处理后,处理组显著高于对照组。
关键词:糙皮侧耳;低温刺激;DAB;渗透调节物质;电导率;保护酶
中图分类号:S646.1+41.04 文献标志码: A
文章编号:1002-1302(2022)10-0133-07
目前,“一荤一素一菇”被称为最恰当的膳食结构[1]。糙皮侧耳(Pleurotus ostreatus)是食用菌范围里栽培历史深远、种植广、发展快、产量高的菌种,又名平菇、牡蛎菇[2],良好的市场销路和丰富的价值,使其成为世界上最受欢迎的食用菌之一[3]。
环境温度是调控食用菌生长发育最活跃和具有重大意义的因素,食用菌在不一样的生长阶段,对温度的要求也都不同,菌丝发育期一般所需温度较高,而子实体期相对较低。郭勇等分析凤尾菇、灵芝等菌丝在不同温度下的生长状态,发现在最适温度时菌丝生长迅速且颜色浓白、边缘整齐;当温度降低10 ℃时,菌丝生长速度降低,颜色变浅,边缘不整齐,菌丝间横隔较短,锁状联合密集,菌丝发育不健全[4]。沈颖越等发现短时间冷刺激或持续温差刺激可使肺形侧耳从营养生长期转化进入生殖期[5]。Sakamoto等研究发现金针菇菌丝在常温黑暗条件下无法出菇,经过13~16 ℃低温刺激后,金针菇子实体形成[6]。温嘉伟对白灵侧耳菌丝进行 0~4 ℃持续3~5 d的低温胁迫,促使原基形成[7]。因此,低温诱导对食用菌菌丝成熟、原基形成及子实体生长发育过程都具有重要作用。
糙皮侧耳作为变温结实性食用菌之一,需经历复杂的生化、生理低温应激反应,才能促使菌丝成熟,完成营养生长往生殖生长的转变。目前,关于糙皮侧耳的研究多集中于栽培料[8-9]、不同基质及外源添加物[10-11]对平菇生长的影响,对低温诱导糙皮侧耳菌丝成熟机制的研究甚少。本研究以糙皮侧耳菌株“双抗黑平”为试验材料,测定低温诱导处理糙皮侧耳菌丝后出菇情况、活性氧(reactive oxygen species,ROS)、渗透调节物质含量、超氧化物歧化酶(superoxide dismutase,SOD)、过氧化物酶(perxidase,POD)、过氧化氢酶(catalase,CAT)、丙二醛(malondialdehyd,MDA)等生理指标的变化,研究菌丝成熟的生理机制,为更加深入理解糙皮侧耳菌丝的生长发育过程,进一步为实际栽培生产提供理论依据与技术支撑。
1 材料与方法
1.1 试验材料
糙皮侧耳菌株“双抗黑平”,保存于河北工程大学园林与生态工程学院食用菌研究室。
1.2 培养环境与方法
本试验于2020年3月至2021年6月在河北工程大学食用菌研究室完成。
1.2.1 培养基
PDA培养基:马铃薯200.0 g,琼脂粉20.0 g,葡萄糖20.0 g,磷酸二氢钾3.0 g,硫酸镁1.5 g,维生素B 10 mg,1 L水。
1.2.2 菌丝培养
在超净工作台中无菌环境下将待测菌株接种于一次性35 mm小培养皿中,待菌丝长满后,选取长势良好的“双抗黑平”再次重复接种操作进行活化,活化3次后备用;接种直径5 mm菌丝于铺有玻璃纸的一次性直径90 mm培养皿中,25 ℃ 恒温培养箱中暗处理7 d。7 d后,将所有菌丝分3组处理,对照组为25 ℃恒温继续培养7 d,低温处理组为17 ℃低温处理7 d,高温处理组为33 ℃高温胁迫7 d。然后收集不同温度处理的菌丝,液氮中速冻,放于-80 ℃冰箱内保存备用。不同温度处理的菌丝见图1。
1.3 各项生理指标的测定
DAB染色,参照二氨基联苯胺(3,3′-diaminobenzidine-HC1,DAB)染色检测法[12]。考马斯亮蓝法[13]测可溶性蛋白含量,蒽酮比色法[14]测可溶性糖含量,酸性茚三酮法[13]测游离脯氨酸含量,MDA含量测定使用硫代巴比妥显色测定法[13],相对电导率测定参考周冰谦等的方法[15],3种保护酶(CAT、POD、SOD)活性测定参考王学奎的方法[13]进行调整。
1.4 栽培管理
按照玉米芯86%、麦麸10%、石灰3%、石膏1%、含水量60%,装袋后,高压灭菌1.5 h,冷却接种。所有菌棒放置25 ℃培养箱内避光培养,待菌丝长满料袋后,将料袋随机分成3个处理组,分别于17、25、33 ℃恒温培养箱避光进行培养,湿度控制在80%~90%,原基形成后,每天早、中、晚各喷水1次,当子实体分化5~7 d、菌盖平展、边沿略有波浪状时进行采摘,标记并记录体质量、生物学效率。
生物学效率=子实体湿质量(g)/培养料干质量(g)×100%。
1.5 数据处理
采用SPSS 26.0統计分析软件进行单因素ANOVA差异显著性分析,进行平均值Duncans多重比较(α=0.05),所有试验数据运用Microsoft Excel 2016 统计、计算。
2 结果与分析
2.1 不同温度诱导处理对糙皮侧耳出菇的影响
对糙皮侧耳进行不同温度诱导处理后发现,仅有经过17 ℃低温处理的菌丝才能正常形成原基,其颜色有蓝黑和黑色2种,25、33 ℃处理的菌丝均未有原基产生,从而导致无法出菇。由表1可知,经过17 ℃低温刺激后,原基到子实体的过程颜色由深黑、蓝黑逐渐转为浅黑、灰色,子实体菌盖直径在5.199~6.828 cm之间,菌盖厚度在1.272~1.862 cm之间,菌柄长度在3.851~4.658 cm之间,菌柄直径在1.540~1.633 cm之间,单朵质量范围在169.4~187.5 g之间,生物学效率最低62.8%,最高达82.3%。
2.2 不同温度诱导处理对糙皮侧耳菌丝中活性氧(ROS) 的影响
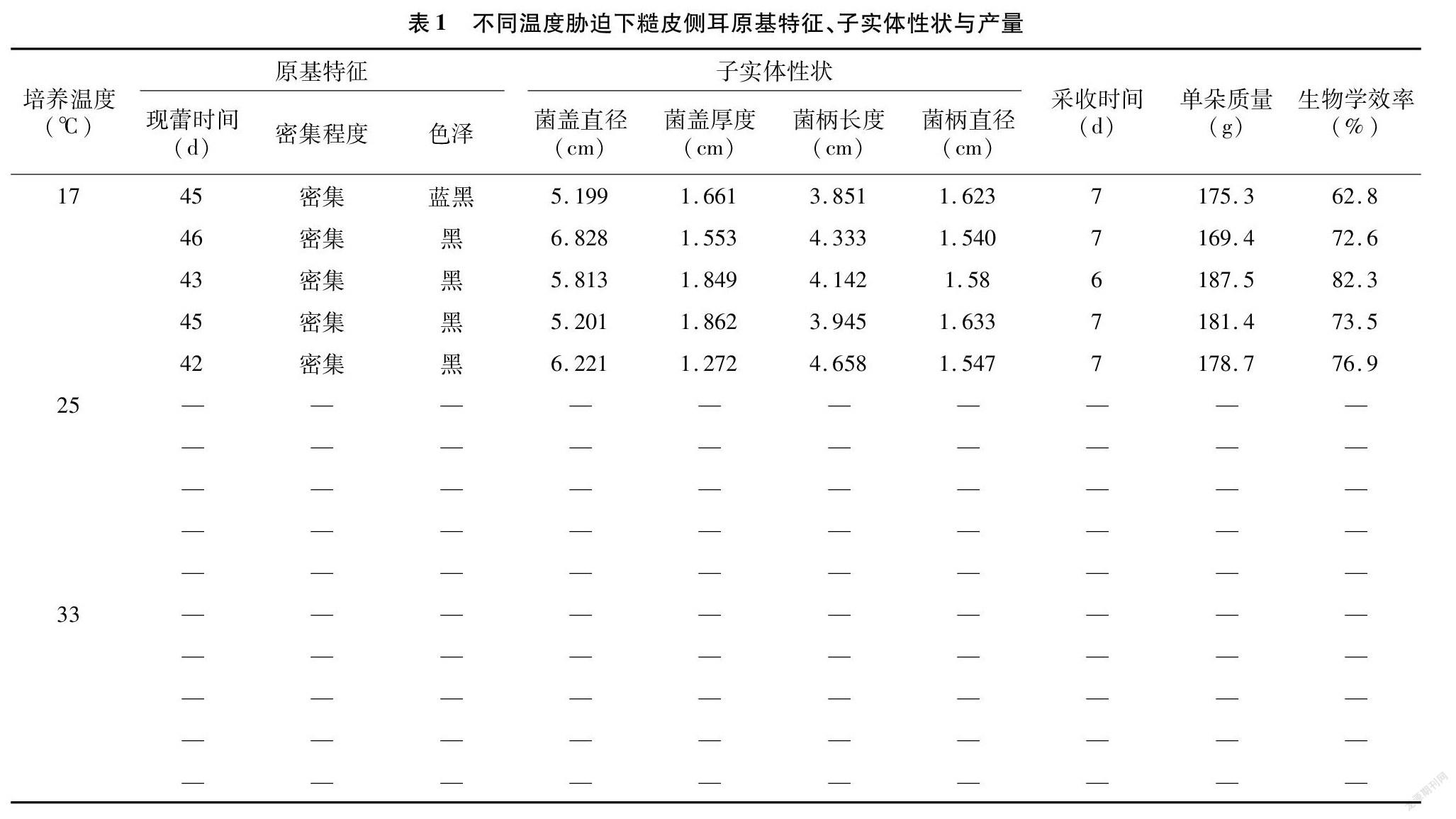
为检测经不同温度诱导处理后活性氧的积累,用DAB染色检测了糙皮侧耳菌丝中H2O2和O-2·的水平,由图2可知,25 ℃处理后菌丝的染色程度较弱,菌丝颜色较浅(图2-A);与对照相比较,17 ℃ 和33 ℃诱导处理后的菌丝能观察到显著的染色斑点且颜色深,说明温度对菌丝造成影响会积累H2O2和O-2·,且33 ℃处理后菌丝的颜色更深,提示积累了更多ROS(图2-B、图2-C)。
2.3 不同温度诱导处理对糙皮侧耳可溶性糖和可溶性蛋白含量的影响
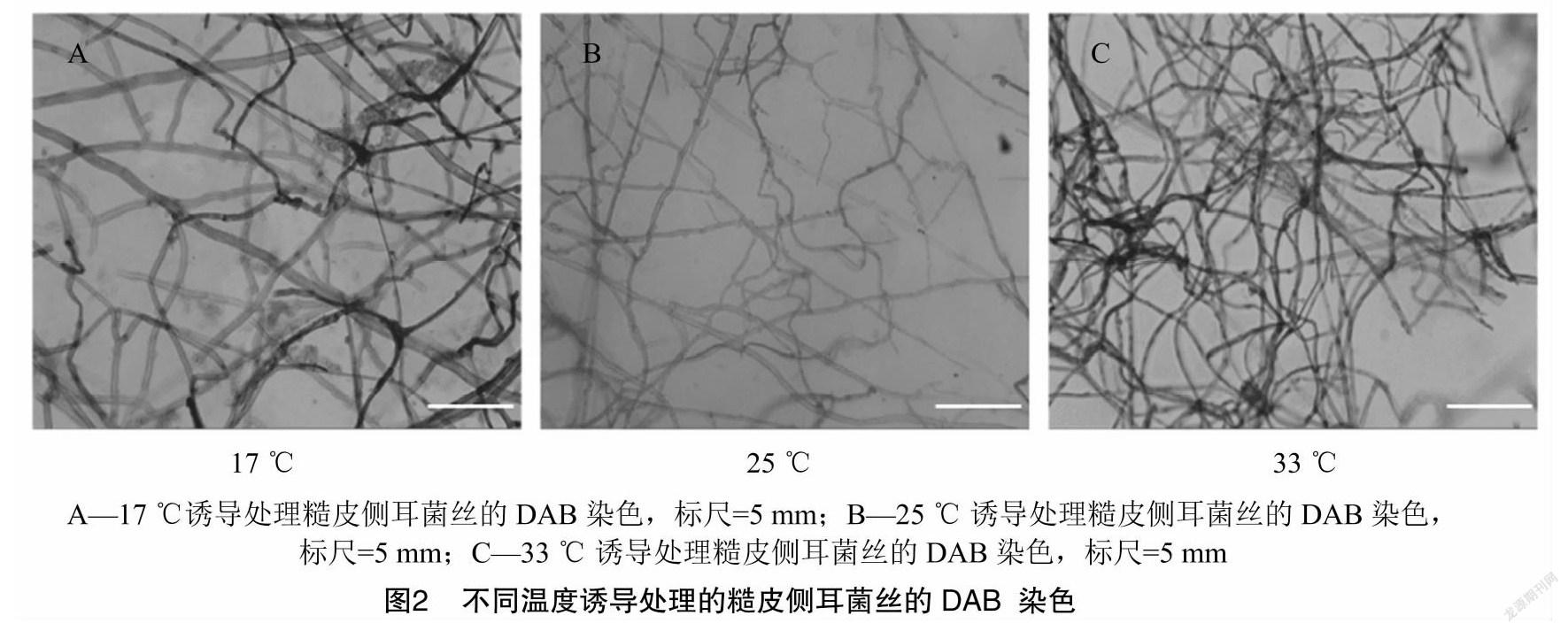
可溶性糖、可溶性蛋白是调节细胞内外渗透平衡的重要物质,物质含量与提高细胞液浓度呈正相关,含量增加可以稳定细胞膜结构,调节内外平衡,从而增强对胁迫环境的抵抗能力[16]。不同温度处理对糙皮侧耳菌丝中可溶性糖含量的影响见图 3-A,17、33 ℃诱导处理后,可溶性糖含量分别为3.51%和5.98%,显著高于对照组(P<0.05),可溶性糖含量大幅提高,上升幅度分别为55%及165%。
可溶性蛋白含量的增多有利于抵御外界温度变化对自身的影响,增加抗逆性[17]。糙皮侧耳菌丝中可溶性蛋白含量在不同温度处理诱导下的变化趋势见图3-B,可溶性蛋白含量变化趋势与可溶性糖含量变化趋势基本保持一致,17、33 ℃处理7 d后,菌丝中可溶性蛋白含量与对照组相比较,显著提高41.94%和66.01%(P<0.05),分别达到11.93、13.95 mg/g,且33 ℃处理组中可溶性蛋白含量显著高于17 ℃处理组(P<0.05)。
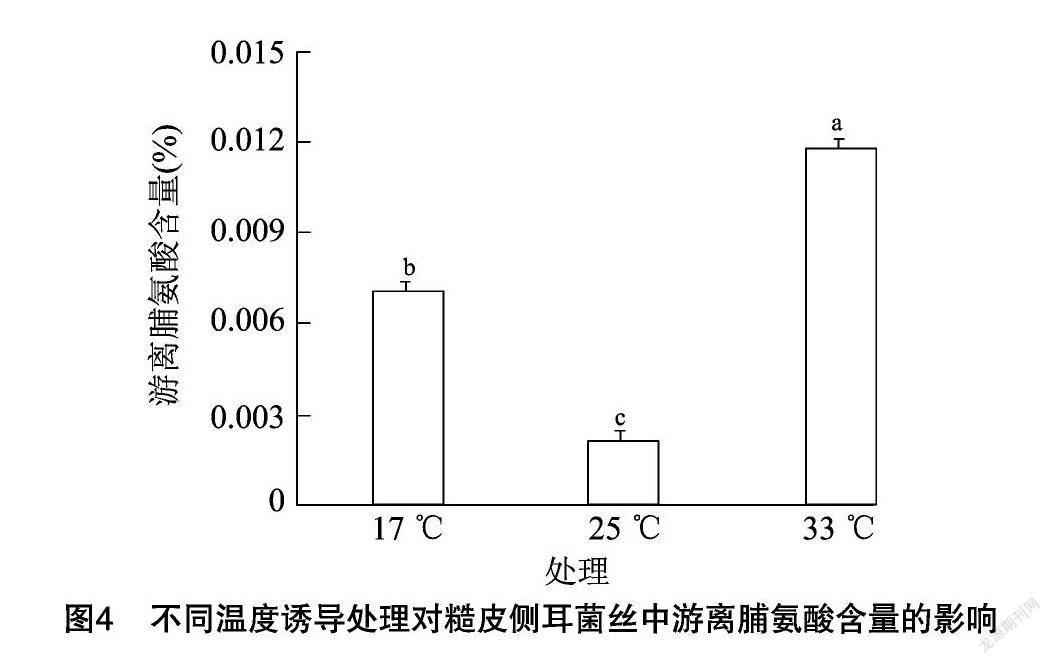
2.4 不同温度诱导处理对糙皮侧耳菌丝中游离脯氨酸含量的影响
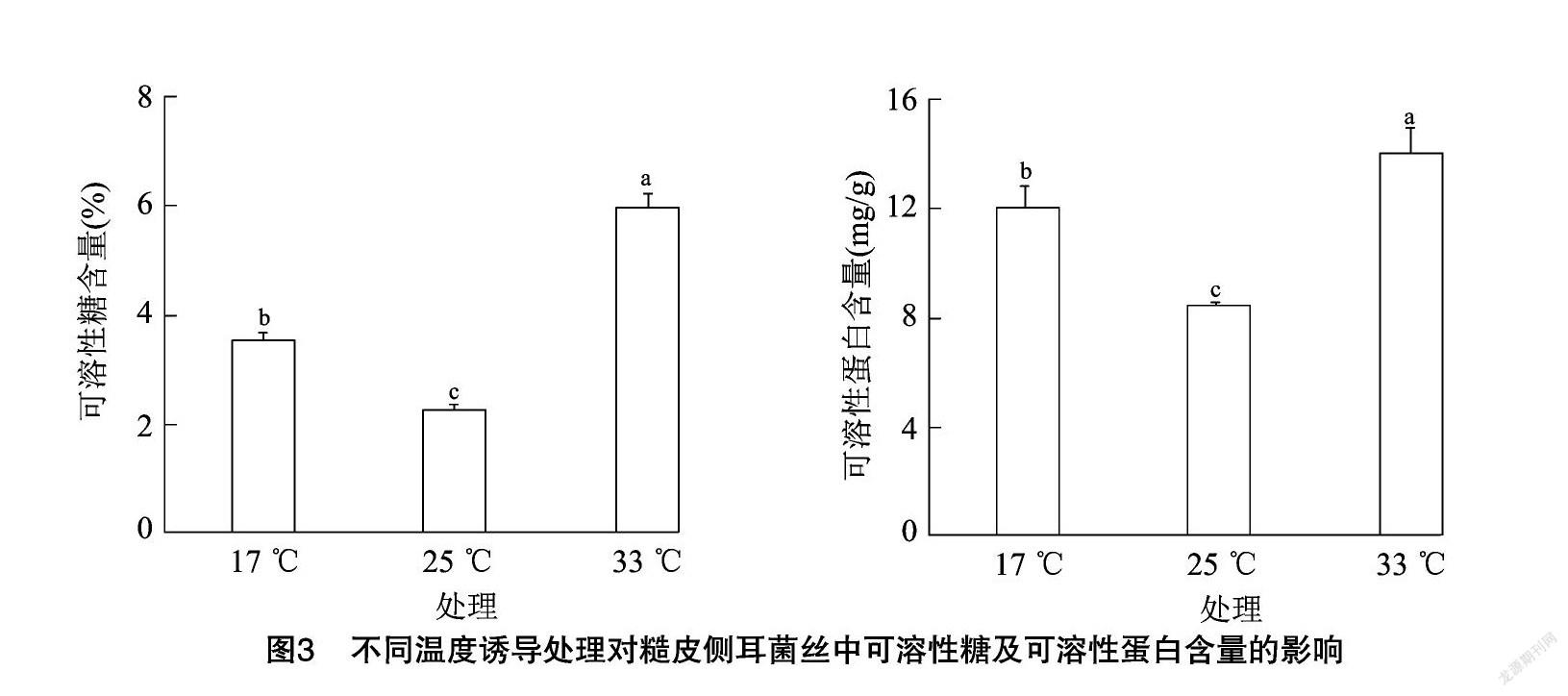
游离脯氨酸同样是细胞内重要的渗透调节物质[18-19],脯氨酸作为最大的水溶性氨基酸,是细胞组织内的防冻剂、膜稳定剂[20],可抵御或减缓不同温度胁迫对细胞的损伤。糙皮侧耳菌丝中游离脯氨酸含量变化见图4,不同温度处理对菌丝中游离脯氨酸含量的影响比较显著,对照组中游离脯氨酸的含量为0.002 1%,经17 ℃和33 ℃诱导处理后,游离脯氨酸含量显著增加(P<0.05),分别提高230.10%和449.17%。并且33 ℃处理组含量最高,与17 ℃低温处理相比,游离脯氨酸显著升高(P<0.05)。
2.5 不同温度诱导处理对糙皮侧耳菌丝中丙二醛(MDA)含量和相对电导率的影响
在逆境环境下,细胞膜系统是最先遭受伤害,也是最先反应的系统[21]。MDA含量与植物抗逆性呈负相关[22],逆境中其含量将会增加。糙皮侧耳菌丝中MDA含量的变化趋势见图5-A,MDA含量依次为33 ℃处理组(11.24 μmol/g)>17 ℃处理组(9.54 μmol/g)>25 ℃处理组(7.86 μmol/g),低温
及高温诱导处理后,MDA含量均明显升高(P<0.05),提示遇到外界温度胁迫时菌丝通过提高MDA含量来增强自身的抵抗能力。
环境胁迫导致细胞膜透性加大,电解质受影响出现紊乱,引起相对电导率变化,并反映了细胞膜受损程度[23]。相对电导率变化趋势与MDA基本一致,由图5-B可知,对照组的相对电导率为33.81%,经过不同温度诱导处理后,菌丝的相对电导率发生差异性变化,都呈现出明显上升趋势(P<0.05),与对照组相比较,17 ℃处理组中相对电导率增幅为60.8%,33 ℃处理组最高 增幅达到90.2%,说明高温诱导处理导致菌丝电解质外渗严重增加,细胞膜受损最严重。
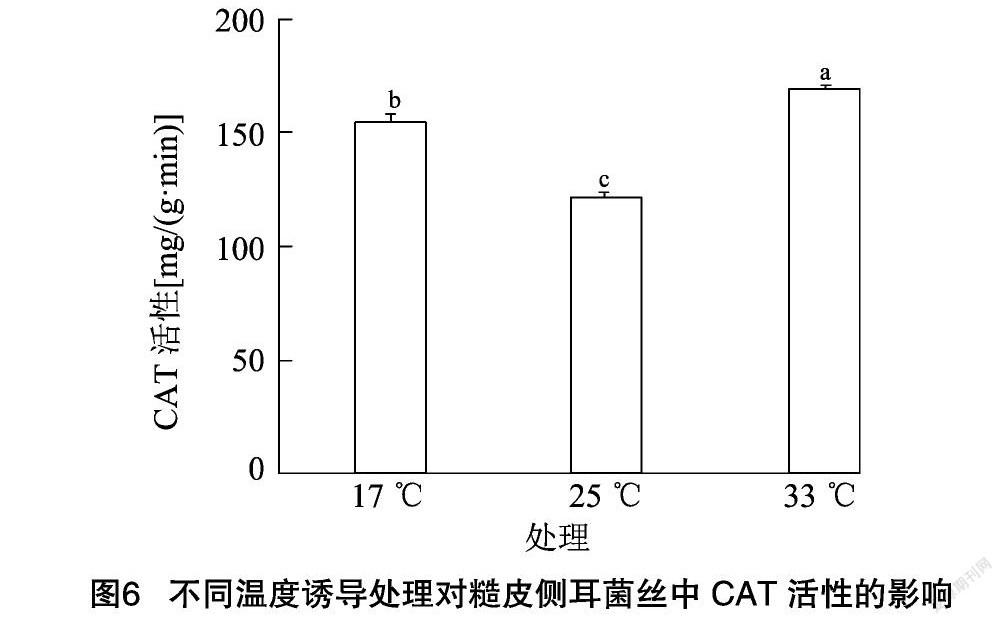
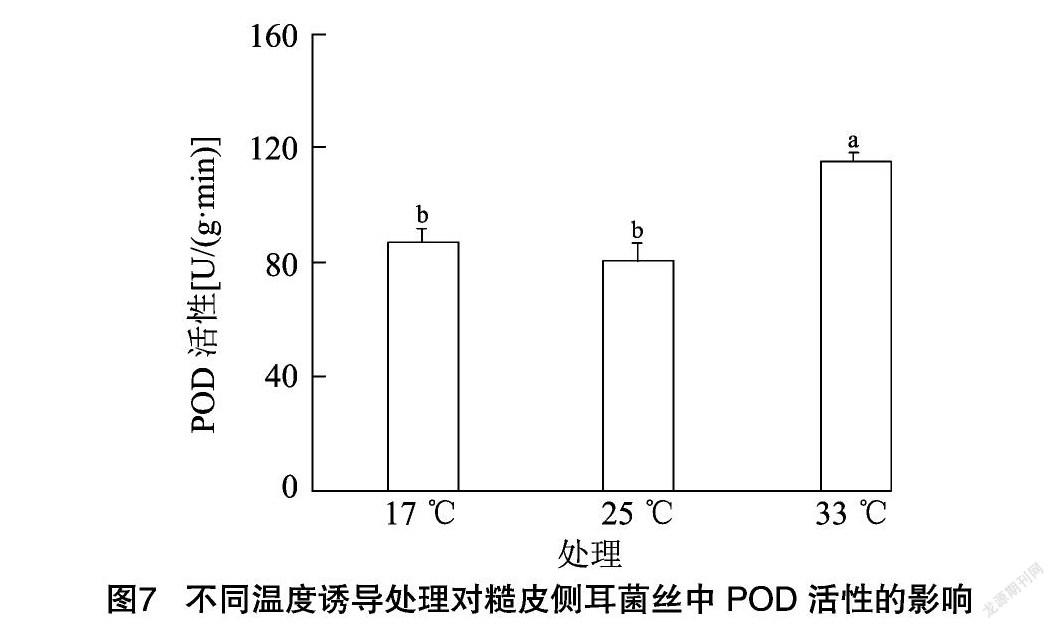
2.6 不同温度诱导处理对糙皮侧耳菌丝中CAT、POD及SOD活性的影响
CAT和POD是植物体内保护酶系统的重要组成部分,能有效清除植物体内H2O2和其他过氧化产物,避免细胞膜的过氧化伤害[24]。糙皮侧耳菌丝中CAT活性在不同温度诱导处理下的变化情况见图6。由图6可知,对照组25 ℃条件下CAT活性为 121.36 mg/(g·min)。17 ℃低温诱导处理后,CAT活性增加了27.21%,达到154.39 mg/(g·min)。在33 ℃高温诱导处理后,CAT活性比17 ℃处理组有小幅增加,达到169.35 mg/(g·min),但比对照组显著增加(P<0.05),增幅达39.5%。
糙皮侧耳菌丝中POD活性的变化趋势如图7所示,POD活性变化趋势与CAT基本一致,大小依次为:33 ℃处理组>17 ℃处理组>25 ℃处理组,25 ℃ 条件下POD活性为80.62 U/(g·min),17 ℃低温诱导使得POD活性增加,但与对照相比较变化不显著(P>0.05),然而33 ℃高温诱导处理后,POD活性显著增加(P<0.05),平均增幅为43.42%,POD活性高达115.63 U/(g·min),因此推测糙皮侧耳菌丝对高温更加敏感,当遇到高温胁迫时,细胞中POD活性能够达到相对较高的水平,从而能快速有效清除多余的H2O2和其他过氧化物,使菌丝内部的活性氧和氧自由基处于低含量的状态,在一定程度上减缓高温胁迫对菌丝的影响。
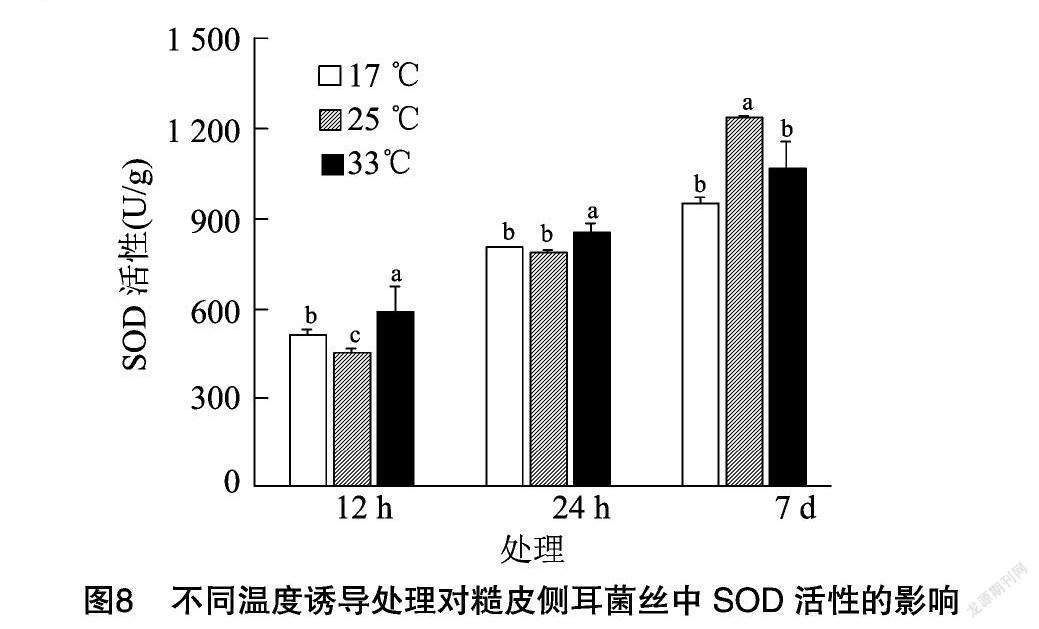
SOD同样是植物体内重要的保护酶之一[25],在逆境胁迫下,能有效清除超氧阴离子自由基,起到保护作用。糙皮侧耳菌丝中SOD活性在不同温度诱导下的变化情况见图8,由图8可知,对糙皮侧耳菌丝进行诱导处理7 d后发现对照组(25 ℃)菌丝中SOD活性最高,达到1 237.74 U/g,高于17 ℃和33 ℃处理组。这与POD活性的变化趋势不一致,因此推测可能是在温度诱导处理时,短时间内SOD活性快速上升,导致处理组菌丝中SOD活性显著高于对照组,随着处理时间增加,温度胁迫会对菌丝的生理状态产生非常严重的破坏,所以温度诱导处理7 d后,对照组中SOD活性最高。为了验证这一猜想,又对菌丝进行了12 h和24 h的温度诱导处理,试验结果显示处理12 h后,处理组中SOD活性显著高于对照组;处理24 h后33 ℃处理组中SOD活性最高,17 ℃ 处理组与对照组没有显著差别,这与推测基本相符。
3 讨论与结论
糙皮侧耳菌丝适宜生长温度25 ℃,子实体分化需要的适宜温度为17 ℃左右,是典型的变温结实性食用菌。在经受環境温度改变时,生物体内的活性氧、可溶性蛋白、可溶性糖、游离脯氨酸及保护酶等都与其抗逆性密切相关。可溶性糖、可溶性蛋白及游离脯氨酸利用其特质调节含量,维持细胞内外的渗透平衡[26],其含量的高低与抗性能力呈正相关。本研究中可溶性蛋白、可溶性糖和游离脯氨酸在高温及低温诱导处理下,含量都有明显升高,且33 ℃高温组中这些物质的含量最高,变化最显著,提示糙皮侧耳菌丝对高温更加敏感,表现出对高温更强的抵抗能力,同时也表明了相对于17 ℃低温处理,菌丝在高温处理下遭受到了严重的破坏,因此推测菌丝可能在高温下受损程度严重,所以导致后期无法形成子实体,造成不出菇的现象。MDA是膜脂过氧化产物之一,是质膜受损的重要指标[27]。在本研究中菌丝中MDA含量的变化趋势与相对电导率基本一致,处理组中MDA及相对电导率显著高于对照组,且33 ℃处理组中最高,本研究结果也说明了菌丝在高温下遭受到了相对更加严重的破坏。
当外界环境发生温度变化时,食用菌菌丝内部的保护酶系统会被立即激活,抵御逆境对菌丝的伤害。在17、33 ℃温度诱导处理后,CAT活性显著高于对照组25 ℃,且33 ℃处理组最高,说明CAT能快速有效清除多余的H2O2和其他过氧化物,使菌丝内部的活性氧和氧自由基处于低含量的状态,在一定程度上减缓温度胁迫对菌丝的影响。POD活性变化趋势与CAT基本一致,大小依次为:33 ℃处理组>17 ℃处理组>25 ℃处理组,17 ℃低温诱导使得POD活性增加,与对照相比较增加幅度较低(P>0.05),然而33 ℃高温诱导处理后,POD活性显著增加(P<0.05)。SOD活性的变化情况与前两者有所不同,经7 d诱导处理后,不同处理组SOD活性均低于对照组25 ℃。然后又测了另外2个时间点SOD的活性分别是诱导处理12 h和24 h,结果显示在不同温度处理12 h后,SOD活性的大小依次为33 ℃处理组>17 ℃处理组>25 ℃处理组,且33 ℃和17 ℃处理组都显著高于对照组。继续低温或高温处理24 h后,SOD活性的变化趋势没有太大改变,依然是33 ℃处理组最高,但是低温处理组即 17 ℃ 诱导处理24 h后,菌丝中SOD活性与对照组相比没有显著上升。因此,推测低温结实性菇类在温度胁迫初期反应强烈,SOD活性快速上升,尤其是高温胁迫后快速响应,说明高温对菌丝伤害性更大,但随着胁迫时间的延长,SOD活性快速增加之后将不再持续增加,这与管道平、郝海波等的研究结果[28-29]相似,活性氧在生物体内含量的多少,需要整个防御清除系统协调合作[30],部分酶活性的高低不能作为直接判断因素,植物有利用酶促防御系统,达到减缓衰老的目的[31],这可能是SOD酶活性后期出现对照组较高的原因,因此深入透彻了解糙皮侧耳菌丝应对温度胁迫的生理变化过程就需要多层次、多方位、多角度进行研究。
综上所述,研究低温诱导糙皮侧耳菌丝成熟时各个生理指标变化情况,发现细胞渗透调节物质(可溶性糖、可溶性蛋白和游离脯氨酸)、MDA、相对电导率和抗氧化保护酶活性(CAT、POD和SOD)均有明显变化,DAB染色后颜色深浅也显现氧化胁迫状态的不同,且33 ℃高温处理组的各个物质的含量最高,说明菌丝对高温比较敏感,在高温下受到更加严重的破坏,同时也表明了低温诱导糙皮侧耳菌丝成熟时,不止生理指标变化,也需要多种机制的共同调控。栽培袋出菇试验,充分验证低温诱导刺激是糙皮侧耳形成子实体的必要条件,这与孔令淼等、孔维威等的研究结果[32-33]一致。本研究为更加深入理解糙皮侧耳菌丝的成熟机制及低温诱导糙皮侧耳在实际栽培生产中的应用提供了理论依据与技术支撑。
参考文献:
[1]顾可飞,周昌艳,李晓贝. 食用菌的营养价值及药用价值[J]. 食品工业,2017,38(10):228-231.
[2]梁群焘. 平菇种质资源的鉴别及保藏方法的研究[D]. 福州:福建农林大学,2009:1.
[3]Li J,Liu X B,Zhao Z W,et al. Genetic diversity,core collection and breeding history of Pleurotus ostreatus in China[J]. Mycoscience,2019,60(1):14-24.
[4]郭 勇,叶小金,甘炳成,等. 不同温度和光照培养条件下3种食用菌菌丝的菌落及菌丝形态的研究[J]. 西南农业学报,2011,24(6):2301-2306.
[5]沈颖越,顾 敏,蔡为明,等. 秀珍菇子实体发育相关消减杂交cDNA文库的构建与分析[J]. 浙江农业学报,2014,26(2):330-334.
[6]Sakamoto Y.Protein expression during Flammulina velutipes fruiting body formation[J]. Mycoscience,2010,51(3):163-169.
[7]温嘉伟. 白灵菇与杏鲍菇基因组和表观基因组特征的进化分析[D]. 长春:东北师范大学,2019:3-4.
[8]文 晴,朱 琳,余海尤,等. 工厂化金针菇菌糠对平菇熟料栽培和营养成分的影响[J]. 北方园艺,2021(2):124-130.
[9]Hernández D,Ros M,Carmona F,et al. Composting spent mushroom substrate from Agaricus bisporus and Pleurotus ostreatus production as a growing media component for baby leaf lettuce cultivation under Pythium irregulare biotic stress[J]. Horticulturae,2021,7(2):13.
[10]Muswati C,Simango K,Tapfumaneyi L,et al. The effects of different substrate combinations on growth and yield of oyster mushroom (Pleurotus ostreatus)[J]. International Journal of Agronomy,2021,2021:1-10.
[11]Lei M,Wu X L,Huang C Y,et al. Trehalose induced by reactive oxygen species relieved the radial growth defects of Pleurotus ostreatus under heat stress[J]. Applied Microbiology and Biotechnology,2019,103(13):5379-5390.
[12]仲昭朝,鄒 婷,唐惠炜,等. 铜胁迫对蚕豆根尖细胞凋亡及线粒体功能的影响[J]. 南京大学学报(自然科学),2019,55(1):154-160.
[13]王学奎. 植物生理生化实验原理和技术[M]. 2版. 北京:高等教育出版社,2006.
[14]张述伟,宗营杰,方春燕,等. 蒽酮比色法快速测定大麦叶片中可溶性糖含量的优化[J]. 食品研究与开发,2020,41(7):196-200.
[15]周冰谦,卢 恒,刘峰,等. 不同温度胁迫对金银花细胞膜透性、活性氧代谢及其有效物质积累的影响[J]. 中国中药杂志,2019,44(18):3935-3941.
[16]Ban Q Y,Wang X W,Pan C,et al. Comparative analysis of the response and gene regulation in cold resistant and susceptible tea plants[J]. PLoS One,2017,12(12):e0188514.
[17]古丽江·许库尔汗,孙雅丽,阿依古丽·铁木儿,等. 低温胁迫对红加仑枝条渗透物质含量、膜质过氧化及保护酶活性的影响[J]. 新疆农业科学,2019,56(4):685-695.
[18]Xiang H T,Wang T T,Zheng D F,et al. ABA pretreatment enhances the chilling tolerance of a chilling-sensitive rice cultivar[J]. Brazilian Journal of Botany,2017,40(4):853-860.
[19]李 莹,杨超群,高梓峰,等. 低温胁迫下4份烟草品种苗期叶绿素及渗透调节物质含量的变化[J]. 延边大学农学学报,2021,43(2):44-52.
[20]决 超,杨囡君,方 庆. 高温胁迫对平菇子实体脯氨酸积累的影响[J]. 安徽农业科学,2012,40(36):17453-17454.
[21]Lyons J M. Chilling injury in plants[J]. Annual Review of Plant Physiology,1973,24(1):445-466.
[22]Tabassum T,Farooq M,Ahmad R,et al. Seed priming and transgenerational drought memory improves tolerance against salt stress in bread wheat[J]. Plant Physiology and Biochemistry,2017,118:362-369.
[23]李瑞雪,金晓玲,胡希军,等. 低温胁迫下6种木兰科植物的生理响应及抗寒相关基因差异表达[J]. 生态学报,2019,39(8):2883-2898.
[24]Garratt L C,Janagoudar B S,Lowe K C,et al. Salinity tolerance and antioxidant status in cotton cultures[J]. Free Radical Biology and Medicine,2002,33(4):502-511.
[25]王玉贤,姚培杰,袁颖辉,等. 低温胁迫下不同耐寒性叶用芥菜的生理差异分析[J]. 中国蔬菜,2021(6):74-79.
[26]项洪涛,郑殿峰,何 宁,等. 植物对低温胁迫的生理响应及外源脱落酸缓解胁迫效应的研究进展[J]. 草业学报,2021,30(1):208-219.
[27]刘学庆,孙纪霞,丁朋松,等. 低温胁迫对蝴蝶兰内源激素的影响[J]. 江西农业大学学报,2012,34(3):464-469.
[28]管道平. 环境胁迫下部分食用菌菌丝酶活性变化的研究[D]. 福州:福建农林大学,2004:13-20.
[29]郝海波,黄建春,王 倩,等. 热胁迫对双孢蘑菇抗氧化酶及热激蛋白基因的差异表达的影响[J]. 菌物学报,2021,40(3):616-625.
[30]决 超. 高温胁迫对平菇生理生化特征影响研究[D]. 郑州:河南农业大学,2011:5-10.
[31]魏 婧,徐 畅,李可欣,等. 超氧化物歧化酶的研究进展与植物抗逆性[J]. 植物生理学报,2020,56(12):2571-2584.
[32]孔令淼,郝 瑶. 连续低温贮藏平菇菌丝对其产量的影响[J]. 基层农技推广,2020,8(8):31-33.
[33]孔维威,宋志波,袁瑞奇,等. 出菇温度对工厂化瓶栽平菇子实体产量和品质的影响[J]. 食药用菌,2021,29(1):64-66.

