罗氏Cobas 6000 e601电化学发光免疫分析系统 国产配套洗液的应用效果
胡红永 张灿梅
作者单位:671000 云南大理白族自治州,大理白族自治州人民医院核医学科(胡红永),检验科(张灿梅)
罗氏Cobas 6000e系列电化学发光免疫分析仪因性能稳定、检测敏感度高、精密度好等优点而被广泛应用于临床检验和科研工作中。在检测过程中所有项目都需使用ProCell M和CleanCell M液,同时为消除潜在干扰,一些项目在测量前需要使用PreClean M液[1]。配套洗液在测试过程中消耗量巨大,由于其售价昂贵,经测算每个测试的耗占比约为15%~20%。而国产配套预清洗液、缓冲液和清洗液价格相对低廉,可以降低医疗成本,为医疗改革提供支持。本研究采用国产配套预清洗液、缓冲液和清洗液代替罗氏原装 PreClean M、ProCell M和CleanCell M液,评估和比较检测效果。
1 材料与方法
1.1 仪器与试剂 罗氏Cobas 6000 e601电化学发光免疫分析仪以及PreClean M、ProCell M、CleanCell M液、配套试剂和校准品均由罗氏诊断产品(上海)有限公司提供。国产预清洗液、缓冲液和清洗液由深圳瑞莱柏生物科技有限公司提供。
1.2 研究方法
1.2.1 国产配套洗液性能测试 根据性能测试操作步骤,在罗氏Cobas 6000 e601电化学发光免疫分析系统试剂盘1、2号位分别放置Blankcell试剂,3、 4号位分别放置Cellcheck试剂,5号位放置血清淀粉样蛋白P(serum amyloid P,SAP)检测试剂。再在“香蕉架”上5个位置分别放置相应的仪器性能测定验证检测试剂,在主机维修管理软件上执行“Assay Performance Check(APC)”程序后,进行相应的性能验证测试,测试完成后采用相应的性能测试管理软件分析测试数据,自动得到测试结果。
1.2.2 交叉污染及敏感度检测 性能验证合格后,分别采用原装PreClean M、ProCell M和CleanCell液 以及替代的国产检测预清洗液、缓冲液和清洗液进行“APC”交叉污染及敏感度检测程序,通过主机维修软件分析得到变异系数(coefficient of variation,CV)、交叉污染值和敏感度。要求性能验证参数AB3、iSAP、CO的CV分别为≤5%、≤2%、≤5%,交叉污染值≤1.5×10-4,敏感度≤6.0×10-15,比较结果差异是否有统计学意义。
1.2.3 检测指标与方法 根据所选检测及质控项目,使用不同的配套预清洗液、缓冲液和清洗液,采用夹心法检测高敏促甲状腺素(hypersensitive thyroid stimulating,h-TSH)、糖类抗原125(carbohydrate antigen 125,CA125)和癌胚抗原(carcinoembryonic antigen, CEA),采用竞争法检测孕酮(progesterone,P)、游离三碘甲状腺原氨酸(free triiodothyronine,FT3)和雌二醇(estradiol,E2)。E2检测需要用到PreClean M液, 其余项目则无需使用PreClean M液。先使用罗氏原装PreClean M、ProCell M和CleanCell M液及原装试剂进行校准和测定,再使用国产预清洗液、缓冲液和清洗液分别替换原装PreClean M、ProCell M和CleanCell M液,重新校准后测试相同项目。
1.2.4 室内质控及室间质评评价 采用美国伯乐公司的质控品(批号:40390),设置高、低2个浓度水平,分别以国产预清洗液、缓冲液和清洗液与罗氏原装PreClean M、ProCell M和CleanCell M液对7个项目〔FT3、h-TSH、总三碘甲状腺原氨酸(total triiodothyronine,TT3)、孕酮(P)、促卵泡生成素(follicle stimulating hormone,FSH)、促黄体生成素(luteinizing hormone,LH)、睾酮(testosterone,T)〕进行1个月的室内质控检测。以本实验室原有室内L-J质控图进行数据统计,监测不同项目的每日质控结果,根据1S,3S质控判断规则分析室内质控结果。采用国产洗液对2021年第二次国家卫生健康委临床检验中心提供的肿瘤标志物Ⅰ室间质评质控品进行复测,根据国家卫生健康委临床检验中心提供的靶值,计算检测偏倚。
1.3 统计学方法 采用SPSS 19.0软件分析数据。符合正态分布的计量资料以均数±标准差(±s)表示,组间比较采用t检验。P<0.05为差异有统计学意义。
2 结果
2.1 交叉污染率和敏感度检测 国产预清洗液、缓冲液和清洗液的交叉污染率和敏感度与原装预清 洗液、缓冲液和清洗液比较,均符合标准要求,差异均无统计学意义(均P>0.05)。见表1~2。
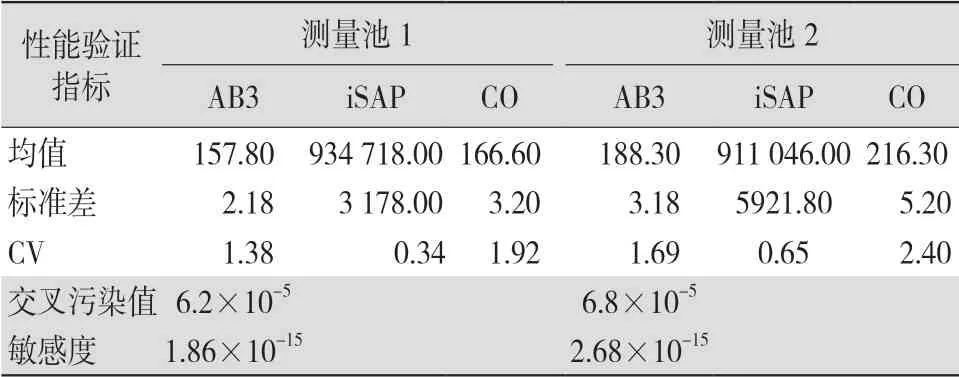
表1 原装洗液交叉污染率及敏感度检测结果
2.2 原装PreClean M、ProCellM、CleanCell M液与国产预清洗液、缓冲液和清洗液的准确性验证 按照《用患者样本进行方法比较和偏倚评估:批准指南第二版》(EP9-A2文件)[2]要求,每日收集10份患者 样本,共收集5 d。分别使用罗氏原装PreClean M、ProCell M、CleanCell M液和国产预清洗液、缓冲液和清洗液对每个样本进行重复测定,取平均值作为最终测定值。更换国产配套洗液后,重新进行仪器的清洗和灌注,并经再次较准,完成相同项目的重复测试。见表3。结果表明,采用原装PreClean M、 ProCell M和CleanCell M液与国产预清洗液、缓冲液和清洗液测定的h-TSH、FT3、E2、P、CA125、CEA结果均较为接近,计量资料采用配对t检验,差异无统计学意义(P>0.05,r>0.99),呈高度正相关。

表2 国产洗液交叉污染及敏感度检测结果
表3 采用国产洗液与罗氏原装洗液检测6种指标结果比较(±s)
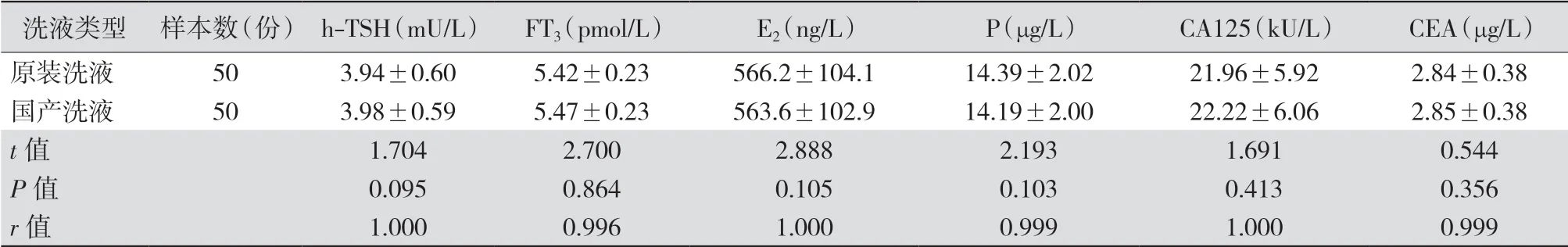
表3 采用国产洗液与罗氏原装洗液检测6种指标结果比较(±s)
注:h-TSH为高敏促甲状腺素,FT3为游离三碘甲状腺原氨酸,E2为雌二醇,P为孕酮,CA125为糖类抗原125,CEA为癌胚抗原
洗液类型 样本数(份)h-TSH(mU/L) FT3(pmol/L) E2(ng/L) P(μg/L) CA125(kU/L) CEA(μg/L)原装洗液 50 3.94±0.60 5.42±0.23 566.2±104.1 14.39±2.02 21.96±5.92 2.84±0.38国产洗液 50 3.98±0.59 5.47±0.23 563.6±102.9 14.19±2.00 22.22±6.06 2.85±0.38 t值 1.704 2.700 2.888 2.193 1.691 0.544 P值 0.095 0.864 0.105 0.103 0.413 0.356 r值 1.000 0.996 1.000 0.999 1.000 0.999
2.3 精密度验证 使用美国伯乐公司提供的质控品(批号:54690)配制为2个浓度水平的溶液,复溶后充分混匀,分装成20份。
2.3.1 批内精密度验证 使用已复溶好的高、低浓度质控品,每个样本连续重复测定20次,记录测定结果,分别计算均值、标准差及CV。结果判断标准:批内精密度<1/4允许总误差(total allowable error,TEa),参考美国临床检验室内质量控制文件(CLIA'88),比对结果为符合。
2.3.2 批间精密度验证 使用已复溶好的低、高浓度质控品,每日测试2批,每批测定1次,两批间隔时间2 h以上,连续测定10 d,每个样本记录20次测定结果,分别计算均值、标准差、CV。批间精密度<1/3TEa,参考CLIA'88文件,比对结果为符合。采用国产配套洗液和罗氏原装洗液检测各项目,均值和标准差比较差异均无统计学意义(均P>0.05)。采用国产预清洗液、缓冲液和清洗液检测的各项目批内CV均<3.76%,批间CV均<5.86%,符合仪器所需试剂CV要求。
2.4 分析测量范围验证 采用EP-6A方案收集临床患者低浓度血清(L;接近最低检测限)和高浓度血清(H;接近检测范围高限),将低值(L)、高值(H)血清按一定比例配制成系列浓度的混合血清,各取份数按照5L、4L+1H、3L+2H、2L+3H、1L+4H、5H的比例配制混合,得到6个浓度的标本。使用国产预清洗液、缓冲液、清洗液与原装PreClean M、ProCell M和CleanCell M液分别对所有浓度标本在2 h内随机重复检测3次,计算每个浓度的均值。见表4。结果表明,国产预清洗液、缓冲液、清洗液与原装PreClean M、ProCell M、CleanCell M液的敏感度及测量范围比较差异均无统计学意义(均P>0.05)。

表4 采用国产洗液与罗氏原装洗液分析测量范围比较
2.5 室内质控及室间质评 将罗氏配套PreClean M、ProCell M、CleanCell M液更换为国产配套清洗液、清洗液和缓冲溶液并灌注后,检测7个项目的质控品,采用质控软件统计,绘制均值为现用质控图均值。罗氏原装配液与国产配液全部质控结果都在±s范围内,比较均值及CV值差异无统计学意义。见表5。采用国产洗液对2021年第二次国家卫生健康委肿瘤标志物Ⅰ室间质评的质控品进行复测,所有项目结果偏倚均在±5%以内。

表5 罗氏原装配套溶液与国产配套溶液室内质控对比
3 讨论
电化学发光法具有精密度、敏感度高、检测线性范围广、结果稳定等优点,且配套试剂稳定性较好,保存时间较长[3]。在医学检验及科研工作中得到广泛应用。电化学发光检测原理以三联吡啶钌为标记物,与三丙胺(tripropylamine,TPrA)共同构成电化学发光系统,三联吡啶钌催化TPrA在电极表面发生特异性电化学发光反应[4],与酶促发光法、直接发光法等方法比较,具有较大优势。
电化学发光免疫分析系统中,PreClean M液用于清除可能干扰信号检测的物质[4];CleanCell M液用于为电极提供缓冲环境,在每次测定后清洗试管系统和检测元件;而ProCell M液中的TPrA参与电极表面的氧化还原反应[5],因此ProCell M液在检测过程中作为电子供体很重要[6]。国产清洗液若与罗氏原装ProCell M液存在明显差异,会导致发光信号值的差异。罗氏电化学发光免疫检测分析系统中,主要检验原理是竞争法和夹心法,因使用洗液的变化可导致检测结果出现偏低或偏高[7]。
本研究以罗氏Cobas 6000 e 601电化学发光免疫分析系统为检测平台,比较国产配套洗液与罗氏原装洗液的性能测试结果,对仪器分别进行性能验证,交叉污染率及敏感度对比。采用不同检测方法检测 6个项目,结果比较差异均无统计学意义。对7个免疫项目经过1个月室内质控跟踪,所有测量项目的高低浓度水平质控全部在本实验室绘制质控指标的x±2s之内,且CV值均与罗氏原装溶液相近。复测2021年国家卫生健康委室间质评第二次肿瘤标志物Ⅰ样品,结果显示偏倚在±5%以内。
综上所述,国产配套洗液在罗氏Cobas 6000 e系列电化学发光免疫分析系统中各性能指标验证结果均合格,临床对比标本结果根据EP9-A2文件要求均可接受。在实际检测分析应用中可替代罗氏原装配套洗液,有研究表明在实际应用中无需重新校准,可直接替换原装洗液使用[8-10]。使用国产洗液能为医院降低耗材使用成本,减轻患者的经济负担。
利益冲突所有作者均声明不存在利益冲突

