核心素养指导下的高中化学盐类水解的解题思路分析
吴仕君
摘要:盐类水解在高中化学教学中非常重要,其中的知识点很抽象,题型复杂多变,对学生的宏观辨识与微观探析以及变化观念与平衡思想要求很高。学生要在核心素养的指导下学会对试题进行归纳总结,了解其中的规律和本质,在探究中学会证据推理,建构模型认知,实现科学探究与创新意识的培养。本文主要探究了核心素养指导下的高中化学盐类水解的解题思路,促进学生了解解题方法,提高解题能力。
关键词:高中化学;核心素养;盐类水解;解题思路
盐类水解问题是重要考点,教师要带领学生深入分析和总结,把零散的知识归纳概括,理清头绪。学生通过类比推理和分类概括充分解知识要点,形成清晰思路,在解题过程中做到心中有数。有了解题规律做引导,学生会科学分析,主动判断,在解题过程中建构模型认知,提高科学探究能力,了解化学的微观现象和宏观世界,提高学生的学习兴趣和解题能力。
一、探究试题类型,明确考查形式
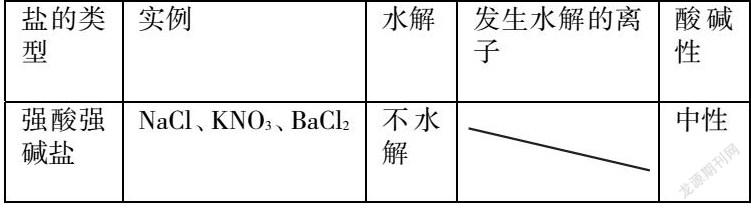
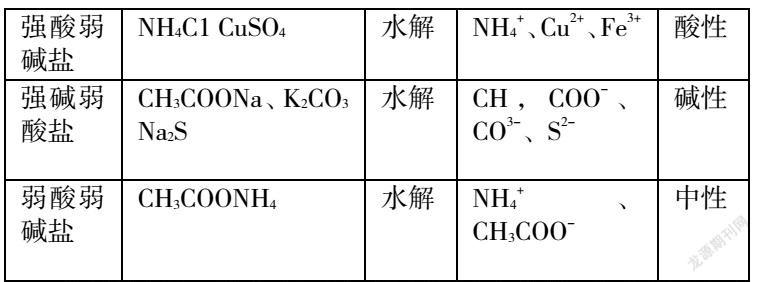
在解答盐类水解问题时首先要明确常考的试题类型,掌握规律,了解解题技巧和方法。明确了盐类水解问题的常考试题类型会使学生思路清晰,更好地了解考查形式和解题方向,轻松答题。通过对试题类型分析可以发现,盐类水解试题通常包括了强碱弱酸盐阴离子的水解,其水溶液呈碱性,如CH3COONa水解的离子方程式为CH3COO-+H2O⇌CH3COOH+ OH-;多元弱酸的酸根离子分步水解,如Na2CO3水解的离子方程式为C032- +H20⇌HCO3- +OH-、HCO3- +H2O⇌ H2CO3+OH- 。其次还有强酸弱碱盐,阳离子水解,其水溶液呈酸性,如氯化铵、氯化铝水解的离子方程式分别为NH4+ + H20⇌H++NH3·H2O、Al3+ +3H2O⇌Al(OH)3+3H+。NaCl等强酸强碱盐不水解,溶液呈中性。同时还有弱酸弱碱盐双水解,其溶液的酸碱性取决于弱酸和弱碱的相对强弱。当Ka=Kb时,溶液显中性,如CH3COONH4:当Ka>Kb时,溶液显酸性,如HCOONH4;当Ka<Kb时,溶液显碱性,如NH4HCO3。最后一种就是弱酸酸式盐水解,取决于酸式酸根离子电离程度和水解程度的相对大小。如果电离程度大于水解程度,溶液呈酸性,如NaHSO3、NaH2PO4等。若电离程度小于水解程度溶液呈碱性,如NaHCO3、Na2 HPO4等。在自主总结中,学生要了解常见试题类型,面对试题可以分门别类地探究,并选择恰当的解题方法。
二、总结解题规律,了解本质特征
学生是课堂的主体,为了提高学生的盐类水解解题能力,教师要充分发挥学生的主观能动性,让学生在探究中主动总结解题规律,了解试题本质特征,实现对盐类水解原理的掌握。学生在分析中学会盐类水解的条件、规律、影响因素以及溶液中粒子浓度、pH大小的比较等,也要明确盐类水解的化学方程式及离子方程式,才能更好地解决问题。学生在总结时,要学会概括:难溶不水解,有弱才水解,无弱不水解,越弱越水解,都弱双水解,谁强显谁性,同强显中性,都弱不一定。学生在学习中要掌握盐的类型,可以归纳总结如下表格:
中性掌握了规律,学生在解题时按照规律来分析,会达到事半功倍的效果。教师可以通过具体练习来引导学生探究:例如为了除去MgCl2酸性溶液中的Fe3+,可以在加热搅拌的条件下加入一种试剂,过滤后再加入适量的HCl,这种试剂是()
A. NH3·H2OB. NaOHC. Na2CO3D. MgCO3
分析中,学生会设法使Fe3+的水解平衡右移生成沉淀,又不能引入新的杂质离子。学生会认识到物质提纯的根本顾虑是尽量不要减少提纯的物质,不要引入新的杂质,要方便分离和复原。带着这样的思考,学生会想到只有加入MgCO3才不会引入新的杂质离子。因为其他物质都会发生水解,产生新的物质。通过对规律的分析,学生会明确化学反应现象,快速找到解决问题的方法,提高解题能力。
三、分析影响因素,挖掘知识内涵
通过对高考试题的分析,可以得出盐类水解对水的电离平衡的影响的定性、定量判断以及影响因素探究,这是是高考考查的重点。学生了解了盐类水解的概念、实质、特点、规律和影响因素并在解题中能更好地理解题干信息,再围绕着试题深入分析、逻辑推理和主动判斷,从而顺利地解决问题。例如在恒温条件下,在CH3COONa稀溶液中分别加入少量下列物质:①固体NaOH②固体KOH③固体NaHSO4④固体CH3COONa⑤冰醋酸。其中一定可使c(CH3C0O-)/ c(Na+)比值增大的是()
A.①② B.②⑤ C.①⑤ D.②④⑤
在分析中,学生会看到本题考查的是化学平衡移动原理。在解决盐类水解问题时,教师要引导学生灵活运用勒夏特列原理来分析影响盐类水解的因素,促进学生找到解决问题的切入点,形成解题思路。解题中,学生会想到要使c(CH3C0O-)/ c (Na+)比值增大,就要使它与水之间发生化学反应,而且要保持水解平衡逆向移动,加入固体CH3COONa会达到平衡右移,但是水解程度降低,通过比较分析②④⑤都是可以的。学生在推理中会进一步理解水解的影响因素,在知识加工中总结,在推理中分析规律,实现快速解决问题,提高解题能力。
总之,盐类水解需要溶液中有弱碱阳离子或弱酸阴离子,并且要有可以溶于水的盐类。学生通过对试题类型和考查内容的分析会看到盐类的水解就是中和反应的逆反应。中和反应的程度越大,水解反应的程度越小。学生在对解题规律和解题方法的探究中会认识到水解反应是微弱的、可逆的,在总结中会建构起解题模型,快速把握知识本质,实现解题能力的提高。
参考文献:
[1]李涯红.高中化学盐类水解解题题型归纳[J].数理化解题研究,2021(28):108-109.
[2]曹泓波.关于高中化学盐类水解类型题的解题方法研究[J].祖国,2018(18):252-253.

