加拿利海枣种子的贮藏特性
何兰兰,刘宝林
加拿利海枣种子的贮藏特性
何兰兰,刘宝林
(上海理工大学 医疗器械与食品学院,上海 200093)
针对加拿利海枣种子成熟时具有含水量高,采摘后贮藏不当极易发生霉变等问题,探究加拿利海枣种子的脱水耐性、低温敏感性和贮藏特性。将新鲜成熟的果实在硅胶中干燥,测定加拿利海枣种子的含水量随时间的变化情况,以及不同含水量种子的萌发率。将新鲜种子在4、15 ℃下贮藏1、3、6个月,记录在贮藏过程中种子和种胚的形态变化情况,测定贮藏温度对种子的萌发率和活力的影响情况。当含水量从成熟脱落期的53.79%降至8.0%时,种子的萌发率由76.0%增至92.9%。在贮藏期间,种胚在2种温度下均未生长。在贮藏6个月后,种子的萌发率显著下降,在4 ℃下贮藏时种子易发霉, 但在4 ℃下贮藏后种子的萌发率显著高于在15 ℃下贮藏后种子的萌发率。加拿利海枣种子具有低温耐性和强脱水耐性,为正常性种子。新鲜种子在采后通过干燥和低温保存的方法可以有效保持种子的活力,延长其贮藏期。
脱水耐性;贮藏特性;正常性种子
棕榈科是世界上三大经济植物类群之一,目前已知的棕榈科约含202属、2 800种[1]。其中,海枣属()约含17种,主要分布于亚洲和非洲的热带及亚热带地区。我国有5种海枣属,其中,刺葵()和江边刺葵()原产于我国台湾、广东、海南、广西、云南等地,另引入了无茎刺葵()、加拿利海枣()和海枣(),多为观赏栽培[2]。
Roberts[3]根据种子的脱水耐性和贮藏特性将种子分为顽拗性种子、中间性种子和正常性种子。顽拗性种子具有明显的脱水敏感性和低温敏感性,轻度脱水和低温条件会导致种子快速丧失萌发能力[4]。中间性种子可以耐受一定程度的失水,其贮藏特性介于顽拗性种子与正常性种子之间。正常性种子可以耐受较高程度脱水,且在低温环境下不易受到损伤,因此可在受控的条件下贮藏更长时间[5-6]。
不同属或同属不同种间植物种子的贮藏特性往往具有较大区别。棕榈科中大多数植物的种子为顽拗性种子[7],种子在成熟脱落或采摘后快速失去萌发能力,且种子不耐贮藏。海枣属植物种子通常具有较强的耐热性和耐寒性,可以在沙漠等极端环境下生存繁殖[8-9]。大多数海枣属种子表现为正常性,如、和[10],也有物种(如等)的种子表现为中间性[8]。同时,大部分棕榈科植物种子在成熟时种胚未发育完全[11],部分植物种子的种胚会在贮藏期间生长[12]。
加拿利海枣(Chabaud)为棕榈科海枣属多年生常绿乔木,原生于非洲西北部加利群岛,广泛种植于热带和亚热带地区[9]。加拿利海枣的树形优美舒展,是极具观赏性热带植物之一,具有较大的园艺价值。加拿利海枣在20世纪80年代被引入中国,栽培于中国长江以南地区。加拿利海枣果实通常在成熟期采摘后会被快速干燥,以延长其贮藏时间,但不适宜的贮藏条件往往会导致低发芽率,因此需了解其贮藏特性,并在合适的条件下保存种子[13]。目前,对加拿利海枣的研究多集中于园艺价值,尚未对加拿利海枣种子的贮藏特性进行相关研究。了解加拿利海枣种子的贮藏特性可以为植物繁育和种质资源的保存提供理论支持。
1 实验
1.1 材料
在果实成熟期(2020年9月5日),采集生长于上海理工大学校园内的加拿利海枣树以及种植地周围自然散落的新鲜海枣共约3 000粒。将新鲜的加拿利海枣装至尼龙袋中,并将尼龙袋于采集当天运送至实验室。用清水清洗果实,通过漂浮实验去除虫蛀、腐烂粒,将其余果实置于质量分数为1%的NaClO溶液中浸泡30 min,以消毒,然后在流动的自来水下冲洗3次,洗去表面的残留溶液,并用无纺布吸干表面水分。将消毒后的果实放置在铺有吸水纸的托盘上,并置于阴凉条件下12 h,使果实表面的水分充分蒸发。将处理后的海枣收集至尼龙袋中,所有实验在1 d后开始。除特别说明,文中“种子”均指加拿利海枣在自然界的繁殖单元(Diaspore),即果实。
主要仪器:SPX–150–GB智能型光照培养箱,上海跃进医疗器械有限公司;101–00BS电热鼓风干燥机,上海宏诺设备有限公司;BCD–241WDCV冰箱,青岛海尔股份有限公司;FA2204B精密电子天平,上海越平科学仪器有限公司;D3300数码单镜反光照相机,尼康映像仪器销售(中国)有限公司。
1.2 方法
1.2.1 种子的基本特性
为了测量种子的百粒质量,随机选取100粒种子,用电子天平(0.000 1 g)称量,重复5次实验。随机选取10粒种子,用电子游标卡尺测量单粒种子的尺寸,后用修枝剪将种子沿腹部剪开,取出种胚后用游标卡尺测量种胚的长度、直径。含水量的测定方法参考国际种子检验协会(ISTA)的种子检验规 程[14]。称取种子的质量后,将种子置于烘箱中烘干,至质量恒定(103 ℃,17 h),每组种子的含水量重复测定3次。种子的含水量计算见式(1)。

1.2.2 种子吸胀实验
为了测量果皮/种皮的透水性,将新鲜种子放置于质量分数为1%的琼脂培养基上,在室温下吸胀30 d,每2 d随机选取5粒果实进行含水量的测定,重复3次实验。由于果皮吸胀1 d后开始破裂,因此测量含水量时将果皮去除。
1.2.3 快速脱水对种子活力的影响
将无水硅胶置于烘箱(103 ℃)中烘干17 h,然后转移至方形聚丙烯盒(17 cm×10 cm×5 cm,带盖)中冷却至室温。选择大小均匀的种子共450粒埋入硅胶中,分别进行3、7、10、15、20 d的干燥处理,得到不同含水量的种子。分别取5粒种子按上述方法测量干燥时间不同时种子的含水量,重复3次实验。
根据预实验可知,加拿利海枣种子的最佳培养温度为变温(30 ℃/25 ℃),光照条件为12 h光照/12 h黑暗的循环,光照期间对应培养温度为30 ℃,黑暗期间对应培养温度为25 ℃。将不同含水量种子分别置于培养皿中,每个培养皿放置25粒种子,同一含水量种子做3次重复实验。将培养皿放入前述温度和光照条件的培养箱中培养,每日统计种子的萌发数量,1周内没有种子萌发时终止培养。以子叶柄突破珠孔盖2 mm记为种子萌发。
1.2.4 贮藏温度对种子活力的影响
为了确定不同贮藏条件对种子活力产生的影响,实验设置2种贮藏温度:4 ℃和15 ℃。将1 000粒新鲜种子分别放入塑料盒(上盖有孔)中,置于4 ℃冰箱和15 ℃恒温培养箱中贮藏1、3、6个月。在贮藏期间种子未进行其他杀菌操作。在贮藏结束时将种子再次用NaClO(1%)溶液消毒30 min,然后再移至培养箱中,每日记录种子的萌发数量,每组25粒,重复3次实验。在培养结束后,按照ISTA[14]种子检验规程,在30 ℃条件下使用2,3,5–三苯基氯化四氮唑(TTC,质量分数为0.5%)染色2 h,测定未萌发种子的活力,重复3次实验。
1.2.5 贮藏期间种子形态的变化
观察种子在贮藏期间颜色和形态的变化情况,并用相机拍摄不同贮藏阶段种子的照片。为了评估贮藏过程中种胚的变化情况,在4 ℃和15 ℃下贮藏期间,每周取出10粒种子测量其种胚的直径和长度。
1.3 数据处理
所有数据均采用IBM SPSS Statistics 26处理,将不同干燥时间和贮藏方式对种子萌发率的影响进行单因素ANOVA分析(置信度95%),并采用最小显著性差异法(LSD)进行比较。所有数值均以平均值±标准差表示。
2 结果与分析
2.1 种子基本特性
加拿利海枣果皮成熟时会由绿色变为黄色,然后至橙黄色(图1a)。种子的百粒质量为(200.40± 0.91)g,长度为(17.86±0.50)cm,直径为(12.74± 0.37)cm。种胚呈圆柱状,长度为(3.11±0.18)cm,嵌入胚乳端(珠孔盖远端)直径为(1.69±0.14)cm(见图1和表1)。种胚长度(1)与种子长度(2)的比值约为0.17,种胚体积与种子总体积的比值小于1%。成熟脱落果实的含水量为53.79%,其中果皮、胚乳和种胚的含水量分别为(78.77±0.14)%、(35.58±0.60)%和(65.89±0.68)%。
2.2 吸胀实验
果皮吸水后,外果皮破裂,露出中果皮,见图1b。30 d吸胀实验结果显示,种子的含水量整体呈缓慢上升趋势(见图2),在30 d时达到最高值(39.26±0.64)%,含水量增长了10.34%。
2.3 干燥对种子萌发率的影响
种子在干燥过程中果皮会出现质地变脆、颜色变深、皱缩等现象(见图1c)。在干燥时间为10 d时,部分种子果皮出现破裂现象。种子的含水量随着干燥时间的延长呈下降趋势,前3天水分的减幅最大(见图3),干燥时间为20 d时含水量由初始含水量(53.79±0.34)%降至(7.96±0.51)%(见图3)。未经干燥处理种子的萌发率为76.0%,干燥 时间为7 d时种子的萌发率略降至74.0%,干燥时间为0、3、7 d时种子的萌发率无显著差异(>0.05)。随着干燥时间的延长,种子的萌发率显著(<0.05)上升,其中干燥时间为20 d时含水量降至8.0%,此时萌发率最高,为(93±1.73)%(见图3)。

图1 不同处理下加拿利海枣果实的形态
表1 加拿利海枣种子的种胚直径和长度随贮藏时间的变化情况
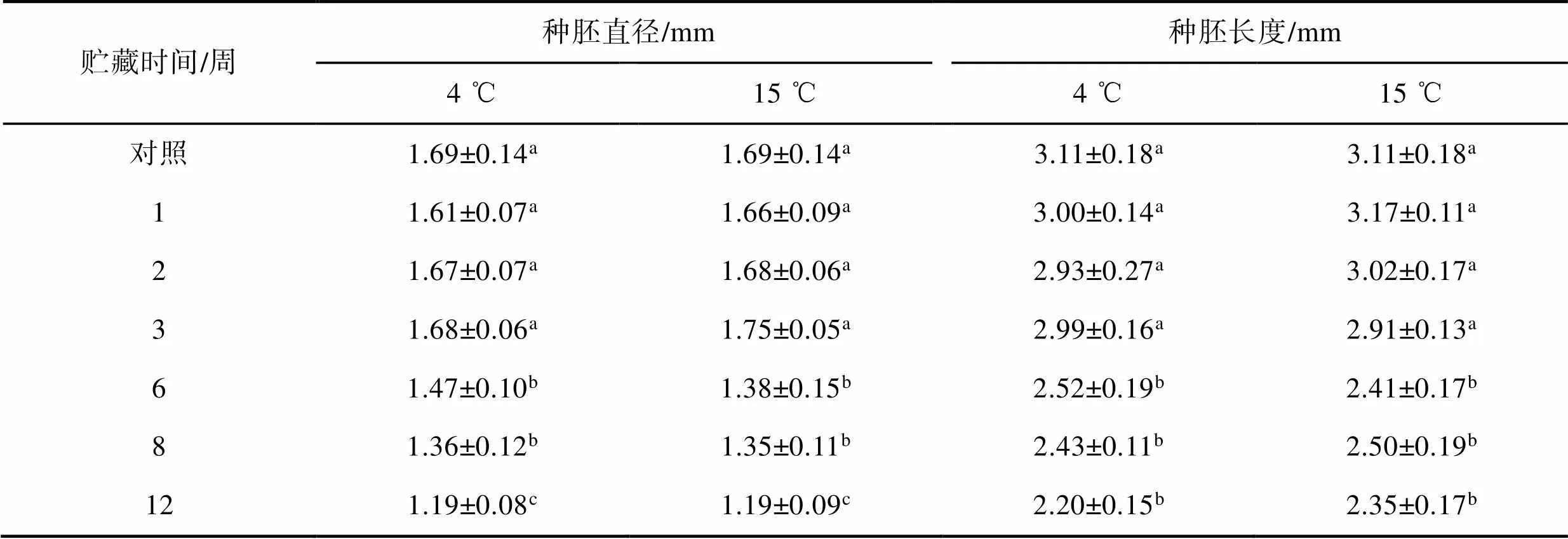
Tab.1 Changes in seed embryo diameter and length of Canary date seeds with storage time. Different letters represent significant differences
注:不同字母代表差异显著,显著性水平为0.05。
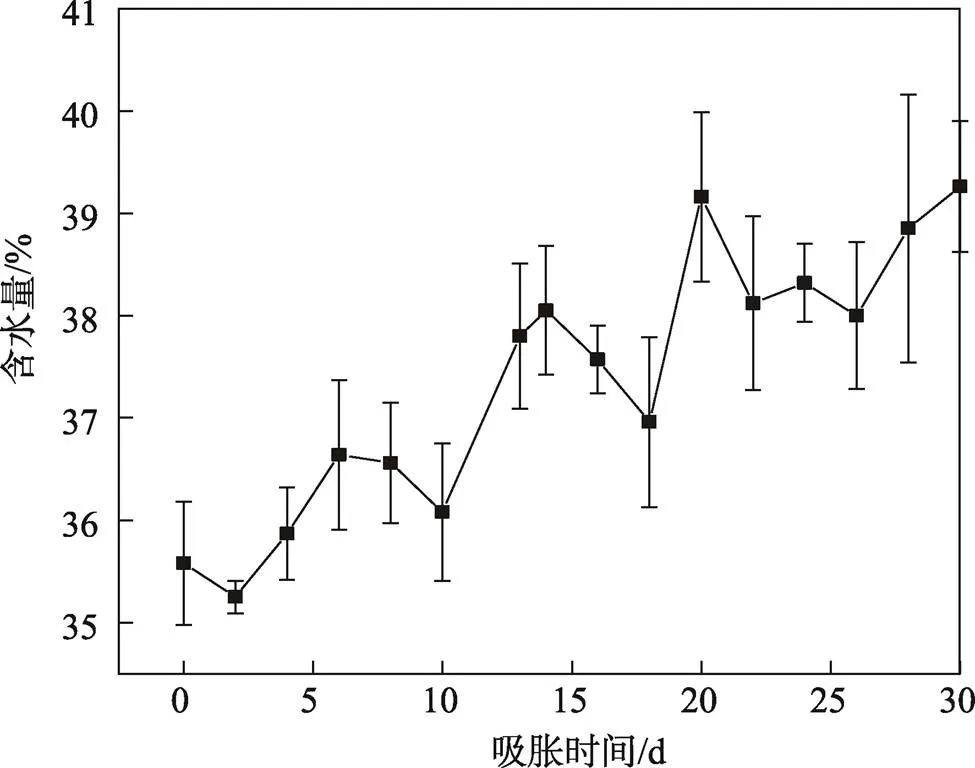
图2 加拿利海枣种子的吸胀曲线
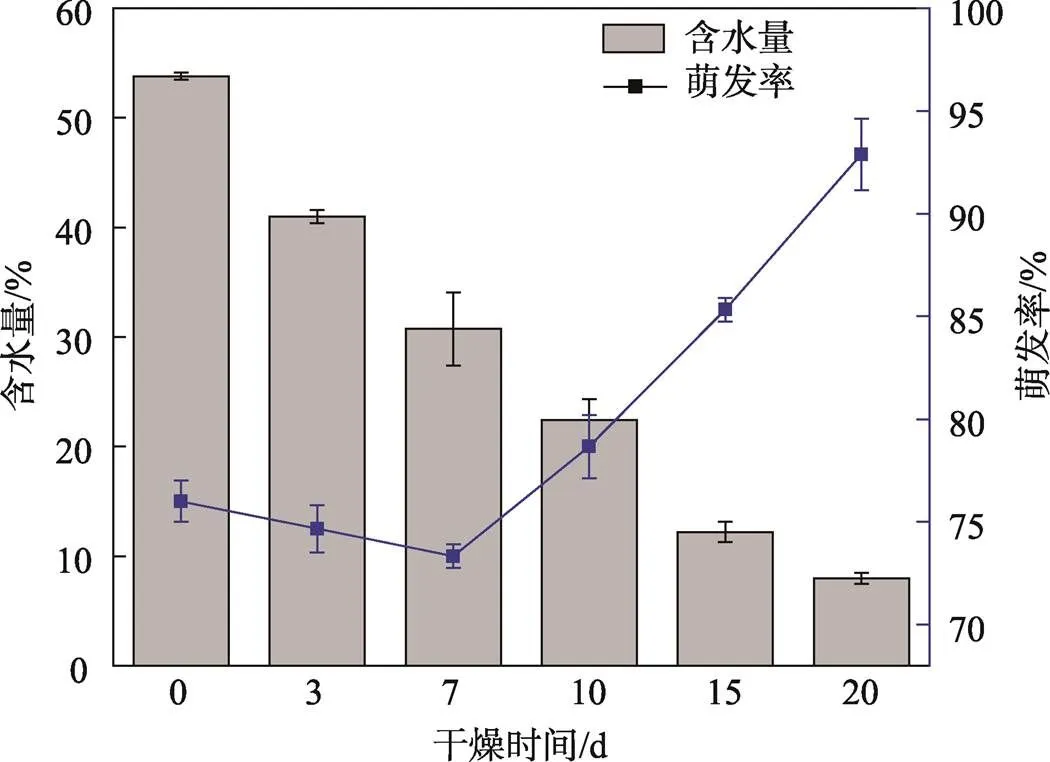
图3 干燥时间不同时加拿利海枣种子含水量和萌发率的变化情况
2.4 贮藏温度对种子萌发率和活力的影响
种子的萌发率会随着贮藏时间的延长呈下降的趋势,贮藏6个月时种子的萌发率显著(<0.05)下降(见图4)。在15 ℃下贮藏1、3、6个月后,种子的萌发率分别为(80.0±2.00)%、(70.7±0.58)%、(16.0±1.00)%。在4 ℃下贮藏时,种子的萌发率分别为(78.7±0.58)%、(74.7±0.58)%、(48.4±2.08)%。贮藏6个月后,在4 ℃下贮藏种子的萌发率显著(<0.05)高于在15 ℃下贮藏的种子。在2种温度下贮藏6个月后,未萌发种子的TTC染色结果显示,在4 ℃下贮藏时种子种胚靠近珠孔盖一端未被着色,另一端则为浅粉色;在15 ℃下贮藏的种子种胚完全未被染色,即在4 ℃下贮藏6个月后种子的活力高于在15 ℃下贮藏的种子。
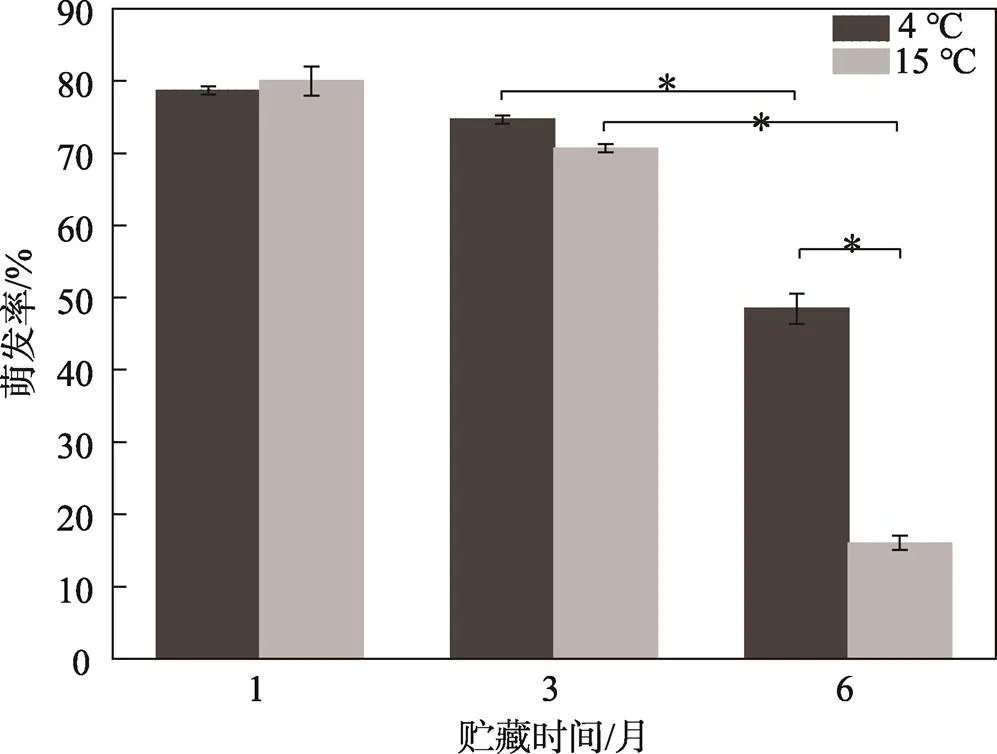
图4 不同贮藏时间和温度对加拿利海枣种子萌发率的影响
注:*表示萌发率有显著性差异,显著性水平为0.05。
2.5 贮藏期间种子形态的变化
在4 ℃和15 ℃下贮藏过程中,种子果皮的颜色逐渐变为红褐色(见图1d)。胚乳颜色由白色变为灰色,横截面可见胚乳中有棕榈油析出,且胚乳干燥后硬度变大(见图1c)。种子在不同温度下贮藏均存在一定程度的失水,种胚在贮藏过程中逐渐萎缩变小,胚乳与种胚之间出现空隙(见图1c)。种胚的体积由于失水逐渐下降(见表1),在4 ℃或15 ℃下贮藏12周后,种胚长度缩小至贮藏前的75.6%和70.7%,直径缩减了29.59%,但贮藏期间种胚形态未发生变化。在4 ℃下贮藏3个月以上时,在容器底部明显可见冷凝水,且大部分果皮发霉变黑,在15 ℃下贮藏的发霉种子数量少于4 ℃下的发霉种子数量。
3 讨论
大部分种子在生长发育后期会经历一段成熟干燥期。与大多数亚热带植物种子相同,加拿利海枣果实的初始含水量较高,即果实在成熟过程中没有或只经历了轻微成熟的干燥期。以往的研究表明,棕榈种子的吸胀速率较低[11],与文中实验结果相符。果皮在吸胀12 h后便开始破裂。虽然种子的吸水速率整体缓慢,但较成熟脱落期的含水量有明显上升,可知果皮与种皮均具有透水性。Pérez等[15]发现种子在吸胀14 d后达到最高含水量,而种子完全吸胀所需时间为10~13 d[16]。种子吸胀的前4天含水量增加了约6倍,之后增长相对平缓[17]。实际上,棕榈科植物种子吸胀速率较慢的原因是胚乳含油量高,而并非因果皮不透水。
许多棕榈科植物的种子会在成熟脱落后的3~6周内因脱水而失活[18],蒲葵种子为顽拗性种子,其在含水量降至8%时就完全丧失活性。棕榈种子表现为中间性,在含水量脱水至10%左右时,仍具有27%左右的萌发率[19]。然而,刺葵属代表种海枣可以在沙漠等干旱地区长期生存[20]。Spennemann等[13]发现,在野外环境中被自然干燥的往季的加拿利海枣种子与当季散落的新鲜种子相比,萌发潜力没有显著差异,即干燥没有导致种子的活力下降。实验中,当含水量降至8.0%时加拿利海枣种子仍有较高的萌发率,表明种子具有很强的脱水耐性。这种脱水耐性使加拿利海枣得以在干旱地区和半干旱地区长期生存,适应热带、亚热带及温带地区的气候环境,可以广泛繁殖。同时,脱水非但没有导致种子萌发率的下降,反而产生了显著的促进作用。Ehara等[21]发现的果皮会对种子萌发产生抑制作用,移除果皮或是破坏果皮结构可以显著提高种子的萌发率。相同的结果也在种子中被证实[22]。由此可以推测,干燥后加拿利海枣种子萌发率的上升是因脱水引起果皮干裂,导致完整的果皮结构被破坏,从而解除了果皮对萌发的抑制。
研究表明,部分棕榈科植物种子如棕榈()的种胚在贮藏过程中会发生形态变化[11, 23]。Jaganathan[23]提出,棕榈科种子未发育完全的种胚在贮藏时期逐渐生长发育,可缩短种子培养后的萌发时间。然而,文中实验结果表明,加拿利海枣种子的种胚尺寸在贮藏中由于干燥失水而持续缩小,尺寸和形态上未出现增长和分化表象,即加拿利海枣种胚在2种贮藏条件下都没有发育。Xiao等[20]的研究表明,加拿利海枣的种胚在萌发(子叶突破珠孔盖)之后才开始发育,即胚根与叶等分生组织始终在子叶柄中保持不分化状态,待环境条件合适时才会进一步发育。文中实验结果也证实加拿利海枣种子萌发前种胚的形态未发生改变。与加拿利海枣种子相似的萌发模式也在一部分棕榈科种子中被发现,如[20]、[24]、[25]等。
合适的贮藏条件可以极大地延长种子的贮藏寿命。文中实验结果表明,种子的萌发率和活力随着贮藏时间的延长呈逐渐下降的趋势,但在贮藏温度4 ℃下种子活力的下降速率显著小于15 ℃下的下降速率。在其他种子贮藏实验中,如4 ℃下贮藏棕榈()种子可以维持较高的种子活性,贮藏效果优于15 ℃[19]。Tweddle等[26]的研究表明,刺葵属植物的贮藏特性大多为正常性而种子由于缺乏详细的贮藏特性实验,被记录为“可能为正常性种子”。文中实验结果表明,加拿利海枣种子对低温不敏感,加之其具有较强的脱水耐性,可以判断其均为正常性种子。由于新鲜加拿利海枣果实的含水量较高,贮藏过程中极易受到霉菌感染,导致腐烂。为了防止种子发霉腐烂,在贮藏前可以预先去除果皮或进行适度干燥处理,同时应降低贮藏环境的空气湿度。
4 结语
了解种子的贮藏特性对种质资源保存策略的制定至关重要。与大部分热带及亚热带植物的种子相似,加拿利海枣种子成熟时体积大且含水量较高。与大多数棕榈科植物产生的顽拗性种子所具有的干燥敏感性和低温敏感性不同,加拿利海枣种子具有较强的脱水耐性。当含水量降至10%以下时,加拿利海枣种子仍有高萌发率,且4 ℃下低温贮藏效果显著优于15 ℃,即种子具有正常性种子的特性,此特性有利于加拿利海枣种子的短期贮藏。由此可知,在收获后对种子进行适度干燥,并在低温下贮藏,可以有效保持种子的活力和萌发率,避免种子在贮藏中出现发霉现象。此外,对于热带、亚热带植物种质资源的长期超低温保存是目前研究的难题。目前,仅有少数热带作物种子可在液氮中成功保存,但解冻后仍面临萌发率低、生长势弱等问题。文中实验结果证明,加拿利海枣种子具有低温和干燥耐性,为加拿利海枣种子的超低温保存提供了参考。
[1] EISERHARDT W L, SVENNING J C, KISSLING W D, et al. Geograph ical Ecology of the Palms (Arecaceae): Determinants of Diversity and Distributions across Spatial Scales[J]. Annals of Botany, 2011, 108(8): 1391-1416.
[2] Species 2000. Catalogue of Life China 2021 Annual Checklist[DB/OL]. (2021-05-22)[2021-07-01]www.sp2000. org.cn.
[3] ROBERTS E. Predicting the Storage Life of Seeds[J]. Seed Science and Technology, 1973, 1(3): 499-514.
[4] BALLESTEROS D, FANEGA-SLEZIAK N, DAVIES R M. Cryopreservation of Seeds and Seed Embryos in Orthodox-, Intermediate-, and Recalcitrant-Seeded Species[J]. Methods in Molecular Biology, 2021, 2180: 663-682.
[5] ELLIS R H, ROBERTS E H. Improved Equations for the Prediction of Seed Longevity[J]. Annals of Botany, 1980, 45(1): 13-30.
[6] MAYRINCK R C, VILELA L C, PEREIRA T M, et al. Seed Desiccation Tolerance/Sensitivity of Tree Species from Brazilian Biodiversity Hotspots: Considerations for Conservation[J]. Trees, 2019, 33(3): 777-785.
[7] 张俊杰, 蒋学皎, 郭庭鸿, 等. 顽拗性种子脱水敏感性研究进展[J]. 西北林学院学报, 2021, 36(3): 144-151.
ZHANG Jun-jie, JIANG Xue-jiao, GUO Ting-hong, et al. Research Progress on Desiccation-Sensitivity of Recalcitrant Seeds[J]. Journal of Northwest Forestry University, 2021, 36(3): 144-151.
[8] FINTEL G T V, BERJAK P, PAMMENTER N W. Seed Behaviour inJacquin, the Wild Date Palm[J]. Seed Science Research, 2004, 14(2): 197-204.
[9] SOSA P A, SARO I, JOHNSON D, et al. Biodiversity and Conservation of: A Review[J]. Biodiversity and Conservation, 2021, 30(2): 275-293.
[10] TWEDDLE J C, DICKIE J B, BASKIN C C, et al. Ecological Aspects of Seed Desiccation Sensitivity[J]. Journal of Ecology, 2003, 91(2): 294-304.
[11] BASKIN J, BASKIN C. What Kind of Seed Dormancy might Palms Have?[J]. Seed Science Research, 2013, 24(1): 17-22.
[12] JAGANATHAN G K. Defining Correct Dormancy Class Matters: Morphological and Morphophysiological Dormancy in Arecaceae[J]. Annals of Forest Science, 2020, 77(4): 1-6.
[13] SPENNEMANN D, PIKE M, ROBINSON W. Germination Rates of Old and Fresh Seeds and Their Implications on Invasiveness of the Ornamental Canary Islands Date Palm ()[J]. European Journal of Ecology, 2020, 6(2): 70-86.
[14] International Seed Testing Association. International Rules for Seed Testing[J]. Seed Science and Technology, 1999, 27: 27-32.
[15] PÉREZ H, CRILEY R, BASKIN C. Promoting Germination in Dormant Seeds of(Kuntze) Beck, an Endangered Palm Endemic to Hawaii[J]. Natural Areas Journal, 2008, 28: 251-260.
[16] VISSCHER A M, CASTILLO-LORENZO E, TOOROP P E, et al.(Arecaceae) Seeds at Suboptimal Temperature Show Reduced Imbibition Rates and Enhanced Expression of Genes Related to Germination Inhibition[J]. Plant Biology, 2020, 22(6): 1041-1051.
[17] OLIVEIRA N C C, LOPES P S N, RIBEIRO L M, et al. Seed Structure, Germination, and Reserve Mobilization in(Arecaceae)[J]. Trees, 2013, 27(6): 1633-1645.
[18] BROSCHAT T. Palm Seed Propagation[J]. Acta Horticulturae, 1994: 141-148.
[19] 李朋. 蒲葵和棕榈种子脱水耐性的研究[D]. 重庆: 重庆师范大学, 2012: 17-38.
LI Peng. A Study on Dehydration Tolerance ofand Hemp Palm Seeds[D]. Chongqing: Chongqing Normal University, 2012: 17-38.
[20] XIAO Ting-ting, RAYGOZA A A, PÉREZ J C, et al. Emergent Protective Organogenesis in Date Palms: A Morpho-Devo-Dynamic Adaptive Strategy during Early Development[J]. The Plant Cell, 2019, 31(8): 1751-1766.
[21] EHARA H, MORITA O, KOMADA C, et al. Effect of Physical Treatment and Presence of the Pericarp and Sarcotesta on Seed Germination in Sago Palm (Rottb)[J]. Seed Science and Technology, 2001, 29(1): 83-90.
[22] GUIMARÃES L A D O P, SOUZA R G D, DAN M L, et al. Emergence and Vigor ofSeedlings under Shading Levels and the Presence and Absence of the Pericarp[J]. Idesia, 2018, 36(1): 49-56.
[23] JAGANATHAN G K. Ecological Insights into the Coexistence of Dormancy and Desiccation-Sensitivity in Arecaceae Species[J]. Annals of Forest Science, 2021, 78(1): 1-14.
[24] FERREIRA C D, SILVA-CARDOSO I, FERREIRA J C B, et al. Morphostructural and Histochemical Dynamics of(Arecaceae) Germination[J]. Journal of Plant Research, 2020, 133(5): 693-713.
[25] CONCEIÇÃO NEVES S, RIBEIRO L M, CUNHA I R G, et al. Diaspore Structure and Germination Ecophysiology of the Babassu Palm ()[J]. Flora-Morphology, Distribution, Functional Ecology of Plants, 2013, 208(1): 68-78.
[26] TWEDDLE J C, TURNER R M, DICKIE J B. Seed Information Database (Release 5.0)[DB/OL]. (2003-07-01) [2021-07-01]http://data.kew.org/sid/sidsearch.html, 2021.
Seed Storage Behavior of Canary Date Palm
HE Lan-lan,LIU Bao-lin
(School of Medical Instrument and Food Engineering, University of Shanghai for Science and Technology, Shanghai 200093, China)
The paper aims to understand the storage characteristics of seeds, which is essential for the development of germplasm conservation strategies. To address the problems of high moisture content ofseeds at maturity and their susceptibility to mold after harvesting, freshly dispersed diaspores were dried in silica gel to different moisture contents and stored at 4 ℃ and 15 ℃ for 1, 3 and 6 months, and the germination of seeds under drying and storage at different temperatures were determined to determine the desiccation tolerance and storage behavior of seeds. The results showed that the seed germination percentage increased from 76.0% to 92.9% when the moisture content was reduced from 53.79% to 8.0% at the time of natural dispersal. Seed embryos did not show growth during storage at either temperature. The seed germination percentage decreased significantly after 6 months of storage and seeds were susceptible to mold when stored at 4 ℃. The seeds were tolerant of low temperatures and seed survival was significantly higher after short-term storage at 4 ℃ than at 15 ℃, i.e.seeds were orthodox.
desiccation-sensitivity; storage behavior; orthodox seed
S375
A
1001-3563(2022)11-0126-06
10.19554/j.cnki.1001-3563.2022.11.016
2021–08–24
国家自然科学基金(31750110474,32001119)
何兰兰(1998—),女,上海理工大学硕士生,主攻种质资源低温保存。
刘宝林(1968—),男,博士,教授,主要研究方向为低温生物医学技术和食品冷冻冷藏。
责任编辑:彭颋

