滇黄芩总黄酮不同极性萃取部位对非酒精性脂肪肝模型大鼠的改善作用研究
王蒙蒙 乔雪 方琼莲 付胜男 李欣坪 黄丰 林玉萍

关键词滇黄芩;总黄酮;极性萃取部位;非酒精性脂肪肝;保肝;氧化应激;炎症因子
非酒精性脂肪肝(non-alcoholic fatty liver disease,NAFLD)是一种常见的慢性肝病,在发达国家发病率较高,是隐源性肝硬化和慢性肝病的主要病因之一[1 - 2]。NAFLD的全球患病率约为25%,如果不进行及时治疗,可能发展为肝硬化以及肝功能衰竭和肝细胞癌,甚至导致死亡[3]。与NAFLD发展密切相关的危险因素包括胰岛素抵抗、脂代谢紊乱、氧化应激、炎症、细胞凋亡和纤维化等,调节脂代谢紊乱、减轻氧化应激和炎症是中药治疗NAFLD的关键[4]。
滇黄芩为唇形科植物滇黄芩Scutellaria amoena C.H. Wright 的根,又名枯芩、西南黃芩等,主要分布在云南、四川、贵州等地[5-6]。《云南民族药大辞典》记载,其味苦、性寒,归肝、肺、胃、胆、大肠经,彝医常用于治疗肝痛、传染性肝炎、肺咳等疾病[7]。关于滇黄芩药理活性的研究报道较少,目前的研究报道仅显示其具有抗氧化[8-9]、抗心律失常[10]、改善四氯化碳(CCl4)所致肝损伤等作用[11]。本课题组前期研究发现,滇黄芩主要以黄酮类成分为主,具有较好的降脂作用[12-13]。本研究拟以高脂饮食诱导建立NAFLD大鼠模型,考察滇黄芩总黄酮不同极性萃取部位对模型大鼠的保肝作用,探究滇黄芩在抗氧化、保肝等方面的药用价值,为民族药滇黄芩资源的充分利用提供参考。
1 材料
1.1 主要仪器
本研究所用的主要仪器有Infinite M200 PRO 型酶标仪(瑞士Tecan 公司),H1850R型台式高速冷冻离心机(湖南湘仪实验室仪器开发有限公司),DY89-Ⅱ型电动玻璃匀浆机(宁波新芝生物科技股份有限公司),RM2016 型组织切片机(上海徕卡仪器有限公司),XB220A 型电子分析天平(瑞士Precisa 公司),NikonECLIPSE C1 型正置显微镜、Nikon Digital Sight DS-FI2型成像系统(日本Nikon公司)。
1.2 主要药品与试剂
滇黄芩药材于2017 年采自云南省新平县,经云南中医药大学中药学院普春霞副教授鉴定为唇形科植物滇黄芩S. amoena C. H. Wright 的根。总胆固醇(totalcholesterol,TC)测定试剂盒(批号20191102)、三酰甘油(triacylglycerol,TG)测定试剂盒(批号20191203)、天冬氨酸转氨酶(aspartate aminotransferase,AST)测定试剂盒(批号20191130)、丙氨酸转氨酶(alanine transaminase,ALT)测定试剂盒(批号20191129)、高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)测定试剂盒(批号20191202)、低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)测定试剂盒(批号20191129)均购自南京建成生物工程研究所;丙二醛(malondialdehyde,MDA)检测试剂盒( 批号120718190301)、超氧化物歧化酶(superoxide dismutase,SOD)检测试剂盒(批号032219190408)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)检测试剂盒(批号112618190311)、白细胞介素1β(interleukin-1β,IL-1β)检测试剂盒(批号20032602R)、IL-6 检测试剂盒(批号20032603R)、肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)检测试剂盒(批号20032607R)均购自江苏酶免实业有限公司;黄芩苷对照品(批号110715-201016,纯度≥98%)购自中国食品药品检定研究院;其余试剂均为分析纯,水为超纯水。
1.3 动物
本研究所用动物为SPF 级SD大鼠,共36 只,雄性,6~8 周龄,体质量180~200 g,购于湖南斯莱克景达实验动物有限公司[实验动物生产许可证号为SCXK(湘)-2016-0002]。购入后,将大鼠饲养于温度(25±2)℃、相对湿度(45±5)%、12 h 明暗交替的环境中,喂养期间予其自由摄食和饮水。本实验通过了云南中医药大学动物伦理委员会的伦理审核(动物伦理学审查编号为R-06201945)。
2 方法
2.1 滇黄芩总黄酮不同极性萃取部位的制备
取滇黄芩粉末2 kg,加入8 倍量(16 L)95%乙醇,加热回流提取3 次、每次2.5 h,分别过滤并收集滤液。合并3 次滤液,减压回收溶剂得到滇黄芩总黄酮提取物(记为SAF,得率为7.76%;经高效液相色谱法测定,SAF中总黄酮含量为61.7 μg/mL,主要含黄芩苷、韧黄芩素Ⅱ -7-O-β-D- 吡喃葡萄糖醛酸甲酯、去甲汉黄芩素Ⅱ-7-O-β-D-吡喃糖醛酸甲酯、黄芩素、高车前素、汉黄芩素、白杨素和千层纸素A等成分)。取适量SAF,用水分散后,依次用乙酸乙酯、正丁醇萃取3 次,回收溶剂后分别得到滇黄芩总黄酮乙酸乙酯、正丁醇萃取部位浸膏(分别记为SAFA、SAFB,得率分别为46.14%、17.26%)。将上述提取物的浸膏冷冻干燥成粉末,室温保存,使用时用生理盐水溶解。
2.2 造模、分组与给药
将36 只大鼠适应性饲养1 周后,随机挑选6 只作为正常组,给予普通饲料;其余30 只大鼠为造模组,给予高脂饲料。所有大鼠均喂养12 周,然后将造模组大鼠按照随机数字表法分为模型组、非诺贝特组(阳性对照)、SAF组、SAFA组和SAFB组,每组6 只。正常组、模型组大鼠给予生理盐水(10 mL/kg);非诺贝特组大鼠给予非诺贝特(20 mg/kg),剂量参考人体给药剂量设置;SAF组、SAFA 组和SAFB 组大鼠分别给予相应提取物300mg/kg(均以提取物的量计),剂量参考前期预实验结果设置。每日灌胃1 次,连续6周。
2.3 样本取材及处理
末次灌胃后,大鼠禁食不禁水12 h,称定其体质量。腹腔注射2%戊巴比妥钠麻醉大鼠后,于腹主动脉取血;将血液于4 ℃静置30 min 后,以3 000 r/min 低温离心15 min,分离血清。同时,冰上取大鼠肝脏组织,观察肝脏组织的一般外部形态(包括颜色、大小、厚度)。
2.4 肝脏指数测定
取“2.3”项下肝组织,以冰生理盐水清洗干净后,用滤纸吸干多余水分,称量肝脏湿质量,并计算肝脏指数:肝脏指数(%)=肝脏湿质量/大鼠体质量×100%[14]。
2.5 血清中TC、TG、AST、ALT、HDL-C、LDL-C 水平测定
取“2.3”项下血清,采用生化法检测各组大鼠血清中TC、TG、AST、ALT、HDL-C、LDL-C 水平,具体操作按照相应试剂盒说明书方法进行。
2.6 肝组织中SOD、GSH、MDA、IL-1β、IL-6、TNF-α水平測定
取“2.3”项下肝组织,以生理盐水制备10%组织匀浆,然后将匀浆在4 ℃下以3 500 r/min 离心15 min,吸取上层匀浆液。采用酶联免疫吸附测定法检测各组大鼠肝组织中SOD、GSH-Px、MDA、IL-1β、IL-6、TNF-α水平,具体操作按照相应试剂盒说明书方法进行。
2.7 肝组织病理形态学观察
取“2.3”项下肝组织,用4%多聚甲醛固定,常规制备石蜡切片(3 μm),行苏木精-伊红(HE)染色后,在显微镜下观察各组大鼠肝组织病理形态学变化。
2.8 统计学方法
采用SPSS 18.0 软件对数据进行统计分析。结果以x±s 表示,多组间比较采用单因素方差分析,方差齐性时两组间比较采用LSD-t 检验,方差不齐性时两组间比较采用非参数检验。检验水准α=0.05。
3 结果
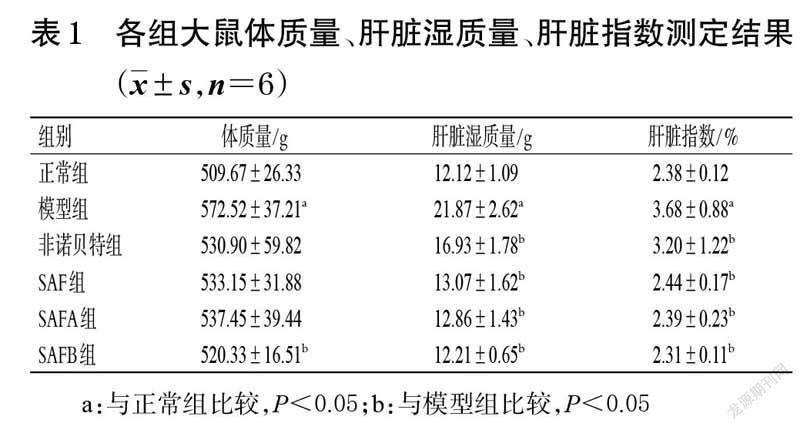
3.1 大鼠体质量、肝脏湿质量和肝脏指数测定结果
与正常组比较,模型组大鼠的体质量、肝脏湿质量和肝脏指数均显著升高(P<0.05);与模型组比较,仅SAFB组大鼠的体质量显著降低(P<0.05),但所有给药组大鼠的肝脏湿质量和肝脏指数均显著降低(P<0.05)。各组大鼠体质量、肝脏湿质量和肝脏指数测定结果见表1。
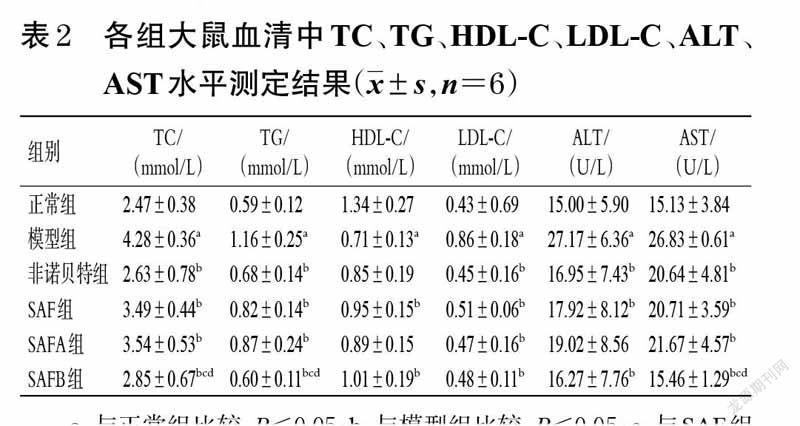
3.2 大鼠血清中TC、TG、HDL-C、LDL-C、ALT、AST水平测定结果
与正常组比较,模型组大鼠血清中TC、TG、LDL-C、ALT、AST水平均显著升高(P<0.05),而HDL-C水平显著降低(P<0.05);与模型组比较,除非诺贝特组大鼠血清中HDL-C水平和SAFA组大鼠血清中HDL-C、ALT水平差异无统计学意义外(P>0.05),其余各给药组大鼠上述指标均显著改善(P<0.05);与SAF 组、SAFA组比较,SAFB 组大鼠血清中TC、TG、AST 水平均显著降低(P<0.05)。各组大鼠血清中TC、TG、HDL-C、LDL-C、ALT、AST水平测定结果见表2。
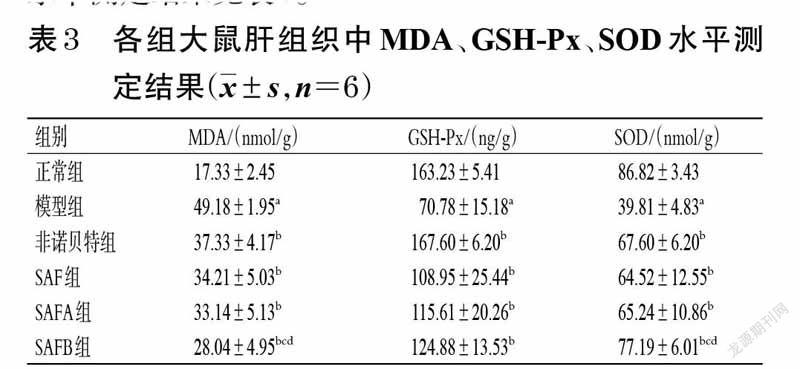
3.3 大鼠肝组织中MDA、GSH-Px、SOD水平测定结果
与正常组比较,模型组大鼠肝组织中MDA水平显著升高(P<0.05),而GSH-Px、SOD水平均显著降低(P<0.05);与模型组比较,各给药组大鼠肝组织中MDA水平显著降低(P<0.05),而GSH-Px、SOD 水平均显著升高(P<0.05);与SAF组和SAFA组比较,SAFB组大鼠肝组织中MDA水平显著降低(P<0.05),SOD水平显著升高(P<0.05)。各组大鼠肝组织中MDA、GSH-Px、SOD水平测定结果见表3。
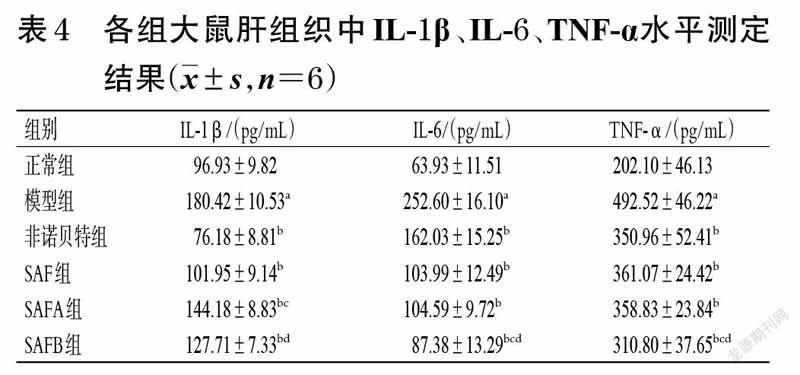
3.4 大鼠肝组织中IL-1β、IL-6、TNF-α水平测定结果
与正常组比较,模型组大鼠肝组织中IL-1β、IL-6、TNF-α水平均显著升高(P<0.05);与模型组比较,各给药组大鼠肝组织中IL-1β、IL-6、TNF-α水平均显著降低(P<0.05);与SAF组比较,SAFA组大鼠肝组织中IL-1β水平显著升高,SAFB组大鼠肝组织中IL-6、TNF-α水平均显著降低(P<0.05);与SAFA 组比较,SAFB 组大鼠肝组织中IL-1β、IL-6 和TNF-α水平均显著降低(P<0.05)。各组大鼠肝组织中IL-1β、IL-6、TNF-α水平测定结果见表4。
3.5 大鼠肝组织病理形态学观察结果
正常组大鼠肝细胞呈规则的放射状排列,大小均匀,肝组织结构和形态均正常。模型组大鼠肝细胞周围可见大量的脂肪空泡,多处细胞核萎缩坏死,有大量炎症细胞浸润。与模型组比较,非诺贝特组大鼠肝细胞损伤状况明显改善,脂肪空泡明显减少,细胞核大小正常,炎症细胞浸润明显改善。滇黄芩总黄酮各极性萃取部位组大鼠肝损伤状态均有不同程度改善,脂肪空泡和细胞坏死现象明显减少,但仍有少量炎症细胞浸润;其中,以SAFB 组大鼠肝组织病理形态学变化的改善更为明显。各组大鼠肝组织病理形态学观察显微图见图1。
4 讨论
非诺贝特是临床上常用于治疗高脂血症的药物,也常作为阳性药物在NAFLD相关研究中使用,故本研究选择非诺贝特作为阳性对照药物。血清中TC、TG、HDL-C、LDL-C、AST、ALT 水平是反映NAFLD 程度最常用的指标[15]。本研究结果显示,以高脂饲料饲养12 周后,模型组大鼠的体质量、肝脏指数均明显升高,肝组织出现炎症细胞浸润,且血清中TC、TG、LDL-C、AST、ALT 水平升高,血清中HDL-C 水平降低,提示建模成功。而非诺贝特组和滇黄芩总黄酮各极性萃取部位组大鼠肝脏指数均显著降低,肝组织病理形态学变化得到一定程度改善,血清中TC、TG、LDL-C、AST、ALT 水平降低,血清中HDL-C 水平升高,并且SAFB 降低模型大鼠血清中TC、TG、AST水平和改善模型大鼠肝组织病理形态学变化的效果比SAF和SAFA更好。
人体内氧化与抗氧化是一个动态平衡的过程,肝组织中的主要抗氧化酶系(包括SOD、GSH-Px 等)能够抑制氧化损伤,是氧化应激中重要的靶点[16]。MDA 是脂质过氧化反应的终产物,也是反映细胞氧化程度、病变进程的重要指标[17]。因此,SOD、GSH-Px 活性及MDA含量通常作为反映机体氧化损伤程度的指标。在NAFLD期间,氧化应激可能促进肝脏脂质堆积、浸润性炎症进展及间质纤维化进展,因此,减轻活性氧诱导的氧化应激、保持肝脏氧化还原稳态,可能是防治NAFLD的有利策略[18]。本研究结果显示,模型组大鼠肝组织中MDA水平升高,SOD、GSH-Px 水平降低;而非诺贝特组与滇黄芩总黄酮各极性萃取部位组大鼠肝组织中MDA水平降低,SOD、GSH-Px 水平升高;并且,SAFB 降低模型大鼠肝组织中MDA水平和升高SOD 水平的作用较SAF和SAFA更优。
氧化应激介导的炎症反应是NAFLD发生的重要病理机制,当氧化应激水平升高后,会促进IL-1β、IL-6、TNF-α等炎症因子的产生,诱导肝损伤[19]。本研究结果显示,模型组大鼠肝组织中IL-1β、IL-6、TNF-α水平显著升高;非诺贝特组与滇黄芩总黄酮各极性萃取部位给药组大鼠肝组织中IL-1β、IL-6、TNF-α水平较模型组显著降低,并且SAFB 组大鼠肝组织中IL-6、TNF-α水平较SAF 组和SAFA组降低得更为明显。该结果表明,滇黄芩总黄酮可减轻NAFLD模型大鼠肝脏的炎症反应,从而缓解NAFLD的病理进程,其中以SAFB的效果更好。
综上所述,滇黄芩总黄酮各极性萃取部位均可通过调控氧化应激、抑制炎症因子的分泌发挥其对NAFLD的改善作用,且以正丁醇萃取部位的效果更好。

