两种凋落叶添加对马尾松土壤酶活性及细菌群落结构的影响
陈惠,孙颖,焦宏哲,司友涛
(福建师范大学 a.地理科学学院, b.湿润亚热带山地生态国家重点实验室培育基地,福州350007)
森林生态系统中底物有机质的元素计量比和生物可利用性,是影响土壤微生物生长和代谢的重要因素[1]。尽管底物的元素计量比多变, 但个体微生物的元素计量比却相对稳定, 此即微生物的内稳性[2]。微生物常采用两种策略来维持个体的内稳性:(1)释放胞外酶来降解有机物,以满足自身对元素的需求[3]。酶活性的大小在一定程度上能反映土壤养分有效性以及微生物对养分的需求程度[4]。(2)通过调节群落结构来适应环境,如生长速率较快的(r策略)微生物由于对养分的需求较高,常呈现低于K-策略微生物的C∶N∶P[5]。因此,微生物群落结构中不同生长策略微生物的比例变化, 可能导致微生物整体元素计量比的变化。底物的生物可利用性则决定了微生物分解底物的优先顺序。在森林生态系统中, 植物残体等新鲜有机质因其化学组成不同,分解速率也不同。易变或可溶性碳化合物如糖、氨基酸的分解速率高于纤维素和木质素[6]。因此, 只有充分考虑底物的元素计量比和可利用性两个方面, 才能准确判断底物与微生物之间的相互作用过程。
亚热带地区由于土壤高度风化,导致磷元素有效性较低[7], 但很少有研究探寻磷元素由植物凋落物向微生物的转移过程。本团队在前期研究中发现, 针叶树种马尾松凋落叶的C∶P高于阔叶树种马褂木凋落叶(2003∶1 vs. 524∶1), 但是马尾松林下土壤的微生物生物量碳∶微生物生物量磷 (MBC∶MBP)却低于马褂木林下土壤(9.3∶1 vs. 16.2∶1)。有研究认为磷矿化与碳耦合性较弱,主要是植物与微生物对磷的需求驱动了磷酸脂酶的产生以及有机磷的矿化[8],但也有一些研究表明磷酸化有机物同时含有碳,磷矿化也可能与碳需求有关,尤其是在碳限制的土壤中[9]。为揭示不同凋落叶对马尾松林下土壤微生物吸收同化碳、磷元素的影响以及碳、磷元素吸收是否存在耦合,将马褂木的凋落叶和马尾松的凋落叶分别加入到马尾松林下土壤中, 进行为期60天的培养试验, 动态监测土壤的养分含量、微生物生物量、酶活性及其计量比, 并用高通量测序技术分析了土壤细菌群落结构的变化,以期为深入了解底物和微生物的关系提供科学依据。
1 材料与方法
1.1 研究区域概况
研究区域位于福建省三明市莘口镇格氏栲自然保护区(26°11′N, 117°28′E),地貌以低丘陵为主, 平均海拔300 m。本区域属于亚热带季风气候, 年平均气温为19.1℃, 年平均降水量 1 749 mm, 年平均蒸发量 1 585 mm, 相对湿度 81%。地带性植被为中亚热带常绿阔叶林, 同时分布有针叶林和针阔混交林, 林下土壤以砂岩发育的酸性红壤为主。2012年2月, 在格氏栲自然保护区内选择立地条件、经营历史相同的一片区域, 在皆伐和炼山之后种植13种中亚热带常见树种的2年生实生苗, 设立“同质园”。同质园采用随机区组设计, 共4个区组(每个区组均含13种树种), 每个区组面积0.1 hm2。
1.2 样品的采集和处理
2019年3月, 分别在同质园内的马尾松(Pinusmassoniana)林和马褂木(LiriodendronChinese)林内按照“S”型布设5个采样点, 采集林内新鲜完整的凋落叶并混匀,每种林分3个重复(来自3个区组)。在实验室内于65 ℃将凋落叶烘干、粉碎, 过0.149 mm筛后分为两部分。一部分保持每个重复(区组)的独立性, 用于养分含量的测定;另一部分则充分混匀, 用于后面的培养试验。同一时间, 在马尾松林内的上述5个取样点去除地表的枯枝落叶, 用土钻采集0~10 cm土壤, 混匀后装入自封袋并立即带回实验室;土壤样品共3个重复(来自3个区组)。在实验室内去除土壤样品中的石砾、动植物残体等杂质, 过2 mm筛后分成两部分, 一部分作为培养前土壤,用于土壤理化性质、微生物生物量、酶活性测试及细菌16S rRNA高通量测序, 另一部分则用于培养试验。
1.3 培养试验
称取相当于100 g干重的马尾松林下土壤于500 mL培养瓶中, 调节土壤含水率为饱和含水率的60%, 用保鲜膜将瓶口密封, 于25℃的恒温培养箱内预培养15天, 以使瓶内土壤条件更加平衡;期间每隔2天补充一次水分, 每次加水前称量培养瓶的质量,从质量损失得知土壤失水率不超过2%。预培养结束后, 参考Rosinger等[10]的方法, 按照每克土添加8 mg植物碳的比例(此添加量目的是突显凋落物的影响), 将烘干粉碎的马尾松凋落叶和马褂木凋落叶分别添加到上述培养瓶中, 使叶片和土壤充分混匀, 保持土壤含水率为60%, 于25℃恒温培养箱内正式培养60天。试验共设2种处理(处理1: 添加马尾松凋落叶的土壤; 处理2: 添加马褂木凋落叶的土壤,由于本实验的主要目的是研究元素从凋落叶向土壤微生物的转移过程,比较添加不同凋落叶对土壤微生物群落结构与代谢的影响,因此未设置裸土对照,添加马尾松凋落叶的马尾松土壤存在于自然条件下,可以视为是另一处理的对照), 每种处理包含3个重复(土壤来自3个不同的区组), 每个重复又包含4个培养瓶(分别用于在第7、15、30、60天进行破坏性取样,测试土壤理化性质、微生物生物量和酶活性,并对第60天培养样品进行细菌16S rRNA高通量测序)。
1.4 土壤理化性质的测定
土壤pH采用CHN868型pH计测定, 水土比为2.5∶1(V∶W)。土壤含水率采用烘干法测定。土壤有机碳(SOC)和土壤总氮(STN)采用碳氮元素分析仪(Elementar Vario EL III, Elementar,German)测定。土壤总磷(STP)用HClO4-H2SO4高温消煮后提取, 并用连续流动分析仪(Skalar San++, Skalar, Netherlands)测定。土壤铵态氮(NH4+-N)和硝态氮(NO3--N)由KCl溶液浸提, 土壤速效磷(Available P)用M3浸提法提取[11], 然后在连续流动分析仪上测定。
1.5 土壤微生物生物量碳(MBC)、磷(MBP)和酶活性的测定
取两份等重量土壤样品, 一份用CHCl3熏蒸,另一份不熏蒸, 随后用0.5 mol·L-1的K2SO4溶液浸提样品中的有机碳[12]。MBC=(CF-CNF)/KEC,式中CF代表K2SO4溶液浸提熏蒸样品后的有机碳浓度, CNF代表K2SO4溶液浸提未熏蒸样品后的有机碳浓度, KEC是浸提系数, 取值0.45。MBP则采用CHCl3熏蒸-NaHCO3浸提法测定[13]。MBP=(PF-PNF)/KP,式中PF代表NaHCO3溶液浸提熏蒸样品的磷浓度, PNF代表NaHCO3溶液浸提未熏蒸样品的磷浓度, KP是浸提系数, 取值0.4。
本研究主要关注碳循环相关的两种土壤酶βG (β-1,4-glucosidase)和CBH (Cellobiohydrolase), 以及磷循环相关的酶ACP (Acid Phosphomonoesterase)。其中测定βG时所用底物是4-甲基伞形酮-β-D-葡萄糖苷, CBH的底物是4-甲基伞形酮-β-D-纤维素二糖苷, ACP的底物是4-甲基伞形酮-磷酸酯。用多功能酶标仪(SpetraMax M5, Molecular Devices, Sunnyvale, USA)测定荧光度来确定酶活性[14]。
1.6 细菌 16S rRNA 基因测序及生物信息学分析
使用OMEGA M5635-02 Soil DNA Kit试剂盒提取土壤DNA,NanoDrop NC-2000分光光度计(Thermo Scientific, Wilmington, DE, 美国)测定DNA的质量,利用1.2%琼脂糖凝胶电泳检测DNA提取质量,使用引物338F(5′-ACTCCTACGGGAGGCAGCA-3′)和806R(5′GGACTACHVGGGTWTCTAAT-3′)对细菌V3-V4高变域进行PCR扩增。PCR反应体系为25 μL,反应条件为:98℃预变性2 min,98 ℃变性15 s,55℃复性30 s,72℃延伸30 s,共25个循环;72℃延伸5 min,反应结束,产物混匀后通过2.0%的琼脂糖凝胶电泳检测。扩增完毕后采用Illumina公司的TruSeq Nano DNA LT Library Prep Kit制备测序文库,采用Illumina NovaSeq平台对DNA片段进行双端(Paired-end)测序。对比 Silva (Release119, http://www.arb-silva.de) 16S rRNA数据库,采用 RDP Classifier( http://rdp.Cme.msu.edu/) 贝叶斯算法对 97%相似水平的 OTU 代表序列进行分类学分析,并在各个分类水平上统计每个样品的群落组成。土壤微生物总DNA提取和测序服务委托上海派森诺生物科技有限公司完成。
1.7 数据处理
在SPSS 20.0软件中, 采用独立样本t检验比较同一时间点的土壤微生物量、有效磷含量、酶活性等指标在不同处理之间的差异显著性(a=0.05)。酶活性与MBC的比值被当作酶效率[15]。以处理为组间因素(含两个水平), 以培养时间为组内因素(含第7、15、30、60天4个水平), 进行重复测量方差分析, 以检验凋落叶类型、时间及其交互作用对微生物量、酶活性、酶效率、酶计量比等指标的影响。主成分分析(PCA)及冗余分析(RDA)由Canoco 5.12来实现, 分析结果采用二型标尺绘图以展示变量之间的相关性[16]。其余图用OriginPro 9.0绘制。
2 结果
2.1 土壤基本理化性质,微生物生物量碳、磷含量, 酶活性以及凋落叶元素含量
用于培养试验的马尾松林下土壤为酸性红壤(pH=4.4±0.1, 平均值±标准误,n=3), 野外原位含水率为33.1±2.0%。土壤铵态氮、硝态氮、有效磷含量分别为33.16±1.89、4.34±1.13、2.43±0.36 (mg·kg-1, 平均值±标准误,n=3),土壤碳、氮、磷含量较低(表1)。本研究所添加的两种凋落叶的元素含量明显不同, 马尾松凋落叶的碳含量显著高于马褂木凋落叶, 而氮、磷含量则显著低于马褂木凋落叶,因此马尾松凋落叶的C∶N和C∶P均显著高于马褂木凋落叶(表1)。

表1 培养试验所添加的两种凋落叶的元素含量及其计量比Table 1 Element contents and stoichiometry of leaf litters and soils used in the incubation experiments
2.2 培养过程中土壤微生物生物量碳、磷及其计量比的变化
由图1可见, 在60天培养期内, T1土壤MBC在第15天出现大幅上升,之后在第30天、60天逐渐回落,呈现先上升后下降的趋势, T2土壤MBC在第7天即迅速上升,第15天回落,第30天再次上升,第60天又回落,呈先上升后下降、然后再次上升下降的模式。在第15天, T1的MBC显著高于T2, 其余3个时间点T1的MBC显著低于T2。在每个取样时间点两种处理的土壤MBP并无显著差异(图1)。重复测量方差分析显示,培养时间对MBC和MBP均有显著影响,但是处理仅对MBC有显著影响, 对MBP没有显著影响(表3)。两种处理的MBC∶MBP随时间的变化模式与MBC的变化模式相似(图1)。培养时间对MBC∶MBP有显著影响, 第7天和15天的MBC∶MBP显著高于其他时间点,但处理对MBC∶MBP无显著影响(表3)。
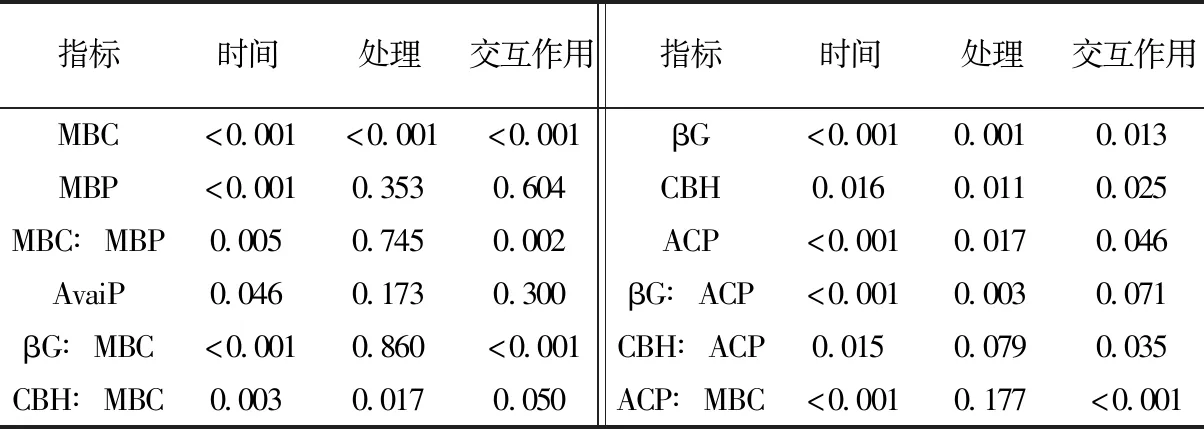
表3 土壤微生物量、有效磷和酶活性随时间变化的重复测量方差分析Table 3 Repeated measures ANOVA of changes in soil microbial biomass,available P and enzyme activities with time
2.3 培养过程中土壤酶活性的变化
培养过程中T1的土壤酶活性整体上要低于T2(图2)。在培养的前30天, T2的土壤βG活性始终显著高于T1。在培养的第7、30和60天, T2的土壤CBH活性显著高于T1。两种处理的ACP活性在凋落叶添加后的第7天最高, 接下来在第30天呈现明显的下降后在第60天重新回升。重复测量方差分析显示, 处理对βG、CBH、ACP均有显著影响, 但是对βG∶MBC和ACP∶MBC这两种酶效率没有显著影响(表3)。
2.4 微生物元素计量比、酶效率、酶计量比之间的冗余分析
以酶效率、单位质量的MBC所拥有的有效磷(AvaiP∶MBC)和单位质量的MBP所拥有的有效磷(AvaiP∶MBP)为解释变量, 以MBC∶MBP、βG∶ACP和CBH∶ACP为响应变量,进行冗余分析, 发现5个解释变量的贡献都达到极显著水平(P<0.01)。如图3所示, 酶计量比对第一轴的贡献率较大, 而微生物的元素计量比对第二轴的贡献率较大。前两个主轴共解释了MBC∶MBP、βG∶ACP和CBH∶ACP变异的81.08%、71.13%和82.00%。βG∶MBC与CBH∶MBC (r=0.50,P=0.04)、ACP∶MBC(r=0.63,P<0.001)之间是显著正相关关系。ACP的酶效率和AvaiP∶MBC之间是极显著正相关关系(r=0.80,P<0.001)。MBC∶MBP与βG∶ACP (r=-0.39,P=0.03)、βG∶MBC (r=-0.39,P=0.03)之间呈显著负相关关系, MBC∶MBP与AvaiP∶MBP呈显著正相关关系(r=0.66,P<0.001)。
2.5 细菌群落丰度和结构差异
图4为属水平上的细菌分类。将平均丰度低于1.5%的部分合并为其他,部分细菌属于分类学数据库分类学谱系的中间等级,没有科学名称,以norank表示,部分属于未培养细菌,以uncultured 表示。在第0天土壤中,酸杆菌科中一种未培养属细菌相对丰度最高(11.3%),培养第60天的T1土壤中该属细菌相对丰度也最高(7.2%),但其比例有所下降。而培养第60天的T2土壤中相对丰度最高的是Burkholderia-Caballeronia-Paraburkholderia属细菌(变形菌门),相对丰度为11.3%。以细菌群落属水平数据进行主成分分析,第0天和培养60天后的T1和T2土壤明显分开,表明细菌群落结构发生了变化。第一主成分(PC1)解释了细菌群落变化的52.95%,第二主成分(PC2)解释了细菌群落变化的24.43%,两个主成分共解释了77.38%的变异。与T2相关性较强的是变形菌门伯克氏菌科Burkholderia-Caballeronia-Paraburkholderia属细菌以及放线菌门的热酸菌属。与第0天土壤相关性较强的是放线菌门的链霉菌属。
3 讨论
已有的研究大多从温室气体排放的角度去研究凋落物添加对土壤微生物生物量、CO2排放的影响[17], 很少有研究关注凋落物添加后土壤微生物元素计量比和酶计量比(尤其是C∶P)的变化。本研究将马尾松凋落叶和马褂木凋落叶添加到马尾松林下土壤中, 以检验底物的碳、磷含量对土壤MBC、MBP和相关酶活性的影响。
3.1 凋落物添加对土壤MBC、MBP的影响
在凋落叶添加后的15天之内, 两种处理的土壤MBC均达到了峰值,这是因为土壤微生物会优先利用凋落叶中的新鲜有机质, 并迅速增加土壤的微生物量[18]。Shahbaz等[17]将小麦的叶、茎、根的残体输入到土壤中, 发现在前15天内MBC迅速增加, 增加比例最高可达85%, 且增加的MBC主要来自新鲜有机质。碳元素既是提供能量的元素, 也是微生物体内含量最多的元素, 因此是微生物需求量最大的元素。Göransson等[19]发现, 冰川覆盖消退后最能限制土壤细菌生长的元素是碳元素。Rosinger等[10]的研究也指出, 在草地和森林的底层土壤中, 碳元素是限制微生物生长和呼吸的主要元素。本研究所用的土壤采自造林仅7年的马尾松林下土壤, 与成熟的马尾松林相比[20], 其SOC (15.81 vs.25.16 g C·kg-1soil)和MBC (257.30 vs.385.74 mg MBC·kg-1soil)含量较低, 因此土壤微生物更加处于碳限制的状态, 对凋落叶添加的响应更敏感。两种处理的MBC在到达峰值后随即下降(图1), 这一现象与已有的研究相似, 这标志着15天之后凋落叶中的易利用碳已被消耗完毕, 同时微生物分解SOM的比重开始加大[21]。
然而, 尽管两种处理所添加的碳的数量是一样的(均为8 mg C·g-1soil), 但T2的土壤MBC显著高于T1(图1, 表3), 这说明底物有机质所含碳的数量, 并不是决定土壤MBC的唯一因素。马褂木凋落叶添加后土壤的βG和CBH酶活性总体上要高于添加马尾松凋落叶的土壤(图2, 表3), 由于这两种酶都是用于分解易利用碳的水解酶[4], 所以这表明马褂木凋落叶比马尾松凋落叶含有更多的易被微生物利用的碳元素。相对于总碳, 底物中的易利用碳的数量是决定MBC的更准确的指标。这与Fontaine等[22]的研究结论一致, 他们发现向土壤中添加葡萄糖等易利用碳后, 土壤微生物量会迅速增加。另外, 添加马尾松凋落叶的土壤MBC含量直到第15天与对照土壤相比才有明显的升高, 而添加马褂木凋落叶的土壤MBC在第7天即有明显的升高, 也证明了马褂木凋落叶所含的易利用碳较多, 更有利于微生物的繁殖生长[23]。Zhang等[24]发现, 由于针叶树种落叶松(Larixgmelinii)的凋落叶的木质素∶N高于阔叶树种蒙古栎(Quercusmongolica)的凋落叶, 故前者的分解速率小于后者, 不利于微生物吸收。
MBP对底物变化的响应似乎没有MBC敏感, 这表现在: (1)在培养试验的前15天, 两种处理的MBC即达到了峰值, 然而直到第30天两种处理的土壤MBP相比对照土壤才有明显的变化(图1)。(2)尽管两种凋落叶中的磷含量不同, 但是两种处理的MBP没有显著差异(表2)。

表2 马尾松林下土壤微生物生物量碳、磷含量及酶活性Table 2 Soil MBC, MBP and enzyme activities before litters addition
MBC∶MBP随时间的变化模式与MBC的变化模式相似(图1),这主要源自于MBC对底物添加更加敏感。时间对MBC∶MBP 有显著影响(表3), 这可能是由土壤微生物群落结构的变化引起的。培养结束后,T2的MBC∶MBP要显著高于T1(图1),说明尽管马尾松凋落叶的C∶P显著高于马褂木凋落叶, 但试验结束时添加马尾松凋落叶的土壤MBC∶MBP反而低于添加马褂木凋落叶的土壤,这主要还是因为马褂木凋落叶中易利用碳较多, T2的MBC含量较高,这与本研究在野外原位条件下测得的马褂木林下土壤的MBC∶MBP高于马尾松林下土壤的趋势相一致。
3.2 凋落物添加对土壤ACP酶活性的影响
两种处理间的酸性磷酸单酯酶(ACP)的活性有显著差异(表3)。微生物分泌胞外酶是为了获取相应的养分, 因此酶活性与有效性养分浓度之间常呈负相关关系[4], 这可能是终产物的反馈抑制,也可能是因为酶合成耗能急需N,微生物只在可利用养分缺乏时才以牺牲生长及代谢为代价来合成酶。当土壤中养分可利用性较高, 微生物获取这种营养物质难度较小, 相关催化酶的活性也会降低。然而, 本研究却发现酸性磷酸单酯酶的酶效率(ACP∶MBC)和AvaiP∶MBC之间是显著正相关关系(图3), 这说明微生物分泌ACP不完全是为了获取有效磷。二者之间的正相关关系可能与碳获取有关。Spohn和Kuzyakov[9]通过室内培养试验发现, 对于磷含量较高的有机质, 土壤微生物常把其中的有机磷分子当做碳源, 而微生物为了获取其中的碳元素, 必须要分泌一些磷酸酶来断开磷酯键以将底物中“多余的”磷脱离下来。如此一来, ACP活性较高的土壤,其有效磷含量可能也较高。这些“多余的”磷元素将为植物生长提供养分, 因此植物和微生物之间才形成了互惠互利的关系。Wang等[25]对青藏高原海螺沟的土壤进行研究也发现, 微生物在矿化有机碳的同时会将多余的磷酸根释放出来, 导致有效磷的积累。本研究中, ACP活性的最大值出现在凋落叶添加后的第7天, 此时正是MBC的升高期,而MBP变化不明显,直到第30天才有明显升高, 这也表明此时较高的ACP活性并非为了获取磷,很可能就是为了辅助获取新进凋落叶中的碳。
3.3 凋落物添加对土壤细菌群落结构的影响
对细菌16S rRNA高通量测序得到的属水平分类的主成分分析中第0天和培养60天后的T1和T2土壤明显分开,表明细菌群落结构发生了变化,培养第60天的T2土壤与第0天土壤及培养第60天的T1土壤沿PC1轴分开,而培养第60天的T1土壤与第0天的土壤沿PC2轴分开,说明T2土壤较T1土壤的细菌群落发生了更大的改变。培养第60天的T2土壤变形菌丰度为优势类群。研究表明大多数变形菌是嗜营养菌,添加易利用碳能促使其快速生长繁殖,并分泌βG酶来分解易利用碳[26],这与T2的MBC含量以及βG高于T1一致,而酸杆菌通常被认为是寡营养菌,可分解难分解的碳源[41]。在本研究中,第0天土壤和培养第60天的T1土壤酸杆菌是丰度最高的优势类群,表明这两种土壤的易利用碳含量较少。
3.4 微生物元素计量比和酶计量比的关系
探寻微生物元素计量比和酶计量比的关系, 可以更深入地揭示酶活性与微生物的养分需求之间的关系。本研究中, MBC∶MBP与βG∶MBC呈显著负相关关系, 即MBC∶MBP较低时单位质量的微生物所分泌的βG会更多一些, 以获取更多的碳。MBC∶MBP与βG∶ACP也呈显著负相关,即MBC∶MBP较低时, βG的相对活性就会升高。所以酶计量比能够准确地反映微生物对不同元素的需求状况。冗余分析中, AvaiP∶MBP是对MBC∶MBP解释率最高的因子, 且二者是正相关关系(图3), 这说明微生物在获取碳的同时会产生较多的有效磷, 这些有效磷并非全部被微生物所吸收而转化为MBP, 才使得AvaiP∶MBP也升高,这与前述的微生物分泌ACP是为了辅助碳获取的结论相吻合。AvaiP∶MBP与MBC∶MBP之间的正相关关系, 以及βG的酶效率与CBH、ACP的酶效率之间呈显著正相关关系(图3), 都说明了获取碳和磷的两类酶之间的协同性以及碳磷循环的耦合性。
4 结论
凋落叶添加后的前15天显著提高了土壤MBC的含量,随着凋落叶中易利用碳的耗竭, MBC的含量随即下降。由于马褂木凋落叶含有的易利用碳多于马尾松凋落叶, 添加马褂木凋落叶的土壤MBC、βG和CBH活性均显著高于添加马尾松凋落叶的土壤。两种处理的MBP没有显著差异, 但是两种处理的酸性磷酸单酯酶的活性有显著差异, 加之ACP的酶效率与AvaiP∶MBC正相关, 这些现象都表明微生物分泌ACP不单单是为了获取有效磷, 很可能也是为了辅助获取碳元素。时间对MBC∶MBP有显著影响, 培养初期的比值大于后期, 这种变化可能来自于微生物群落结构的变化。高通量测序表明细菌群落结构发生了明显改变,添加马褂木凋落叶的土壤嗜营养变形菌含量增加,成为优势类群。MBC∶MBP与βG∶ACP、βG∶MBC之间的负相关关系, 以及MBC∶MBP与AvaiP∶MBP之间的正相关关系, 则说明酶计量比能够准确地反应微生物对不同元素的需求状况以及碳磷循环具有高度的耦合性。

