我国眼科新药临床试验发展趋势分析
廖瑞莲,梁小红,张秀兰,陈翔
(中山大学中山眼科中心,眼科学国家重点实验室,广东省眼科视觉科学重点实验室,广东省眼部疾病临床医学研究中心,广州 510060)
近年来随着人口老龄化、电子产品的普及导致用眼方式的改变,眼部感染、干眼、青光眼、黄斑变性、糖尿病视网膜病变等眼部疾病发病率持续升高[1]。眼科作为医学专业大体系里的一个小分支,行业内有“金眼科、银外科”一说法,表明这一领域具有巨大的市场价值[2]。但其大部分眼科诊疗还在使用国外指南,原创性新疗法匮乏,更缺乏具有自主知识产权的眼科药物、耗材及设备。国产眼科药物处于初级阶段,仍然以进口药物为主[3-5]。
自国务院2015年8月发布《国务院关于改革药品医疗器械审评审批制度的意见》[6]和2017年10月发布《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》[7]以来,我国政府陆续出台一系列利好政策,以加快药品上市审评审批,促进了药品创新和仿制药发展[8]。因此自2015年以来,我国临床试验迅速发展。同时进入21世纪,随着世界信息化快速发展、人口老龄化加剧、医学诊断能力显著提升等多因素共同作用下,眼部疾病发生率大幅提高,国内制药企业纷纷看中眼科领域“小产品、大市场”的市场潜力,布局眼科领域,研发眼科药物。眼科药物除传统的糖皮质激素、抗感染、抗青光眼药物外,眼用抑制新生血管药、人工泪液、抗变态反应药等不断有新品种、改良剂型或者特型包装上市[9-10]。
为了全面了解我国眼科药物临床试验开展情况,我们基于国家药品监督管理局药物临床试验登记与公示平台登记数据库,汇总和分析了我国2015—2020年的眼科注册类药物临床试验情况,旨在为我国眼科药物的研发和临床研究提供最新数据参考,为相关决策提供依据。
1 资料与方法
1.1 资料的来源和提取
自国家药品监督管理局药物临床试验登记与信息公示平台(http://www.chinadrugtrials.org.cn/)登记数据库提取眼科药物临床试验和相关试验药物信息。根据数据公示日期,在2015年1月1日至2020年12月31日的全部9 869项药物临床试验,根据适应证逐条判断是否属于眼科临床试验。由两位医学背景人员独立进行人工复核,两位人员均从事眼科工作,对于眼科药物和适应证熟悉,复核后两人结果进行核对,如出现结果不一致,由第三方进行复核。为保证不遗漏眼科药物临床试验,从初筛排除的数据库中随机抽取20%的临床试验,再由两位工作人员进行核实[8]。
从最终选定的眼科药物临床试验登记信息中提取资料。1)基本信息:题目、申办者、主要研究者、各参加机构、公示日期等;2)试验管理信息:伦理审批、首例入组时间、试验终止日期、试验状态、数据安全监察委员会、是否应该购买受试者保险等;3)试验科学信息:目的、试验药物、适应证、试验设计(包括试验分期、设计类型、随机化、盲法和试验范围)、受试者入组和剔除标准、评价终点指标等。
1.2 数据处理
对研究变量进行整理和赋值,具体包括年度眼科药物临床试验项目数量(2015年、2016年、2017年、2018年、2019年、2020年)、申办方类型(国内制药企业、外资制药企业)、试验范围(国内试验、国际试验)、试验分期(I期、II期、III期、IV期、其他)、试验组长单位、主要研究者、申办方、疾病分类(眼底病、眼表病、青光眼、其他)、适应症、药物类型(化学药物、生物制品、中药/天然药物)、试验药物注册分类。
1.3 统计学处理
本文采用频数(百分比)方法来描述眼科药物临床试验情况。
2 结果
2.1 眼科药物临床试验数量及分期
2015年1月1日至2020年12月31日国家药品监督管理总局药物临床试验登记与信息公示平台共登记药物临床试验9 839项(2021年5月20日查询的数据),其中眼科临床试验98项,占同期全部药物临床试验的1.00%,以国内试验居多,占89.80%(表1)。
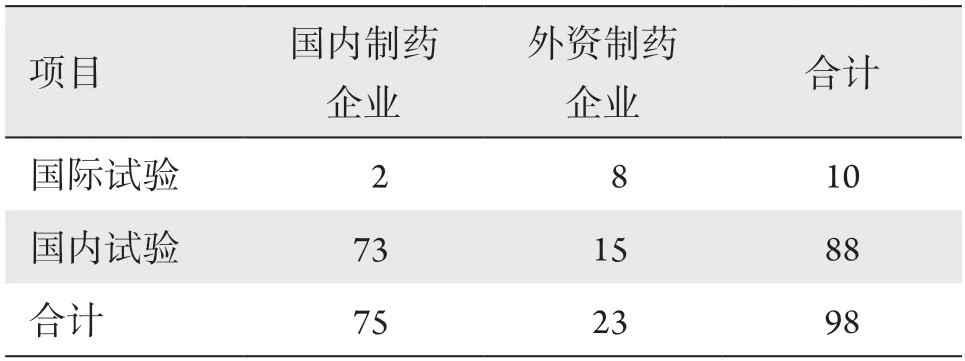
表1 2015—2020年国内和外资制药企业发起的眼科药物临床试验分布Table 1 Summary of ophthalmic drug clinical trials (2015—2020) conducted by domestic and foreign pharmaceutical enterprises
数据显示,2015—2020年期间,眼科药物临床试验开展数量最多的是I期临床研究,占总分期的35.71%,其次是III期临床研究,占30.61%,IV期临床研究最少,仅占5.10%(表2)。
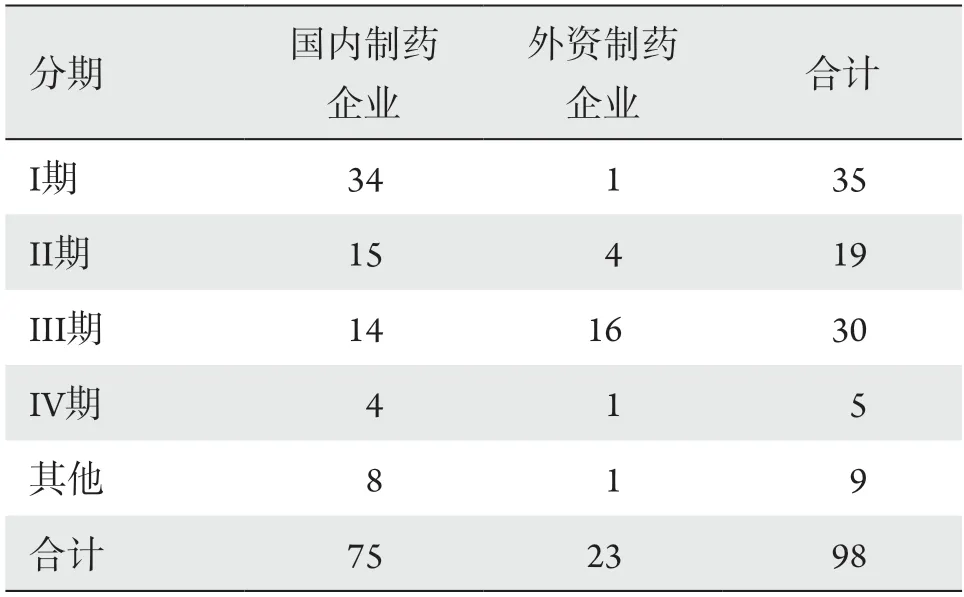
表2 2015—2020年国内和外资制药企业发起的眼科药物临床试验分期Table 2 Summary of ophthalmic drug clinical trials(2015—2020) by stage conducted by domestic and foreign pharmaceutical enterprises
2015—2020年期间,每年眼科药物临床试验数量逐步上升,6年内由7.1%上升至28.6%,以2018—2019年间增长最快,新增11项,整体与药物临床试验发展趋势一致(图1)。
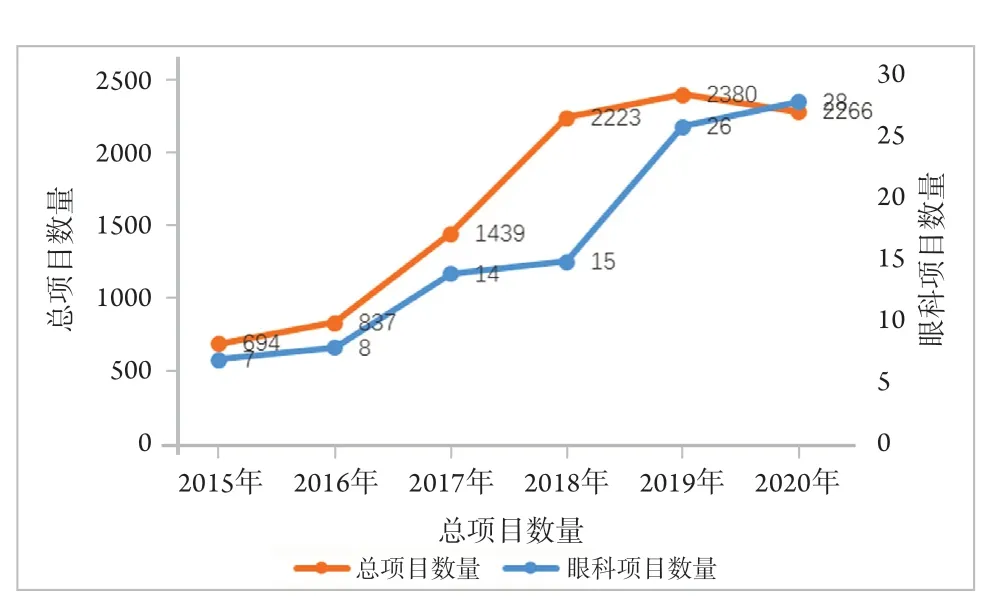
图1 2015—2020年药物临床试验分布图Figure 1 Number of drug clinical trials (2015—2020)
2.2 眼科临床试验牵头单位与申办方情况
98项眼科药物临床试验共涉及22家牵头单位和34位主要研究者,牵头单位前5名的项目总数占眼科药物临床试验总数的67.35%(表3),牵头临床试验数量、项目发起人排名情况见表4。
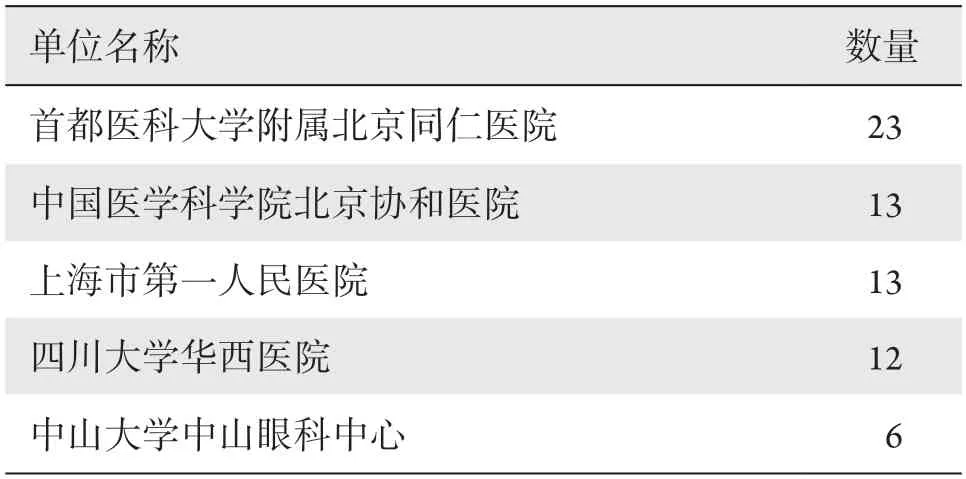
表3 2015—2020年眼科药物临床试验牵头单位情况Table 3 Lead units of ophthalmic drug clinical trials (2015—2020)
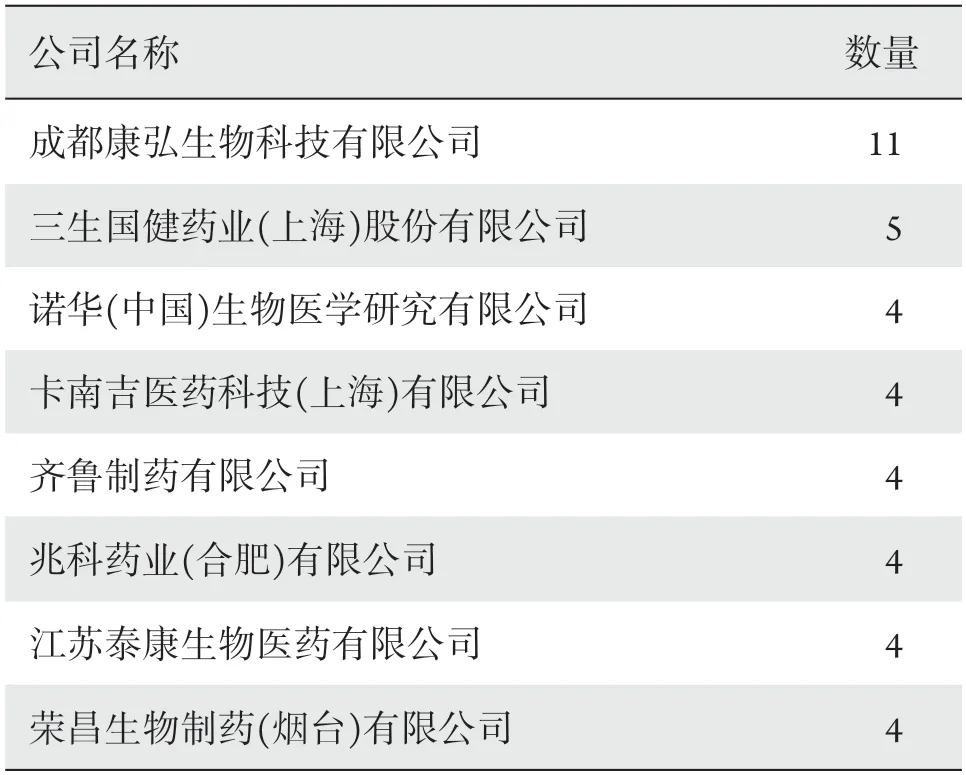
表4 2015—2020年眼科药物临床试验申办方情况Table 4 Sponsor of ophthalmic drug clinical trials (2015—2020)
2.3 眼科药物临床试验所涉及的疾病和适应证
统计后发现:青光眼、眼底病、眼表病3个领域的眼科临床试验占较大比例,具体分布情况见图2。
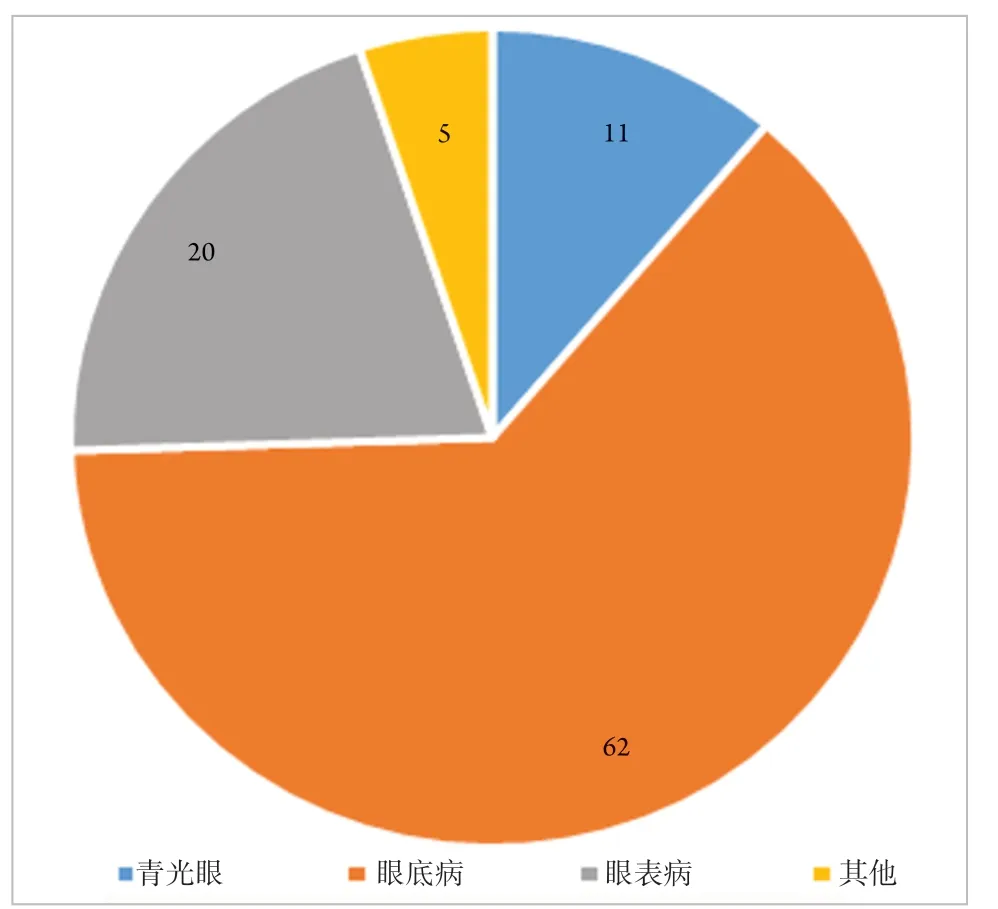
图2 2015—2020年眼科药物临床试验所属疾病分布图Figure 2 Indications map of ophthalmic drug clinical trials(2015—2020)
2.4 眼科药物临床试验所涉及的药物类型
98项眼科临床试验项目可分为化学药物、生物制品、中药/天然药物3种类型,具体分布情况见图3。
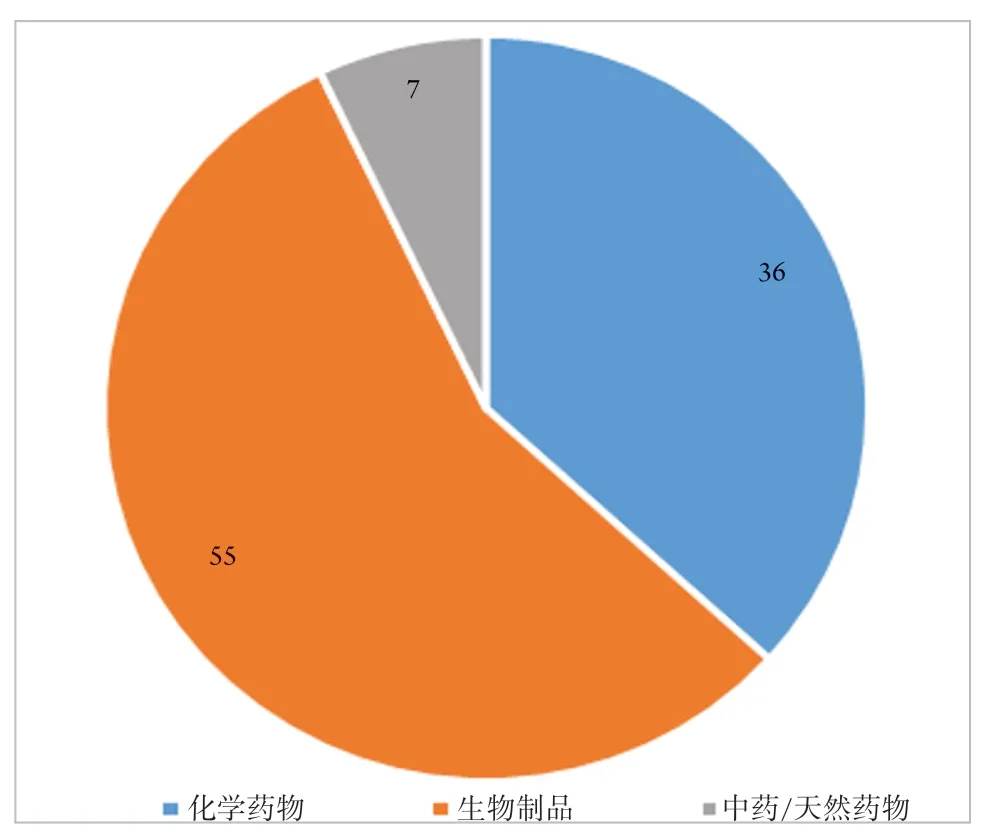
图3 2015—2020年眼科药物临床试验药物类型图Figure 3 Drug types map of ophthalmic drug clinical trials(2015—2020)
本研究统计显示:98项眼科药物临床试验项目共涉及54个药物,其中创新药18个(33.33%)和仿制药36个(66.67%)。创新药中包括外资制药企业研发5个(27.78%)和国内制药企业研发13个(72.22%);仿制药中包括外资制药企业10个(27.78%),国内制药企业26个(72.22%;图4)。
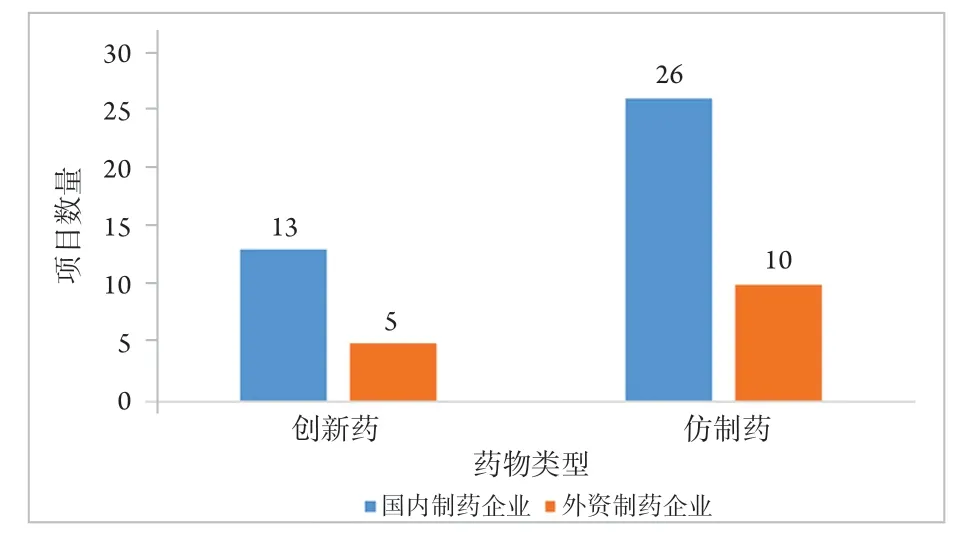
图4 2015—2020年眼科药物临床试验涉及创新药和仿制药情况Figure 4 Innovative and generic drugs map of ophthalmic drug clinical trials (2015—2020)
3 讨论
本研究结果显示:2015—2020年在国家药品监督管理总局药物临床试验登记与信息公示平台登记的眼科药物临床试验共98项,登记的临床试验数量逐年增加。药物研发以眼底疾病、青光眼和眼表疾病3种类型为主,其中眼底疾病已成为各厂家研发的第一选择。药物类型以生物制品和化学药物为主,其中生物制品已成为眼科药物研发的主流。临床试验发起人方面,随着近年中国医药事业的快速发展,国内制药企业的研发能力逐渐提高,无论是在临床试验总数量,还是创新药数量上,都远远超过外资制药企业。国内制药企业已成为眼科药物研发的中坚力量。牵头单位方面,当前临床试验多集中在北上广地区,区域发展不平衡。
近几年随着雷珠单抗、阿柏西普、康柏西普等抗血管内皮生长因子(vascular endothelial growth factor,VEGF)药物的相继上市,效果显著,为眼底疾病的治疗带来了希望。外资制药企业和国内企业纷纷瞄准该类疾病的治疗需求,引来了该类型药物的研发浪潮。在实际的临床诊治过程中,眼内新生血管的形成是多种眼部疾病的共同病理改变,抗VEGF并非血管增生的唯一发病机制,除此之外血小板衍生生长因子(platelet-derived growth factor,PDGF)和血管生成素(angiopoietin,Angs)等都被证明与血管的生成相关。目前针对血管新生分子机制如血小板生长因子(platelet growth factor,PGF)、胎盘生长因子(placental growth factor,PIGF)、血管生成素2(angiopoietin-2,Ang2)等都是研究的热点,以期通过多靶点共同调控达到更佳的治疗目的,其次玻璃体内注射抗VEGF具有较大危险性、患者较为排斥、依从性差,因此降低抗VEGF注射的风险与周期、或开发口服用药和滴眼剂,也将成为此类药物的主要发展方向。双特异性抗体的研发是当前研究热点之一,将成熟的抗VEGF与抗致病补体激活相结合,有望成为多种炎症相关眼底病治疗的新方案[9-11]。在青光眼领域,青光眼作为一种常见的眼科疾病,临床中治疗以控制眼压,以阻碍青光眼视神经损伤的进展。但眼压升高仅是青光眼的一个体征,降低眼压并不能解决青光眼发病机制的问题,降低眼压后仍然存在未知因素影响青光眼的发生发展。近几年研发从控制房水流出通路、青光眼性视神经损伤、青光眼的遗传学及药物基因组学、青光眼的新治疗靶点、新的给药系统、复方制剂等方面作为突破点,寻找更佳的治疗方法,延缓视神经损伤速度,减低致盲率,从而改善患者生活质量[12]。在眼表病领域,随着社会的快速发展,电子产品的普及,软性角膜接触镜在年轻人中的流行等因素,干眼的发病率逐年上升,并趋于年轻化。干眼的病因较为复杂,是一种难治愈且易复发的慢性疾病[13],目前研发主要从治疗泪液分泌不足、抑制眼表炎症、恢复眼表损伤、手术治疗4个方面着手,改善干眼患者的生活质量。去年环孢素滴眼液(II)在中国上市,为干眼患者,甚至于中重度干眼患者、免疫相关干眼患者带来治疗新选择。在近视防控领域,目前常用的控制近视增长方法包括光学干预、药物控制及环境干预。研究显示0.01%阿托品滴眼液可以有效的控制儿童及青少年近视的增长,但临床工作中对0.01%阿托品的给药方式尚无定论[14]。目前多个阿托品治疗儿童近视的临床试验项目正在进行中,有望为近视治疗带来新的希望。
实际上,在中国眼科药物市场上,外企凭借雄厚的技术实力和强大的品牌推广度一直牢牢占据着眼科医院市场的龙头地位,包括日本参天、瑞士诺华、美国爱尔康等外资制药企业都在持续加码国内眼科药物市场,以罗氏、诺华为代表的外资制药企业,近年来研发出新一代的抗VEGF药,凭借充足的资金、雄厚的技术实力和专业的团队全方面开展临床试验,以期望在将来眼科市场占得先机[15]。
但近年来伴随着国内医药政策的改变,国内制药企业也在快速崛起,通过加大研发或引进新药等方式来提升市场竞争力,在眼科市场中分一杯羹。以康弘药业为代表的国内制药企业,其自主研发的一类新药“康柏西普眼用注射液”,于2013年11月获得批准上市,凭借良好的疗效迅速抢占市场,同时在国外开展临床试验,申请在国外上市,实现国内市场打破国际产品的垄断。
与国内制药企业不同,外资制药企业发起的眼科临床试验以III期为主,占69.57%,这是大多数外资制药企业研发策略所致的直接结果,先在当地完成小样本探索研究后再进入中国市场开展大样本确证研究。
眼科药物临床试验的布局正在慢慢变更,既有像康弘为代表的融入国际药物市场,也有向诺华为代表的逐渐将中国纳入国际市场中。在政府的大力支持下,我国的临床试验生态系统逐步完善,临床试验的承接能力和质量水平逐步提高,国内制药企业的竞争性布局正在形成,我们相信,会有更多全球制药企业将中国市场作为重要的发展战略,并将中国纳入其全球发展体系中去[8]。
药物类型方面:生物制品的占比已超过一半,眼科治疗用药市场最大的抗感染药、抗炎药已逐渐饱和,企业纷纷转向其他领域药物的研发。自2013年康柏西普上市,以其效果和价格优势迅速占领市场,国内眼底疾病的需求被释放,同时在法规改革、人口老龄化以及发病率不断提高等多方面因素推动下,生物制品引来了快速发展期。目前眼科临床试验的药物仍以仿制药为主,但创新药和仿制药的比例不再是一边倒,随着《国务院办公厅关于印发国家组织药品集中采购和使用试点方案的通知》发布,“4+7带量采购”政策下使得市场格局发生较大变化,仿制药不再成为国内制药自取的发展战略[15]。
牵头单位方面:基本都分布在北上广的一线城市,这体现出眼科药物研发的不平衡,不仅仅是地区间的不平衡,还包括大、小医院之间的不平衡,城市中心、郊区之间的不平衡。眼科的建设和发展还需要很长的路要走,希望能够在未来的日子中借助于政府、医疗机构、眼科专家等各方的力量,共同推进眼科药物研发的均衡发展。
试验分期分面:I期和III期占比最高,两者相加的数量占项目总数的66.33%,I期是创新药物走向上市的必经之路,而III期是药物走向上市的最近之路,两者分别代表着药物的创新性和有效性、安全性,这说明在眼科领域新药的研发十分火热,不断涌现出新药,同时临床试验达到预期目标的比例高,最终药物成功上市的概率大大提升。
最后,本研究存在一定的局限性。首先,受限于数据库登记信息的有限性与准确性,仅纳入了在国家药品监督管理总局药物临床试验登记与信息公示平台登记的眼科临床试验,未纳入尚未登记的药物临床试验和研究者发起的临床研究。其次本研究提取的临床试验数据,未能全面反映这期间的眼科临床试验全貌。最后,由于临床试验登记具有滞后性,而本次统计基于公示日期,与实际项目开展情况有所不同。
我国眼科药物临床试验在近几年取得了长足的进步,本土制药企业已成为我国药物研发的中坚力量,以抗VEGF为代表的大量药物正处于临床研发阶段或正进入临床,不久的将来将为眼底疾病治疗带来更多的选择。但是也应看到创新药全部是抗VEGF药物,在其他领域未见新药;在国际多中心临床试验领域,外资制药企业仍占主导,我们期待国内制药企业应当进一步提高创新和研发能力。
开放获取声明
本文适用于知识共享许可协议(Creative Commons),允许第三方用户按照署名(BY)-非商业性使用(NC)-禁止演绎(ND)(CC BY-NC-ND)的方式共享,即允许第三方对本刊发表的文章进行复制、发行、展览、表演、放映、广播或通过信息网络向公众传播,但在这些过程中必须保留作者署名、仅限于非商业性目的、不得进行演绎创作。详情请访问:https://creativecommons.org/licenses/by-ncnd/4.0/。

