水解驴胎盘提取物对UV诱导皮肤细胞损伤的保护作用
廖峰 樊雨梅 唐洁 刘苓 熊丽丹


摘要 [目的]探究水解驢胎盘提取物防护光损伤的效果与作用机制,旨在填补水解驴胎盘提取物在防护UV光损伤方面的研究空白,实现驴胎盘的高值化利用。[方法]采用CCK-8方法探究水解驴胎盘提取物对HS68和HaCaT细胞增殖率的影响,利用UVA和UVB分别诱导HS68和HaCaT细胞建立体外光损伤模型,研究水解驴胎盘提取物对UV损伤HS68和HaCaT细胞的保护作用。[结果]0.10%~10.00%(V/V)的水解驴胎盘提取物可显著促进HS68和HaCaT细胞生长;1.00%和0.50%(V/V)水解驴胎盘提取物可显著减弱UVB对HaCaT细胞的损伤,显著减少细胞内ROS的产生和MDA的分泌,显著增加细胞内SOD活性;1.00%(V/V)水解驴胎盘提取物可显著降低UVA辐射HS68细胞造成的MMP-1、MMP-3和MMP-9 mRNA表达上升,但不能改善COL Ⅰ和COL Ⅲ mRNA表达的减少。[结论]水解驴胎盘提取物能够防护UVA和UVB造成的皮肤光损伤,可能与提高抗氧化酶活性、降低脂质过氧化程度、抑制金属蛋白酶的异常分泌有关。
关键词 水解驴胎盘提取物;UVA;UVB;皮肤细胞;抗光损伤;保护作用
中图分类号 S 879.9 文献标识码 A
文章编号 0517-6611(2022)12-0153-05
doi:10.3969/j.issn.0517-6611.2022.12.039
开放科学(资源服务)标识码(OSID):
Protective Effects of Hydrolyzed Donkey Placenta Extract on UV-induced Skin Cells Damage
LIAO Feng1,FAN Yu-mei1,TANG Jie2,3 et al
(1.National Engineering Research Center for Gelatin-based Traditional Chinese Medicine,Dong-E-E-Jiao Co.,Ltd.,Liaocheng,Shandong 252201;2.Cosmetics Safety and Efficacy Evaluation Center,West China Hospital,Sichuan University,Chengdu,Sichuan 610041;3.Sichuan Engineering Technology Research Center of Cosmetic,Chengdu,Sichuan 610041)
Abstract [Objective]To explore the effect and mechanism of the hydrolyzed donkey placenta extract in protecting against light damage,aiming to fill the gap in the research of hydrolyzed donkey placental extract in protecting against UV light damage,and realize the high-value utilization of donkey placenta.[Method]The effects of hydrolyzed donkey placenta extract on the proliferation of HS68 and HaCaT cells were studied by CCK-8 method.The photodamage models of HS68 and HaCaT cells induced by UVA and UVB were established.The protective effects of hydrolyzed donkey placenta extract on HS68 and HaCaT cells damaged by UV were studied.[Result]0.10% -10.00%(V/V) of hydrolyzed donkey placenta extract could significantly promote the growth of HS68 and HaCaT cells; 1.00% and 0.50% (V/V) of hydrolyzed donkey placenta extract could significantly attenuate UVB damage to HaCaT cells,significantly reduce intracellular ROS production and MDA secretion,and significantly increase intracellular SOD enzyme activity.1.00% (V/V) of hydrolyzed donkey placenta extract could significantly reduce the increase of MMP-1,MMP-3 and MMP-9 mRNA expression induced by UVA radiation in HS68 cells,but could not improve the decrease of COL Ⅰ and COL Ⅲ mRNA expression.[Conclusion]The hydrolyzed donkey placenta extract can protect the skin from photodamage caused by UVA and UVB,which may be related to increasing the activity of antioxidant enzymes,reducing the degree of lipid peroxidation,and inhibiting the abnormal secretion of metalloproteinases.06B1975A-ED6D-4890-8ABF-B47D9EA968F3
Key words Hydrolyzed donkey placenta extract;UVA;UVB;Skin cells;Anti-photodamage;Protective effect
胎盘作为妊娠期母体的临时性器官,富含免疫球蛋白、胶原蛋白、激素、生长因子、细胞因子、氨基酸、糖胺聚糖、酶和微量元素等活性成分[1-2],这些活性成分与胎盘提取物的生物活性有着密切的关系[3-4]。现代药理研究表明,胎盘提取物具有抗炎[5]、抗氧化[6]、抗皱[7]、抗过敏[8]、改善黑色素代谢异常[9]、改善皮肤干燥和促进胶原合成[10]等作用,已被用于多种皮肤病的治疗且效果明显,包括接触性皮炎[8]、脱发[11]、痤疮瘢痕[12]和伤口愈合[3]等。鉴于胎盘提取物的良好效果,胎盘提取物广泛应用于临床和美容领域。许多国家开发了胎盘提取物相关护肤产品,如护肤霜、乳液等[3]。已有研究证实,口服猪胎盘提取物能够有效改善皮肤干燥、皮肤屏障功能、弹性和皱纹[13-14]。进一步证实,口服猪胎盘提取物[14]和使用猪胎盘提取物凝胶[15]可有效改善中波紫外线(UVB)造成的氧化损伤、经皮失水量的增加与皱纹形成。有研究证实,猪胎盘提取物能够明显提高UVB光损伤角质形成细胞的活性、降低细胞活性氧自由基(ROS)水平、增加超氧化物歧化酶(SOD)的表达[15-16]。然而,长波紫外线(UVA)穿透能力较强,能直达皮肤真皮层,也是导致光老化的主要原因,目前对于胎盘提取物防护UVA的研究较少。因此,胎盘提取物作为护肤产品的抗光损伤效果和作用机制尚未被全面研究。
化妆品中禁止使用人胎盘和牛胎盘,所以猪胎盘、羊胎盘的使用较为广泛。水解驴胎盘提取物作为一种具有开发前景的护肤品原料,相关应用报道较少。而且,目前有关驴的疫病国内外鲜见相关文献报道[17],可见相比于猪羊,驴胎盘相对安全。因此,笔者利用UVA和UVB分别诱导HS68细胞和HaCaT细胞损伤建立体外光损伤模型,探讨水解驴胎盘提取物(hydrolyzed donkey placenta extract,HDPE)对UV损伤皮肤细胞的保护作用,旨在为水解驴胎盘提取物改善UV造成的光损伤提供了一定的研究基础,填补水解驴胎盘提取物在防护UV光损伤方面的研究空白,实现驴胎盘的高值化利用。
1 材料与方法
1.1 试验材料
1.1.1 试剂。DMEM培养基、胎牛血清(FBS),美国Gibco公司;八肽胆囊收缩素(CCK-8),日本同仁化学研究所;总SOD活性检测试剂盒,南京建成生物研究所;脂质氧化MDA检测试剂盒,上海碧云天生物技术有限公司;Trizol RNA提取试剂,赛默飞世尔科技;反转录试剂盒(HiScript Ⅱ Q Select RT SuperMix for qPCR,+gDNA wiper)、实时荧光定量PCR试剂盒(AceQ qPCR SYBR Green Master Mix),南京诺唯赞生物科技有限公司;引物由成都擎科梓熙生物技术有限公司合成。
1.1.2 试材。永生化人角质形成细胞(HaCaT),中国科学院昆明细胞库;人成纤维细胞(HS68),美国ATCC细胞库;驴胎盘由东阿阿胶股份有限公司提供。
1.1.3 仪器。酶标仪、CFX-connect荧光定量PCR仪,美国Bio-Bad公司;倒置荧光显微镜,日本Olympus公司;ND-2000超微量核酸蛋白测定仪,美国Nano Drop公司;SS-04A型UVA仪、SS-04B型UVB仪,上海适玛公司。
1.2 试验方法
1.2.1 HDPE的制备。取新鲜驴胎盘样品,先用生理盐水冲洗干净,并用手术器械去除筋膜和脐带。然后用自来水清洗数次,直至去除淤血。脱水绞碎后,1∶1加入蒸馏水,再加入MgCl2,加热到70 ℃后保持30 min。经木瓜蛋白酶和胰蛋白酶酶解,灭酶后过滤,上清液经0.22 μm滤膜过滤后,即为水解驴胎盘提取物。
1.2.2 HDPE对细胞存活率的影响。HaCaT细胞、HS68细胞用含10%胎牛血清的DMEM培养基于37 ℃、5% CO2的培养箱内培养。将培养皿中生长至80%左右的HaCaT细胞、HS68细胞回收至离心管中,通过细胞计数仪计数,按照2.0×104~8.0×104 cells/孔接种至24孔细胞培养板中,培养24 h。试验分为HDPE处理组(25.00%、10.00%、1.00%、0.10%、0.01%,V/V)和空白对照组。在37 ℃培养箱中继续培养24 h。培养板内加入适量CCK-8 后培养4 h,测定450 nm吸光度,计算细胞在HDPE各体积分数作用下的存活率。
1.2.3 细胞分组处理。培养皿中生长至80%左右的HaCaT细胞,按照3.0×105~4.0×105 cells/孔接种至6孔细胞培养板中,培养24 h。试验分为空白对照组、模型对照组和HDPE处理组(1.00%、0.50%和0.10%,V/V)。根据试验分组设定,分别将配制好的待测物添加至HaCaT细胞内,在37 ℃培养箱中培养过夜24 h。倒掉培养液,每孔添加2 mL磷酸盐缓冲液(PBS),放置于UVB辐照仪下,辐照能量30 mJ/cm2。空白对照组不照射UVB。弃去PBS,换成不含血清的培养基,培养6 h后,Trizol处理细胞并收集细胞用于mRNA表达检测。
将融合至约80%的HS68细胞按照3.0×105~4.0×105 cells/孔接种于6孔板中,置于37 ℃、5% CO2恒温培养箱中培养24 h。弃培养基,加入PBS,经5 J/cm2 UVA輻射后,分为UVA对照组(加DMEM培养基)和HDPE处理组(1.00%、0.50%、0.10%,V/V)。培养6 h后,Trizol处理细胞并收集细胞用于mRNA表达检测。06B1975A-ED6D-4890-8ABF-B47D9EA968F3
1.2.4 UV辐照后水解驴胎盘提取物对细胞存活率的影响。同“1.2.2”的方法测定UV 辐照后水解驴胎盘提取物对细胞存活率的影响。
1.2.5 细胞氧化水平的测定。细胞内超氧化物歧化酶(SOD)、脂质氧化产物丙二醛(MDA)的测定按照试剂盒的说明进行检测。
1.2.6 细胞内胶原蛋白mRNA表达的测定。
Trizol处理细胞后,提取总RNA,根据试剂盒反转录cDNA,以 cDNA 为模板扩增MMP-1、MMP-3、MMP-9、COL Ⅰ、COL Ⅲ,在预试验探索出的反应条件下进行RT-PCR 反应。基因引物序列见表1。统计Ct值,计算相对表达情况进行结果分析。
1.3 统计分析
应用SPSS 17.0统计软件进行数据分析,试验重复3次,数据结果以均数±标准差(±S)表示。多组数据差异比较采用方差分析,两组间差异比较采用t检验。
2 结果与分析
2.1 HDPE对UVB所诱导的HaCaT细胞损伤的保护作用
2.1.1 HDPE对HaCaT细胞存活率的影响。
采用CCK-8测定HDPE对HaCaT细胞存活率的影响,结果如图1所示。水解驴胎盘提取物对HaCaT细胞存活率的影响受处理浓度调控,当给药浓度在25.00%时,驴胎盘提取物对HaCaT细胞具有明显的抑制效果(P<0.01);给药浓度在0.10%~10.0%,驴胎盘提取物可显著促进HaCaT细胞生长(P<0.01)。由此可 见,10.00%及以下浓度为HDPE处理HaCaT细胞的安全浓度。
2.1.2 HDPE对HaCaT细胞增殖的影响。
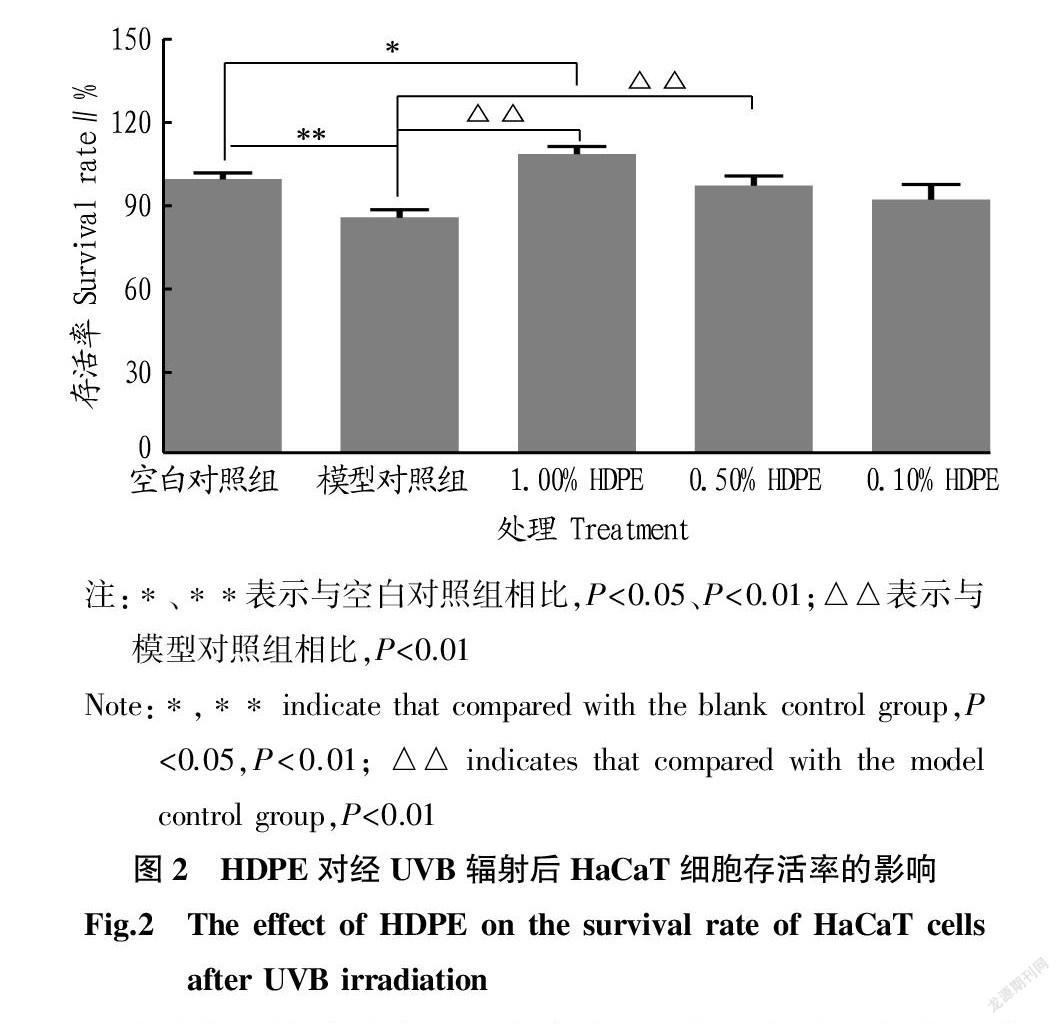
HDPE以剂量依赖方式防护UVB辐射造成的HaCaT细胞损伤,见图2。与空白对照组相比,UVB辐射模型组细胞存活率降低至86.11%,差异具有统计学意义(P<0.01),表明UVB辐射模型构建成功。与模型组相比,提前加入1.00%、0.50%和0.10%的HDPE分别使细胞存活率提升23.06%、11.59%和6.53%,其中1.00%和0.50%差异显著(P<0.01)。可见,1.00%、0.50%的HDPE能够显著改善UVB造成的HaCaT细胞损伤。
2.1.3 HDPE对细胞SOD活性的影响。
过量的UV辐射皮肤后,促使机体产生大量ROS,当积聚在体内的ROS超过机体正常清除自由基的能力时,会对机体产生破坏性的生物学效应。SOD是生物体主要的抗氧化酶之一,能通过多种内源性细胞防御系统清除产生的氧自由基,防止脂质过氧化及其中间代谢产物对机体的损害。采用商品化试剂盒测定细胞内SOD活性,结果如图3所示。与模型组相比,1.00%和0.50% HDPE处理过的细胞SOD活性分别增高9.83%和8.75%,但差异不具有统计学意义(P>0.05)。
2.1.4 HDPE对细胞MDA含量的影响。过量UVB照射皮肤,导致ROS大量积累,ROS不仅破坏细胞本身抗氧化酶,而且破坏细胞DNA、蛋白质,引起细胞脂质过氧化,导致氧化产物MDA含量增加,影响线粒体呼吸链复合物及线粒体内关键酶活性。MDA作为细胞脂质过氧化的终产物,可反映膜脂质过氧化的程度。采用商品化试剂盒测定细胞MDA含量,结果如图4所示,与空白对照组比较,模型组细胞MDA含量显著增加(P<0.05),表明HaCaT细胞正常的抗氧化能力受到损伤,细胞膜的结构和功能遭到一定程度破坏。与模型组相比,1.00%、0.50%和0.10%的HDPE对细胞MDA含量增加有抑制作用,抑制率分别为105.00%、85.00%和16.87%,1.00%和0.50%组差异具有统计学意义(P<0.01),表明HDPE能一定程度抑制HaCaT细胞MDA含量,修复UVB辐射造成的细胞膜氧化损伤。
2.2 HDPE对UVA所诱导的HS68细胞损伤的保护作用
2.2.1 HDPE对HS68细胞存活率的影响。从图5可以看出,HDPE浓度在10.00%~25.00%时,HDPE显著抑制HS68细胞生长(P<0.01);HDPE浓度在0.01%~1.00%时,HDPE显著促进HS68细胞生长(P<0.01)。结果表明,1.00%及以下浓度是HDPE对HS68细胞的安全浓度。
2.2.2 HDPE对胶原mRNA表达的影响。胶原是皮肤真皮层的主要成分,由Ⅰ型胶原(type Ⅰ collage,COL Ⅰ;85%~90%)、Ⅲ型胶原(type Ⅲ collage,COL Ⅲ;10%~15%)和其他类型胶原构成,是皮肤强度和弹性的物质基础。UV辐射可通过诱导 Ⅰ 型和 Ⅲ 型胶原的基因表达下调,引发成熟胶原的降解和影响胶原蛋白的合成[18-19],导致皮肤弹性下降,产生松弛、皱纹等现象[20]。UVA照射导致HS68细胞COL Ⅰ和COL Ⅲ mRNA表达下降,但是HDPE在试验研究剂量范围内并不能改善此效果(图6)。与模型组相比,加入HDPE后的HS68细胞的COL Ⅰ、COL Ⅲ的mRNA表达均显著下降 (P<0.01)。说明试验剂量范围内,HDPE不能修复UVA辐射造成的HS68细胞COL Ⅰ和COL Ⅲ mRNA表达的下降。
2.2.3 HDPE对MMPs mRNA表达的影响。
基质金属蛋白酶(matrix metalloproteinases,MMPs)在关节炎、皮肤老化、肿瘤侵袭和转移等疾病病理过程中的组织破坏中起重要作用[21]。UV通过激活细胞信号转导通路诱导表皮和真皮细胞MMP-1、MMP-3和MMP-9的表达,降解真皮细胞外基质的胶原蛋白和其他蛋白[22]。经UV辐射后,皮肤角质形成细胞与成纤维细胞合成分泌的MMP-1和MMP-3量及其mRNA水平显著增加[23]。利用RT-PCR技术分析HDPE对UVA辐射HS68细胞MMP-1、MMP-3和MMP-9 mRNA表达的影响,结果发现(图7),HDPE以剂量依赖方式影响MMP-1、MMP-3和MMP-9 mRNA的表达。与模型组相比,1.00%、0.50%和0.10%的HDPE均显著降低MMP-1的表达(P<0.01),1.00%的HDPE均显著降低MMP-3和MMP-9 mRNA的表达(P<0.01),但是0.50%和0.10%的HDPE显著增加MMP-3和MMP-9 mRNA的表達(P<0.01)。试验结果表明,使用1.00%的HDPE可显著缓解UVA辐射HS68细胞所致MMP-1、MMP-3和MMP-9 mRNA表达的增加,从而减少UVA对胶原蛋白的降解。06B1975A-ED6D-4890-8ABF-B47D9EA968F3
3 讨论
紫外辐射、空气污染、不良生活习惯等均能导致皮肤老化,而紫外辐射是造成皮肤光老化的最主要因素。紫外线包含UVA、UVB、UVC,其中UVC在通过臭氧层时大部分被吸收,到达地球表面的紫外线主要包含UVA和UVB。紫外辐射对皮肤产生的影响包括色素沉着、皮肤老化、皮肤癌症易感性增加以及毛细血管扩张等。UVA诱导产生ROS,过量ROS引起机体多种生物学效应,如脂质过氧化、激活转录因子和产生DNA链断裂等[24],导致MMPs累积、弹性蛋白变性、胶原蛋白降解,造成皮肤光老化。UVB可通过直接损伤DNA或诱导产生自由基等机制损害皮肤[24],是产生良性或恶性肿瘤的主要因素[25]。因此,寻找有效的抗光老化方法已成为研究热点。多项研究表明,口服胎盘提取物具有显著的抗氧化活性,能够有效改善UVB造成皮肤损伤和老化,但胎盘提取物是否对UVA造成的光老化有保护作用鲜见报道。
该试验研究发现,1.00%、0.50%的水解驴胎盘提取物能够明显提高UVB光损伤HaCaT细胞活性,与Park等[15]的报道一致。1.00%、0.50%的水解驴胎盘提取物能够提高SOD活性,降低MDA含量。Yamasaki等[16]研究证实,猪胎盘提取物能够增加UV辐射的黑色素瘤细胞SOD-1、SOD-3和过氧化酶的表达,但是对SOD-2的表达没有影响。然而,Yoshimoto等[26]研究发现猪胎盘提取物调节正常黑色素细胞的黑色素合成可能与SOD-2酶参与的线粒体呼吸有关;去除渗出物和不溶性物质(包括脂质)的猪胎盘提取物反而能够促进黑色素的合成和抑制SOD-2酶表达。因此,推测胎盘提取物所含功效成分不同,可能是导致研究结果有差异的原因之一。Park等[27]利用动物试验证实,甘氨酰-L-亮氨酸、L-亮氨酰-甘氨酸是胎盘提取物保护皮肤免受UVB损伤的主要功效物质。因此,需进一步明确水解驴胎盤提取物防护光老化的主要功效成分与具体作用通路。
1.00%的水解驴胎盘提取物可显著缓解UVA辐射所致MMP-1、MMP-3和MMP-9 mRNA表达的增加。Hong等[14]也报道猪胎盘物能够显著降低MMP-2、MMP-9的表达量。多项研究结果表明,胎盘提取物能够有效改善皮肤弹性与皱纹[7,13-14]。Ⅰ 型胶原和Ⅲ型胶原是皮肤强度和弹性的主要物质基础,推测胎盘提取物能够有效提升 Ⅰ 型胶原和Ⅲ型胶原的表达。该试验研究发现,0.10%~1.00%的水解驴胎盘蛋白并不能改善UVA造成 Ⅰ 型胶原和Ⅲ型胶原表达的下降。因此,需进一步全面研究水解驴胎盘提取物对UVA的防护作用,考虑是不是与水解驴胎盘提取物种的成分有关。
综上所述,该试验研究证实水解驴胎盘提取物对UVA和UVB导致的细胞光损伤均有保护作用,推测其机制与提高抗氧化酶活性、降低脂质过氧化程度、抑制金属蛋白酶的异常分泌有关。该试验对水解驴胎盘提取物抗皮肤光老化作用及其机制进行了研究,填补水解驴胎盘提取物在防护UV光损伤方面的研究空白,旨在实现驴胎盘的高值化利用,增加农民收入,提升农民养驴积极性。
参考文献
[1]
TOGASHI S I,TAKAHASHI N,IWAMA M,et al.Antioxidative collagen-derived peptides in human-placenta extract[J].Placenta,2002,23(6):497-502.
[2] 李小梅.猪胎盘肽冻干粉的制备及功效考察[D].扬州:扬州大学,2016:10-13,42-53.
[3] CHAKRABORTY P D,BHATTACHARYYA D.Isolation of fibronectin type III like peptide from human placental extract used as wound healer[J].Journal of chromatography B,2005,818(1):67-73.
[4] DE D,CHAKRABORTY P D,BHATTACHARYYA D.Analysis of free and bound NADPH in aqueous extract of human placenta used as wound healer[J].Journal of chromatography B,2009,877(24):2435-2442.
[5] TEBAKARI M,DAIGO Y,ISHIKAWA H,et al.Anti-inflammatory effect of the water-soluble portion of porcine placental extract in lipopolysaccharide-stimulated RAW264.7 murine macrophage cells[J].Biological & pharmaceutical bulletin,2018,41(8):1251-1256.
[6] PARK S Y,PHARK S,LEE M,et al.Anti-oxidative and anti-inflammatory activities of placental extracts in benzo[a]pyrene-exposed rats[J].Placenta,2010,31(10):873-879.
[7] YOSHIKAWA C,KOIKE K,TAKANO F,et al.Efficacy of porcine placental extract on wrinkle widths below the eye in climacteric women[J].Climacteric,2014,17(4):370-376.06B1975A-ED6D-4890-8ABF-B47D9EA968F3
[8] JASH A,KWON H K,SAHOO A,et al.Topical application of porcine placenta extract inhibits the progression of experimental contact hypersensitivity[J].Journal of ethnopharmacology,2011,133(2):654-662.
[9] PAL P,MALLICK S,MANDAL S K,et al.A human placental extract:in vivo and in vitro assessments of its melanocyte growth and pigment-inducing activities[J].International journal of dermatology,2002,41(11):760-767.
[10] CHO H R,RYOU J H,LEE J W,et al.The effects of placental extract on fibroblast proliferation[J].Journal of cosmetic science,2008,59(3):195-202.
[11] BARAT T,ABDOLLAHIMAJD F,DADKHAHFAR S,et al.Evaluation of the efficacy and safety of cow placenta extract lotion versus minoxidil 2% in the treatment of female pattern androgenetic alopecia[J].International journal of women′s dermatology,2020,6(4):318-321.
[12] PHONCHAI R,NAIGOWIT P,UBONSAEN B,et al.Improvement of atrophic acne scar and skin complexity by combination of aqueous human placenta extract and mesenchymal stem cell mesotherapy[J].Journal of cosmetics,dermatological sciences and applications,2020,10(1):1-7.
[13] NAGAE M,NAGATA M,TERAMOTO M,et al.Effect of porcine placenta extract supplement on skin condition in healthy adult women:A randomized,double-blind placebo-controlled study[J].Nutrients,2020,12(6):1-12.
[14] HONG K B,PARK Y,KIM J H,et al.Effects of porcine placenta extract ingestion on ultraviolet B-induced skin damage in hairless mice[J].Korean journal for food science of animal resources,2015,35(3):413-420.
[15] PARK Y,HAN B K,CHOI H S,et al.Effect of porcine placenta extract from subcritical water extraction on photodamage in human keratinocytes[J].Korean society for food science of animal recources,2015,35(2):164-170.
[16] YAMASAKI M,HASEGAWA S,TAKAHASHI H,et al.Placental extracts induce the expression of antioxidant enzyme genes and suppress melanogenesis in B16 melanoma cells[J].Natural product research,2015,29(22):2103-2106.
[17] 劉宪斌,王仁虎,姜桂苗,等.规模驴场主要传染性疫病的流行特点及风险分析[J].黑龙江畜牧兽医,2018(4):99-104.
[18] GRIFFITHS C E,RUSSMAN A N,MAJMUDAR G,et al.Restoration of collagen formation in photodamaged human skin by tretinoin (retinoic acid)[J].New England journal of medicine,1993,329(8):530-535.
[19] FISHER G J,DATTA S,WANG Z Q,et al.C-Jun-dependent inhibition of cutaneous procollagen transcription following ultraviolet irradiation is reversed by all-trans retinoic acid[J].The journal of clinical investigation,2000,106(5):663-670.06B1975A-ED6D-4890-8ABF-B47D9EA968F3
[20] HELFRICH Y R,SACHS D L,VOORHEES J J.Overview of skin aging and photoaging[J].Dermatology nursing,2008,20(3):177-184.
[21] FISHER G J,WANG Z Q,DATTA S C,et al.Pathophysiology of premature skin aging induced by ultraviolet light[J].The New England journal of medicine,1997,337(20):1419-1428.
[22] RIGEL D S,WEISS R A,LIM H W,et al.Photoaging[M].New York:Marcel Dekker,Inc.,2004:5-9,27-28.
[23] 夏濟平,宋秀祖,毕志刚.紫外线对皮肤角质形成细胞和成纤维细胞产生MMP-1和MMP-3的影响 [J].中国麻风皮肤病杂志,2006,22(1):11-13.
[24] ICHIHASHI M,UEDA M,BUDIYANTO A,et al.UV-induced skin damage[J].Toxicology,2003,189(1/2):21-39.
[25] TRUCHUELO M T,JIMNEZ N,MIGUEL-GOMEZ L,et al.Histological and immunohistochemical evaluation of the efficacy of a new cosmetic formulation in the treatment of skin photoaging[J].Dermatology research and practice,2017,2017:1-10.
[26] YOSHIMOTO S,OHAGI Y,YOSHIDA M,et al.Placental extracts regulate melanin synthesis in normal human melanocytes with alterations of mitochondrial respiration[J].Experimental dermatology,2019,28(S1):50-54.
[27] PARK J I,LEE J E,SHIN H J,et al.Oral administration of glycine and leucine dipeptides improves skin hydration and elasticity in uvb-irradiated hairless mice[J].Biomolecules & therapeutics,2017,25(5):528-534.06B1975A-ED6D-4890-8ABF-B47D9EA968F3

